Daratumumab単剤療法
ダラツムマブ (ダラキューロ®)
DARA:ダラツムマブ(ダラキューロ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,800mg/body 皮下注射 | 1~2 | Day 1, 8, 15, 22 |
| 1,800mg/body 皮下注射 | 3~6 | Day 1, 15 |
| 1,800mg/body 皮下注射 | 7~39 | Day 1 |
前投薬
| 本剤によるinfusion reaction軽減のため、 投与開始1~3時間前に副腎皮質ホルモン、 解熱鎮痛剤、 抗ヒスタミン剤を前投与する。 遅発性反応の軽減には、 必要に応じて投与後に副腎皮質ホルモン等を追加する。 |
その他
「高リスクのくすぶり型多発性骨髄腫 (SMM) における進展遅延」 に対して、 2025年2月14日承認申請、 2025年11月20日承認
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ダラキューロ® (ダラツムマブ:DARA)
*ヤンセンファーマ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】28日間
【催吐性】最小度
【FN発症】低リスク*
*AQUILA試験のFN発症率0%²⁾を基に編集部が分類
▼1~2サイクル
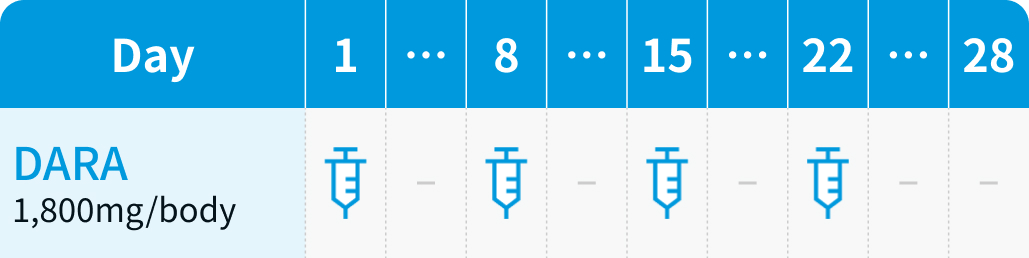
▼3~6サイクル
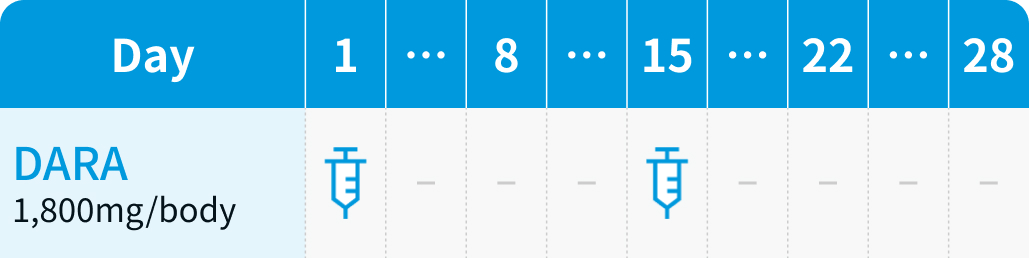
▼7~39サイクル
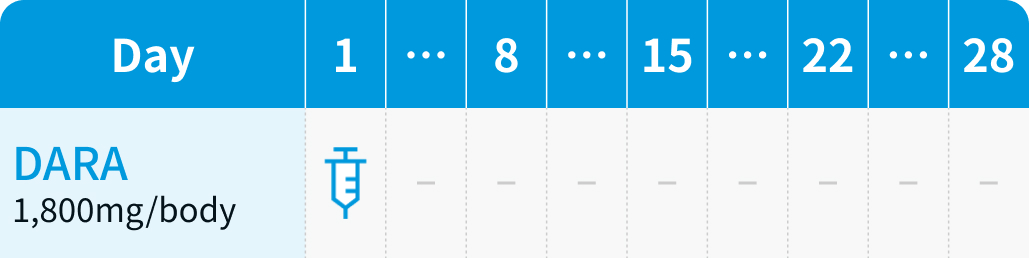
ダラツムマブ1,800mg+ボルヒアルロニダーゼ アルファ30,000単位 (15mL) を28日周期で、 第1~2サイクルは週1回×4回 (1、 8、 15、 22日目)、 第3~6サイクルは2週ごとに2回 (1、 15日目)、 第7サイクル以降は4週ごとに1回 (1日目) 皮下投与し、 投与期間は最大3年間とする。
AQUILA試験³⁾では、 infusion reaction予防として、 DARA投与1~3時間前にメチルプレドニゾロン (初回2回は100mg、 以降60mg)、 アセトアミノフェン650~1,000mg、 抗ヒスタミン薬 (ジフェンヒドラミン25~50mgなど) を前投与し、 モンテルカスト10mg (1サイクルDay1のみ) を追加することが推奨された。 また、 後投薬としてメチルプレドニゾロン20mg相当量を投与翌日から2日間投与することが推奨された。
Key Data|臨床試験結果
📊 AQUILA試験
N Engl J Med. 2025;392(18):1777-1788.
未治療・高リスクのくすぶり型多発性骨髄腫 (SMM) 患者390例を対象とした非盲検・第Ⅲ相無作為化比較試験。 ダラツムマブ単剤療法群194例と積極的経過観察群196例に1:1の比率で割り付け、 主要評価項目としてPFS (IMWG診断基準に基づく活動性MMへの進行) が設定された。
【有効性】ダラツムマブ群 (vs 経過観察群)
- 5年PFS 63.1% (vs 40.8%)
- HR 0.49、 95%CI 0.36–0.67、 p<0.001)
- 5年OS 93.0% (vs 86.9%)
- 5年時の1次治療開始率 29.7% (vs 55.9%)
- ORR 29.9% (vs 1.0%)
【安全性】主な有害事象 : 全Grade
- 疲労 34.2%
- 上気道感染 30.1%
- 下痢 27.5%
- 関節痛 26.9%
- 鼻咽頭炎 25.4%
- 背部痛 23.8%
- 不眠症 22.3%
各プロトコル
適格基準
AQUILA試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球≧1,000/μL
- 血小板≧5万/μL
- 肝機能 : T-Bil≦2xULN、 AST/ALT≦2.5xULN
腎障害患者に対する用量調整
抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
有害事象発現時の減量・休薬・中止基準
Infusion reaction発現時の対応¹⁾ : Grade 3が3回発現した場合、 またはGrade 4が発現した場合は投与中止。
AQUILA試験³⁾の基準 : ダラツムマブの減量は認められず、 以下の基準に従って対応し、 回復後は同量で再開する。
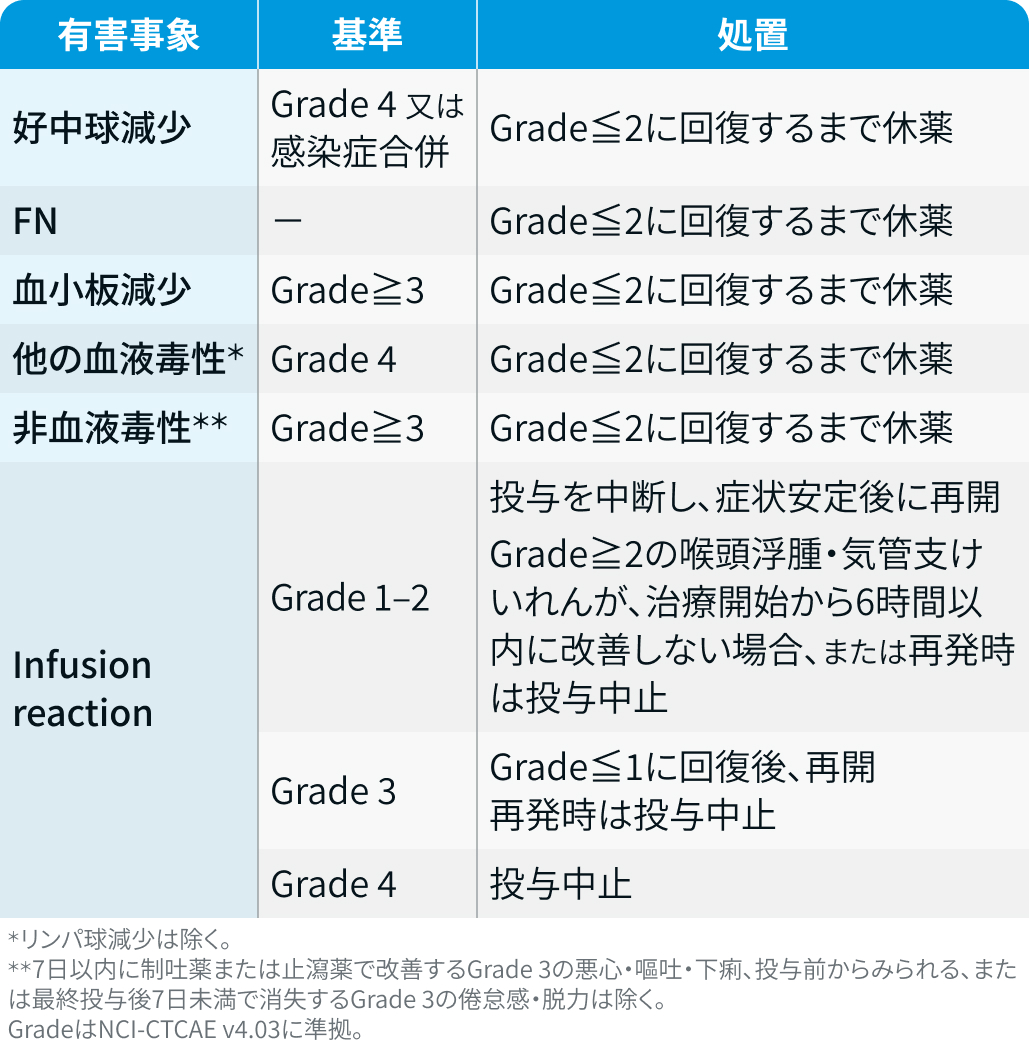
AQUILA試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
レジメンの位置付け
ダラツムマブは、 高リスクSMMに対する初の早期介入薬として位置付けられる。 従来は経過観察が基本であったSMM管理に、 予防的治療という新たな選択肢を提供する点が特徴である。
作用機序の特徴
ダラツムマブはヒトCD38に結合し、 CDC、 ADCC、 ADCPなどを介して腫瘍増殖を抑制すると考えられている。 ボルヒアルロニダーゼ アルファは結合組織のヒアルロン酸を加水分解する酵素であり、 皮下組織での浸透性を高めることで、 拡散吸収されたダラツムマブによる抗腫瘍効果を促すと考えられている。
レジメン適用時の注意事項
骨髄抑制 : 投与前および投与中は定期的に血液検査を行い、 骨髄抑制の有無を確認する。
輸血前検査への干渉 (CD38発現) : 本剤は赤血球上のCD38と結合し、 間接クームス試験が偽陽性となる可能性があり、 この干渉は最終投与後6ヵ月程度持続し得る。 本剤投与前に不規則抗体スクリーニングを含む輸血前検査を実施し、 輸血予定がある場合は関連部署へ周知する。
腫瘍崩壊症候群 (TLS) : TLS発現の可能性があるため、 電解質・腎機能を確認しながら十分に観察する。
HBV再活性化 : HBV再活性化による肝炎のリスクがあるため、 投与前にHBV感染の有無を確認し、 必要な処置を行う。
RMP【重要な特定されたリスク】
ダラキューロ® : 医薬品リスク管理計画書 (RMP)
- Infusion reaction
- 間接クームス試験への干渉
- 骨髄抑制
- 感染症
- 腫瘍崩壊症候群
出典
1) ヤンセンファーマ株式会社. ダラキューロ®配合皮下注 電子添文 (2025年11月改訂 第8版)
2) ヤンセンファーマ株式会社. ダラキューロ配合皮下注 適正使用ガイド (2025年11月改訂)
3) N Engl J Med. 2025;392(18):1777-1788.
最終更新 : 2025年11月25日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Daratumumab単剤療法
DARA:ダラツムマブ(ダラキューロ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,800mg/body 皮下注射 | 1~2 | Day 1, 8, 15, 22 |
| 1,800mg/body 皮下注射 | 3~6 | Day 1, 15 |
| 1,800mg/body 皮下注射 | 7~39 | Day 1 |
前投薬
| 本剤によるinfusion reaction軽減のため、 投与開始1~3時間前に副腎皮質ホルモン、 解熱鎮痛剤、 抗ヒスタミン剤を前投与する。 遅発性反応の軽減には、 必要に応じて投与後に副腎皮質ホルモン等を追加する。 |
その他
概要
「高リスクのくすぶり型多発性骨髄腫 (SMM) における進展遅延」 に対して、 2025年2月14日承認申請、 2025年11月20日承認
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ダラキューロ® (ダラツムマブ:DARA)
*ヤンセンファーマ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】28日間
【催吐性】最小度
【FN発症】低リスク*
*AQUILA試験のFN発症率0%²⁾を基に編集部が分類
▼1~2サイクル

▼3~6サイクル

▼7~39サイクル

ダラツムマブ1,800mg+ボルヒアルロニダーゼ アルファ30,000単位 (15mL) を28日周期で、 第1~2サイクルは週1回×4回 (1、 8、 15、 22日目)、 第3~6サイクルは2週ごとに2回 (1、 15日目)、 第7サイクル以降は4週ごとに1回 (1日目) 皮下投与し、 投与期間は最大3年間とする。
AQUILA試験³⁾では、 infusion reaction予防として、 DARA投与1~3時間前にメチルプレドニゾロン (初回2回は100mg、 以降60mg)、 アセトアミノフェン650~1,000mg、 抗ヒスタミン薬 (ジフェンヒドラミン25~50mgなど) を前投与し、 モンテルカスト10mg (1サイクルDay1のみ) を追加することが推奨された。 また、 後投薬としてメチルプレドニゾロン20mg相当量を投与翌日から2日間投与することが推奨された。
Key Data|臨床試験結果
📊 AQUILA試験
N Engl J Med. 2025;392(18):1777-1788.
未治療・高リスクのくすぶり型多発性骨髄腫 (SMM) 患者390例を対象とした非盲検・第Ⅲ相無作為化比較試験。 ダラツムマブ単剤療法群194例と積極的経過観察群196例に1:1の比率で割り付け、 主要評価項目としてPFS (IMWG診断基準に基づく活動性MMへの進行) が設定された。
【有効性】ダラツムマブ群 (vs 経過観察群)
- 5年PFS 63.1% (vs 40.8%)
- HR 0.49、 95%CI 0.36–0.67、 p<0.001)
- 5年OS 93.0% (vs 86.9%)
- 5年時の1次治療開始率 29.7% (vs 55.9%)
- ORR 29.9% (vs 1.0%)
【安全性】主な有害事象 : 全Grade
- 疲労 34.2%
- 上気道感染 30.1%
- 下痢 27.5%
- 関節痛 26.9%
- 鼻咽頭炎 25.4%
- 背部痛 23.8%
- 不眠症 22.3%
各プロトコル
適格基準
AQUILA試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球≧1,000/μL
- 血小板≧5万/μL
- 肝機能 : T-Bil≦2xULN、 AST/ALT≦2.5xULN
腎障害患者に対する用量調整
抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
有害事象発現時の減量・休薬・中止基準
Infusion reaction発現時の対応¹⁾ : Grade 3が3回発現した場合、 またはGrade 4が発現した場合は投与中止。
AQUILA試験³⁾の基準 : ダラツムマブの減量は認められず、 以下の基準に従って対応し、 回復後は同量で再開する。

AQUILA試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
レジメンの位置付け
ダラツムマブは、 高リスクSMMに対する初の早期介入薬として位置付けられる。 従来は経過観察が基本であったSMM管理に、 予防的治療という新たな選択肢を提供する点が特徴である。
作用機序の特徴
ダラツムマブはヒトCD38に結合し、 CDC、 ADCC、 ADCPなどを介して腫瘍増殖を抑制すると考えられている。 ボルヒアルロニダーゼ アルファは結合組織のヒアルロン酸を加水分解する酵素であり、 皮下組織での浸透性を高めることで、 拡散吸収されたダラツムマブによる抗腫瘍効果を促すと考えられている。
レジメン適用時の注意事項
骨髄抑制 : 投与前および投与中は定期的に血液検査を行い、 骨髄抑制の有無を確認する。
輸血前検査への干渉 (CD38発現) : 本剤は赤血球上のCD38と結合し、 間接クームス試験が偽陽性となる可能性があり、 この干渉は最終投与後6ヵ月程度持続し得る。 本剤投与前に不規則抗体スクリーニングを含む輸血前検査を実施し、 輸血予定がある場合は関連部署へ周知する。
腫瘍崩壊症候群 (TLS) : TLS発現の可能性があるため、 電解質・腎機能を確認しながら十分に観察する。
HBV再活性化 : HBV再活性化による肝炎のリスクがあるため、 投与前にHBV感染の有無を確認し、 必要な処置を行う。
RMP【重要な特定されたリスク】
ダラキューロ® : 医薬品リスク管理計画書 (RMP)
- Infusion reaction
- 間接クームス試験への干渉
- 骨髄抑制
- 感染症
- 腫瘍崩壊症候群
出典
1) ヤンセンファーマ株式会社. ダラキューロ®配合皮下注 電子添文 (2025年11月改訂 第8版)
2) ヤンセンファーマ株式会社. ダラキューロ配合皮下注 適正使用ガイド (2025年11月改訂)
3) N Engl J Med. 2025;392(18):1777-1788.
最終更新 : 2025年11月25日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。







