DDGP (DEX + CDDP + GEM + pegaspargase)
デキサメタゾン + シスプラチン + ゲムシタビン + ペグアスパルガーゼ
DEX:デキサメタゾン(デキサート®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 15mg/m² | 1~6 | Day 1~5 |
CDDP:シスプラチン(シスプラチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 20mg/m² | 1~6 | Day 1~4 |
GEM:ゲムシタビン(ゲムシタビン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 800mg/m² | 1~6 | Day 1、8 |
Pegaspargase:ペグアスパルガーゼ(オンキャスパー®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2,500国際単位/m² | 1~6 | Day 1 |
前投薬
| オンキャスパー®投与の30〜60分前に、解熱鎮痛剤・抗ヒスタミン剤・副腎皮質ホルモン剤などの前投与を考慮する。 |
その他
| 本邦添付文書では、オンキャスパー®は22歳以上に2,000国際単位/m²を2週間隔で投与とされており、本レジメンとは投与量・スケジュールが異なるため注意が必要。 |
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- デキサート® (添付文書)
- シスプラチン® (添付文書)
- ゲムシタビン® (添付文書)
*日本セルヴィエ株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】21日間
【催吐性】高度*
【FN発症】未報告**
*制吐薬適正使用ガイドラインではCDDPは用量に関わらず高度催吐性リスクに分類
**ピボタル試験³⁾ではFNの報告はないが、 Grade 3以上の好中球減少が高頻度に認められており、 十分な注意が必要

1–5日目にデキサメタゾン (DEX) 15mg/m²、 1–4日目にシスプラチン (CDDP) 20mg/m²、 1日目および8日目にゲムシタビン (GEM) 800mg/m²を点滴静脈し、 1日目にペグアスパルガーゼ2,500 IU/m² (最大3,750 IU) を1–2時間かけて点滴静脈する治療を、 21日間隔で最大6サイクル実施
添付文書では、 オンキャスパー®は22歳以上に2,000 IU/m²を2週間隔で投与とされており、 本レジメンとは投与量・スケジュールが異なるため注意。
Key Data|臨床試験結果
📊 中国・多施設第III相無作為化比較試験³⁾
JAMA Oncol. 2022;8(7):1035-1041.
新たに診断された進行期 (IIIまたはIV期) の節外性NK/T細胞リンパ腫 (ENKL) 患者87例を対象に、 DDGP群 (43例) とSMILE群 (44例) に1対1で無作為に割り付けた、 多施設共同の非盲検無作為化比較試験。 主要評価項目はPFSとされた。
SMILE療法 : 21日を1コースとして、 MTX 2g/m² (day1, 20%静注2h+80%点滴4h)、 DEX 40mg (day2–4, 点滴)、 IFO 1.5g/m² (day2–4, 点滴)、 L-ASP 6000U/m² (最大10000U, day3–9, 点滴)、 VP-16 100mg/m² (day2–4, 点滴)、 Mesna併用。
【有効性】DDGP群 (vs SMILE群)
- PFS中央値 : 未到達 (vs 6.8ヵ月)
- HR 0.42 (95%CI 0.23–0.77)
- 3年PFS率 : 56.6% (vs 41.8%)
- OS中央値 : 未到達 (vs 75.2ヵ月)
- HR 0.41 (95%CI 0.19–0.89)
- 5年OS率 : 74.3% (vs 51.7%)
- 全奏効率 : 90.0% (vs 60.0%)
- 完全奏効率 : 67.5% (vs 47.5%)
【安全性】両群における有害事象の発現率は以下のとおり : Grade1–2 (Grade≧3)。
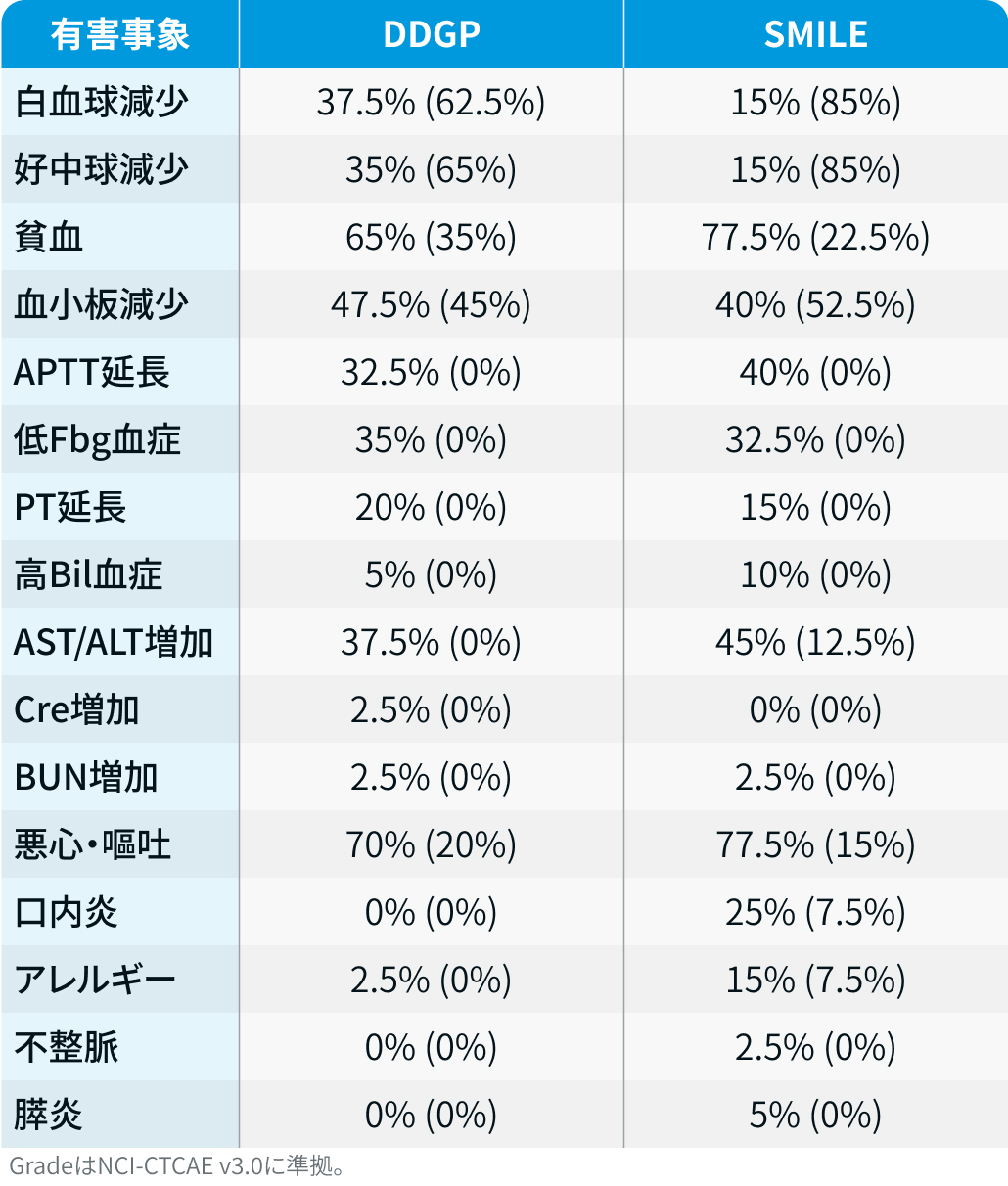
出典³⁾を基に編集部作成
各プロトコル
適格基準
ピボタル試験³⁾の主な適格基準
- 年齢 14~70歳
- ECOG PS 0-2
- ヘモグロビン≧9.0g/dL
- 好中球数≧1,500/μL
- 血小板数≧10万/μL
- 腎機能 : 血清クレアチニン ≦1.5×ULN
- 肝機能 : AST/ALT≦2×ULN、 血清ビリルビン ≦1.5×ULN
腎障害患者に対する用量調整
CDDP⁴⁾ :
- 重篤な腎障害例への投与は禁忌
- CrCl 46~60mL/minでは75%、 31~45mL/minでは50%に減量し、 CrCl≦30mL/minでは投与を推奨しない
- 別の報告 : CrCl 30~49mL/minでは75%、 10~29mL/minでは投与が必要な場合に75%、 CrCl<10mL/minでは投与が必要な場合に50%に減量
GEM⁴⁾ : 腎機能低下や透析時の減量は原則不要。 ただし、 代謝産物dFdUは腎機能低下時に蓄積しやすく、 皮膚障害などの有害事象が増える可能性があるため注意
ペグアスパルガーゼ : 代謝・排泄は主にプロテアーゼによる分解および網内系による除去であり、 腎障害時に減量は不要と考えられる
アスパラギナーゼの薬物動体を参考に、 編集部が評価
有害事象発現時の減量・休薬・中止基準
ピボタル試験³⁾では、 有害事象発現時の対応として以下の管理が定められていた。

一方、 オンキャスパー®の電子添付文書¹⁾には、 次のような対応が明記されている。
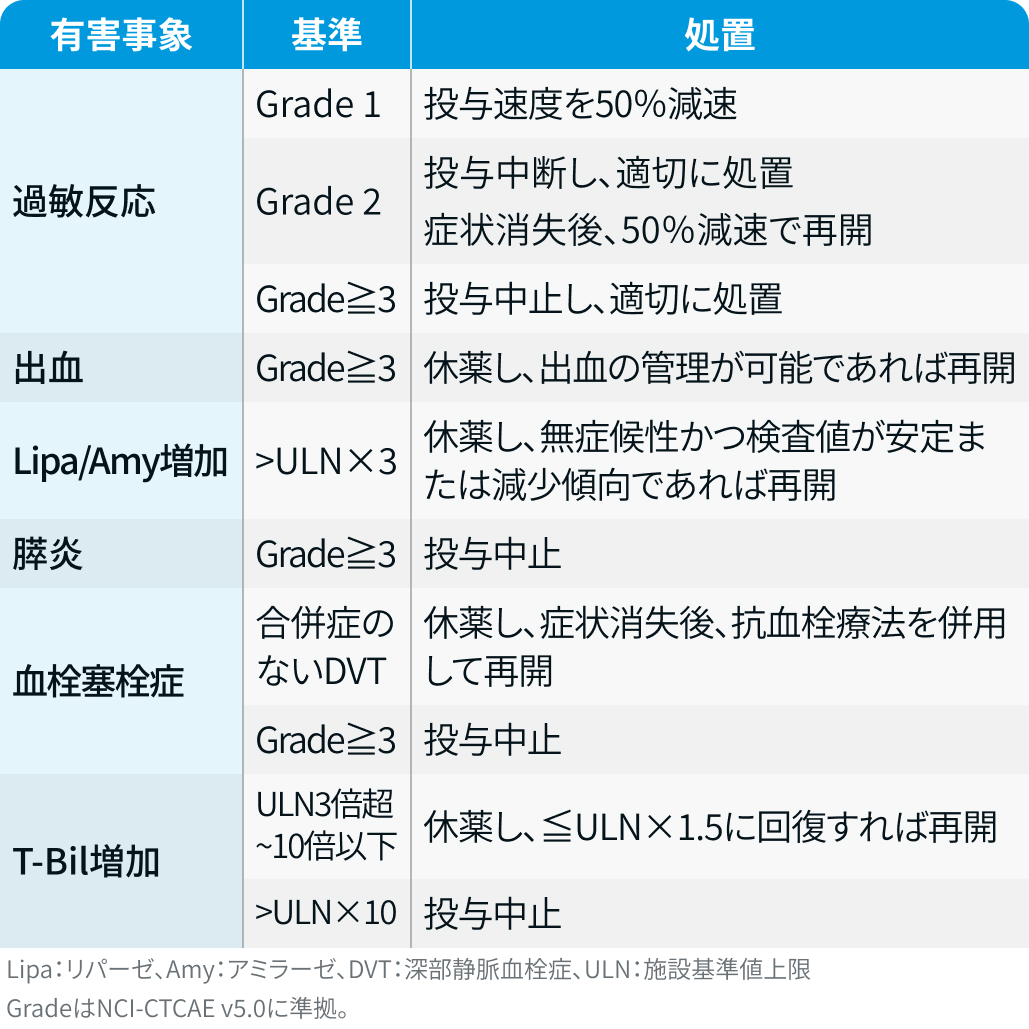
オンキャスパー電子添文¹⁾を基に編集部作成
レジメンの特徴と注意点
🧑⚕️進行期ENKLに対して、 DDGP療法はSMILE療法と比較して毒性を増加させることなくPFSおよびOSを延長することが示されている³⁾。 NCCNガイドラインではSMILE変法と並んで推奨されているが、 造血器腫瘍診療ガイドライン2024年版には記載がない。 エビデンスはなお限定的であり、 慎重な運用が求められる。
東海大学医学部血液腫瘍内科 扇屋大輔先生
本レジメンの位置付け
ENKLの標準治療は未確立であり、 原則として臨床試験への参加が推奨される。 NCCNガイドラインでは、 DDGP療法がSMILE療法変法と並び、 ステージIII/IVの鼻型ENKLおよびステージI~IVの鼻腔外ENKLに対する多剤併用化学療法の推奨レジメンの一つと位置付けられている。
日本でも2023年6月、 ペグアスパラギナーゼが悪性リンパ腫を対象に承認されたが、 最適な併用レジメンに関するエビデンスは依然として限定的であり、 慎重な運用が求められる。
レジメン適用時の注意事項
過敏症 : アナフィラキシーを含む過敏症があらわれることがあるため、 緊急対応を準備しつつ投与を行い、 必要に応じて前投与 (解熱鎮痛薬、 抗ヒスタミン薬、 副腎皮質ホルモン薬) を検討
膵炎 : 急性膵炎や膵壊死などが報告されているため、 血清アミラーゼ・リパーゼを定期的に測定し観察する
出血傾向・血栓塞栓症 : 出血や血栓症のリスクがあるため、 フィブリノゲンやアンチトロンビンIIIなどを定期的に測定し観察する
肝機能障害 : ALT・AST上昇を含む肝障害が起こり得るため、 肝機能検査を定期的に行う
高血糖 : 高血糖の可能性があるため、 血糖値を定期的に測定し観察する
中枢神経障害 : 痙攣や失神などが報告されているため、 十分に観察し、 危険作業に注意を促す
RMP【重要な特定されたリスク】
オンキャスパー®医薬品リスク管理計画書 (RMP)
- 過敏症
- 膵炎
- 出血
- 血栓塞栓症
- 肝機能障害
- 骨髄抑制
- 感染症
- 脂質異常症
- 高血糖
- 中枢神経障害
出典
- 日本セルヴィエ株式会社. オンキャスパー®点滴静注用3750 電子添文. 2023年10月改訂 第2版.
- 日本セルヴィエ株式会社. オンキャスパー®点滴静注用3750 適正使用ガイド. 2024年7月.
- JAMA Oncol. 2022;8(7):1035-1041.
- 日本腎臓学会、 日本癌治療学会、 日本臨床腫瘍学会、 日本腎臓病薬物療法学会編 : がん薬物療法時の腎障害診療ガイドライン2022. ライフサイエンス出版.
最終更新日 : 2025年8月19日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
DDGP (DEX + CDDP + GEM + pegaspargase)
DEX:デキサメタゾン(デキサート®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 15mg/m² | 1~6 | Day 1~5 |
CDDP:シスプラチン(シスプラチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 20mg/m² | 1~6 | Day 1~4 |
GEM:ゲムシタビン(ゲムシタビン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 800mg/m² | 1~6 | Day 1、8 |
Pegaspargase:ペグアスパルガーゼ(オンキャスパー®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2,500国際単位/m² | 1~6 | Day 1 |
前投薬
| オンキャスパー®投与の30〜60分前に、解熱鎮痛剤・抗ヒスタミン剤・副腎皮質ホルモン剤などの前投与を考慮する。 |
その他
| 本邦添付文書では、オンキャスパー®は22歳以上に2,000国際単位/m²を2週間隔で投与とされており、本レジメンとは投与量・スケジュールが異なるため注意が必要。 |
概要
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- デキサート® (添付文書)
- シスプラチン® (添付文書)
- ゲムシタビン® (添付文書)
*日本セルヴィエ株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】21日間
【催吐性】高度*
【FN発症】未報告**
*制吐薬適正使用ガイドラインではCDDPは用量に関わらず高度催吐性リスクに分類
**ピボタル試験³⁾ではFNの報告はないが、 Grade 3以上の好中球減少が高頻度に認められており、 十分な注意が必要

1–5日目にデキサメタゾン (DEX) 15mg/m²、 1–4日目にシスプラチン (CDDP) 20mg/m²、 1日目および8日目にゲムシタビン (GEM) 800mg/m²を点滴静脈し、 1日目にペグアスパルガーゼ2,500 IU/m² (最大3,750 IU) を1–2時間かけて点滴静脈する治療を、 21日間隔で最大6サイクル実施
添付文書では、 オンキャスパー®は22歳以上に2,000 IU/m²を2週間隔で投与とされており、 本レジメンとは投与量・スケジュールが異なるため注意。
Key Data|臨床試験結果
📊 中国・多施設第III相無作為化比較試験³⁾
JAMA Oncol. 2022;8(7):1035-1041.
新たに診断された進行期 (IIIまたはIV期) の節外性NK/T細胞リンパ腫 (ENKL) 患者87例を対象に、 DDGP群 (43例) とSMILE群 (44例) に1対1で無作為に割り付けた、 多施設共同の非盲検無作為化比較試験。 主要評価項目はPFSとされた。
SMILE療法 : 21日を1コースとして、 MTX 2g/m² (day1, 20%静注2h+80%点滴4h)、 DEX 40mg (day2–4, 点滴)、 IFO 1.5g/m² (day2–4, 点滴)、 L-ASP 6000U/m² (最大10000U, day3–9, 点滴)、 VP-16 100mg/m² (day2–4, 点滴)、 Mesna併用。
【有効性】DDGP群 (vs SMILE群)
- PFS中央値 : 未到達 (vs 6.8ヵ月)
- HR 0.42 (95%CI 0.23–0.77)
- 3年PFS率 : 56.6% (vs 41.8%)
- OS中央値 : 未到達 (vs 75.2ヵ月)
- HR 0.41 (95%CI 0.19–0.89)
- 5年OS率 : 74.3% (vs 51.7%)
- 全奏効率 : 90.0% (vs 60.0%)
- 完全奏効率 : 67.5% (vs 47.5%)
【安全性】両群における有害事象の発現率は以下のとおり : Grade1–2 (Grade≧3)。

出典³⁾を基に編集部作成
各プロトコル
適格基準
ピボタル試験³⁾の主な適格基準
- 年齢 14~70歳
- ECOG PS 0-2
- ヘモグロビン≧9.0g/dL
- 好中球数≧1,500/μL
- 血小板数≧10万/μL
- 腎機能 : 血清クレアチニン ≦1.5×ULN
- 肝機能 : AST/ALT≦2×ULN、 血清ビリルビン ≦1.5×ULN
腎障害患者に対する用量調整
CDDP⁴⁾ :
- 重篤な腎障害例への投与は禁忌
- CrCl 46~60mL/minでは75%、 31~45mL/minでは50%に減量し、 CrCl≦30mL/minでは投与を推奨しない
- 別の報告 : CrCl 30~49mL/minでは75%、 10~29mL/minでは投与が必要な場合に75%、 CrCl<10mL/minでは投与が必要な場合に50%に減量
GEM⁴⁾ : 腎機能低下や透析時の減量は原則不要。 ただし、 代謝産物dFdUは腎機能低下時に蓄積しやすく、 皮膚障害などの有害事象が増える可能性があるため注意
ペグアスパルガーゼ : 代謝・排泄は主にプロテアーゼによる分解および網内系による除去であり、 腎障害時に減量は不要と考えられる
アスパラギナーゼの薬物動体を参考に、 編集部が評価
有害事象発現時の減量・休薬・中止基準
ピボタル試験³⁾では、 有害事象発現時の対応として以下の管理が定められていた。

一方、 オンキャスパー®の電子添付文書¹⁾には、 次のような対応が明記されている。

オンキャスパー電子添文¹⁾を基に編集部作成
レジメンの特徴と注意点
🧑⚕️進行期ENKLに対して、 DDGP療法はSMILE療法と比較して毒性を増加させることなくPFSおよびOSを延長することが示されている³⁾。 NCCNガイドラインではSMILE変法と並んで推奨されているが、 造血器腫瘍診療ガイドライン2024年版には記載がない。 エビデンスはなお限定的であり、 慎重な運用が求められる。
東海大学医学部血液腫瘍内科 扇屋大輔先生
本レジメンの位置付け
ENKLの標準治療は未確立であり、 原則として臨床試験への参加が推奨される。 NCCNガイドラインでは、 DDGP療法がSMILE療法変法と並び、 ステージIII/IVの鼻型ENKLおよびステージI~IVの鼻腔外ENKLに対する多剤併用化学療法の推奨レジメンの一つと位置付けられている。
日本でも2023年6月、 ペグアスパラギナーゼが悪性リンパ腫を対象に承認されたが、 最適な併用レジメンに関するエビデンスは依然として限定的であり、 慎重な運用が求められる。
レジメン適用時の注意事項
過敏症 : アナフィラキシーを含む過敏症があらわれることがあるため、 緊急対応を準備しつつ投与を行い、 必要に応じて前投与 (解熱鎮痛薬、 抗ヒスタミン薬、 副腎皮質ホルモン薬) を検討
膵炎 : 急性膵炎や膵壊死などが報告されているため、 血清アミラーゼ・リパーゼを定期的に測定し観察する
出血傾向・血栓塞栓症 : 出血や血栓症のリスクがあるため、 フィブリノゲンやアンチトロンビンIIIなどを定期的に測定し観察する
肝機能障害 : ALT・AST上昇を含む肝障害が起こり得るため、 肝機能検査を定期的に行う
高血糖 : 高血糖の可能性があるため、 血糖値を定期的に測定し観察する
中枢神経障害 : 痙攣や失神などが報告されているため、 十分に観察し、 危険作業に注意を促す
RMP【重要な特定されたリスク】
オンキャスパー®医薬品リスク管理計画書 (RMP)
- 過敏症
- 膵炎
- 出血
- 血栓塞栓症
- 肝機能障害
- 骨髄抑制
- 感染症
- 脂質異常症
- 高血糖
- 中枢神経障害
出典
- 日本セルヴィエ株式会社. オンキャスパー®点滴静注用3750 電子添文. 2023年10月改訂 第2版.
- 日本セルヴィエ株式会社. オンキャスパー®点滴静注用3750 適正使用ガイド. 2024年7月.
- JAMA Oncol. 2022;8(7):1035-1041.
- 日本腎臓学会、 日本癌治療学会、 日本臨床腫瘍学会、 日本腎臓病薬物療法学会編 : がん薬物療法時の腎障害診療ガイドライン2022. ライフサイエンス出版.
最終更新日 : 2025年8月19日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。





