Ponatinib
ポナチニブ(アイクルシグ®)
治療スケジュール
概要
監修医師
Ponatinib:ポナチニブ(アイクルシグ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 45mg 1日1回 経口 | 1~ | Day 1~ |
その他
| 他の抗悪性腫瘍薬との併用について、 有効性及び安全性は確立していない. |
| 有害事象発現時の休薬、減量および投与中止の基準は概要欄参照. |
Ponatinibの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「大塚製薬株式会社」 の外部サイトへ遷移します.
主な有害事象
国内第I/II相試験¹⁾、 海外第II相試験²⁾より引用
骨髄抑制
慢性期CML
- 血小板数減少 (≧Grade3 47.1%¹⁾、 ≧Grade3 31.9%²⁾)
- 好中球数減少 (≧Grade3 23.5%¹⁾、 ≧Grade3 14.8%²⁾)
- 貧血 (≧Grade3 0.0%¹⁾、 ≧Grade3 5.9%²⁾)
- リンパ球数減少 (≧Grade3 5.9%¹⁾、 ≧Grade3 0.4%²⁾)
進行期CML
- 血小板数減少 (≧Grade3 22.2%¹⁾、 ≧Grade3 26.8%²⁾)
- 好中球数減少 (≧Grade3 33.3%¹⁾、 ≧Grade3 21.8%²⁾)
- 貧血 (≧Grade3 5.6%¹⁾、 ≧Grade3 15.1%²⁾)
- リンパ球数減少 (≧Grade3 5.6%¹⁾、 ≧Grade3 0.0%²⁾)
主な有害事象
慢性期CML
- 心血管閉塞性事象 (11.8%¹⁾、 ≧Grade3 11.8%¹⁾、 10.0%²⁾、 ≧Grade3 6.7%²⁾)
- 高血圧 (35.3%¹⁾、 ≧Grade3 23.5%¹⁾、 16.7%²⁾、 ≧Grade3 4.4%²⁾)
- 肝機能障害 (23.5%¹⁾、 ≧Grade3 11.1%¹⁾、 17.8%²⁾、 ≧Grade3 5.9%²⁾)
進行期
- 心血管閉塞性事象 (11.2%¹⁾、 ≧Grade3 5.6%¹⁾、 8.9%²⁾、 ≧Grade3 3.9%²⁾)
- 発熱性好中球減少症 (22.2%¹⁾、 ≧Grade3 22.2%¹⁾、 3.4%²⁾、 ≧Grade3 3.4%²⁾)
- 高血圧 (38.9%¹⁾、 ≧Grade3 33.3%¹⁾、 6.1%²⁾、 ≧Grade3 3.4%²⁾)
- 肝機能障害 (44.4%¹⁾、 ≧Grade3 11.1%¹⁾、 15.6%²⁾、 ≧Grade3 7.8%²⁾)
その他重要な有害事象
慢性期CML
- 脳血管閉塞性事象 (5.9%¹⁾、 ≧Grade3 0.0%¹⁾、 10.0%²⁾、 ≧Grade3 3.7%²⁾)
- 末梢血管閉塞性事象 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 8.5%²⁾、 ≧Grade3 5.6%²⁾)
- 末梢性浮腫 (5.9%¹⁾、 ≧Grade3 0.0%¹⁾、 5.9%²⁾、 ≧Grade3 0.0%²⁾)
- 心嚢液貯留 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 1.9%²⁾、 ≧Grade3 0.7%²⁾)
- 胸水 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 2.2%²⁾、 ≧Grade3 0.7%²⁾)
- 体液貯留 (5.9%¹⁾、 ≧Grade3 5.9%¹⁾、 0.7%²⁾、 ≧Grade3 0.0%²⁾)
- 肺うっ血 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 0.4%²⁾、 ≧Grade3 0.4%²⁾)
進行期
- 脳血管閉塞性事象 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 3.4%²⁾、 ≧Grade3 2.2%²⁾)
- 末梢血管閉塞性事象 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 4.5%²⁾、 ≧Grade3 2.8%²⁾)
- 末梢性浮腫 (16.7%¹⁾、 ≧Grade3 0.0%¹⁾、 6.1%²⁾、 ≧Grade3 0.0%²⁾)
- 心嚢液貯留 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 3.4%²⁾、 ≧Grade3 0.6%²⁾)
- 胸水 (5.6%¹⁾、 ≧Grade3 0.0%¹⁾、 6.7%²⁾、 ≧Grade3 0.6%²⁾)
- 体液貯留 (5.6%¹⁾、 ≧Grade3 5.9%¹⁾、 1.1%²⁾、 ≧Grade3 0.6%²⁾)
- 肺水腫 (5.6%¹⁾、 ≧Grade3 0.0%¹⁾、 0.0%²⁾、 ≧Grade3 0.0%²⁾)
特徴と注意点
適応
- 適応疾患は前治療薬に抵抗性または不耐容のCMLと再発・難治Ph染色体陽性急性リンパ性白血病である.
特徴
- 第3世代TKI (tyrosine kinase inhibitor) .
- イマチニブ抵抗性の原因となるBCR-ABL1融合遺伝子の点突然変異の1つであるT315I変異に有効.
- 血管閉塞性事象 (心筋梗塞、 脳梗塞、 網膜動脈閉塞症、 末梢動脈閉塞性疾患、 静脈血栓塞栓症) の死亡報告あり.
- 動脈の血管閉塞性事象は高齢および虚血性疾患の既往歴を有する患者に発現頻度が高い.
- 投与前に必ず血圧、 心電図、 頸動脈エコー、 心エコー、 ABI検査、 血液検査等により心血管系疾患の危険因子を評価.
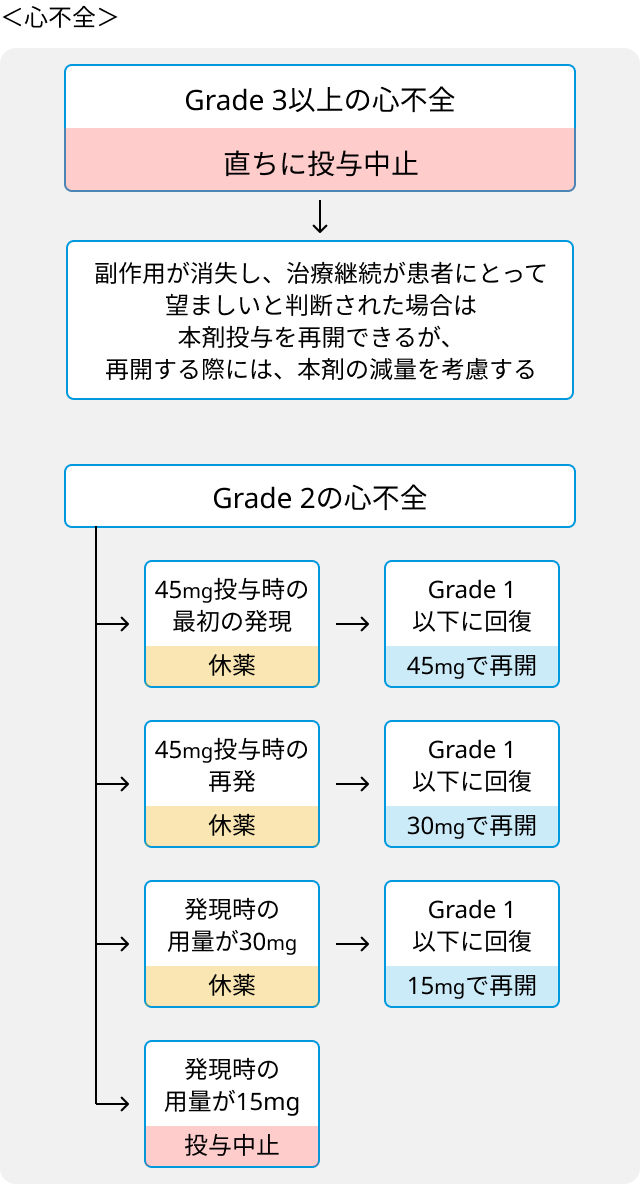
- 血管閉塞性事象又はGrade 3以上の心不全が発現した場合は直ちに中止.
- 血管閉塞性有害事象発現時の休薬、減量および投与中止の基準.
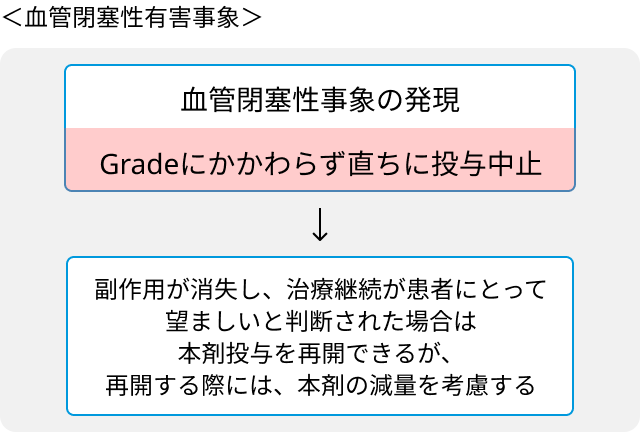
- 血液系の有害事象と投与量調節の基準.
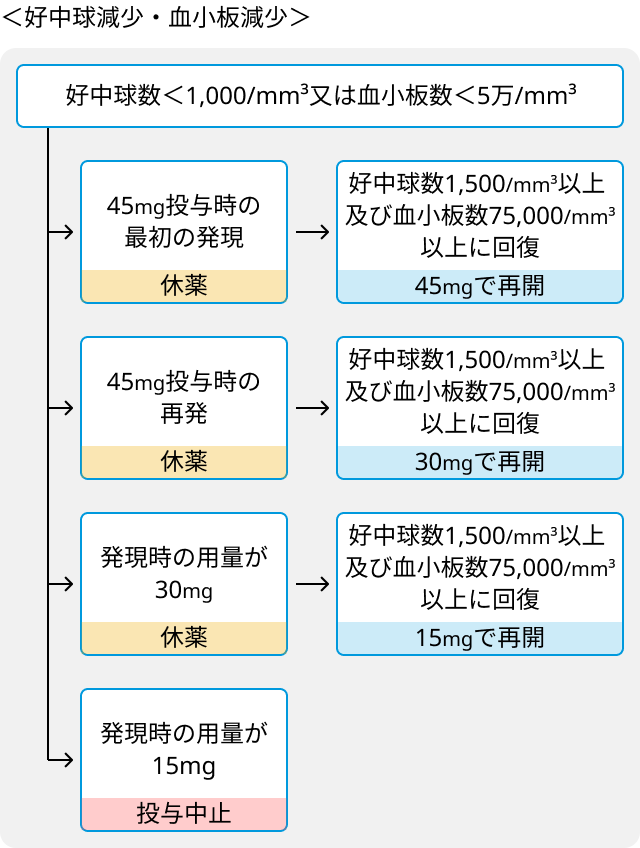
- 肝機能障害発現時の休薬、減量および投与中止の基準.
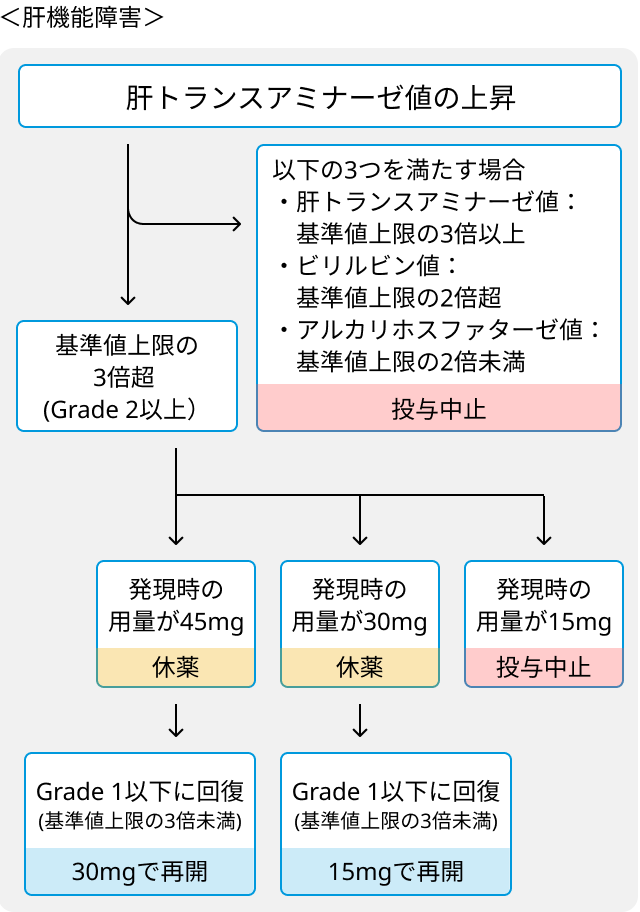
- 膵炎/リパーゼおよびアミラーゼの増加に対する休薬、減量および投与中止の基準.
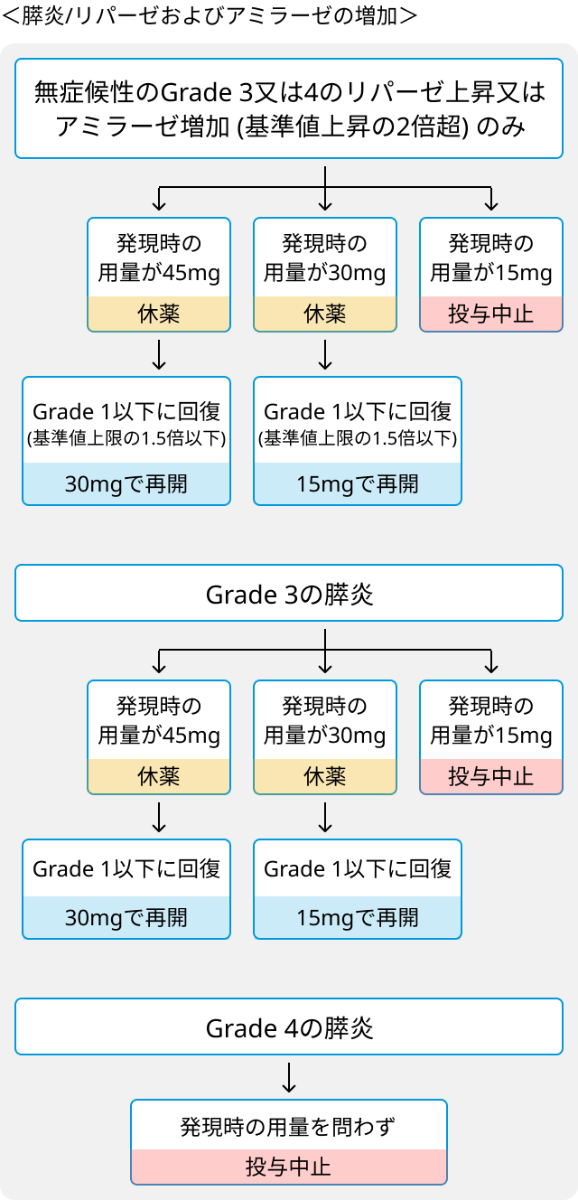
- 心不全に対する休薬、減量および投与中止の基準.
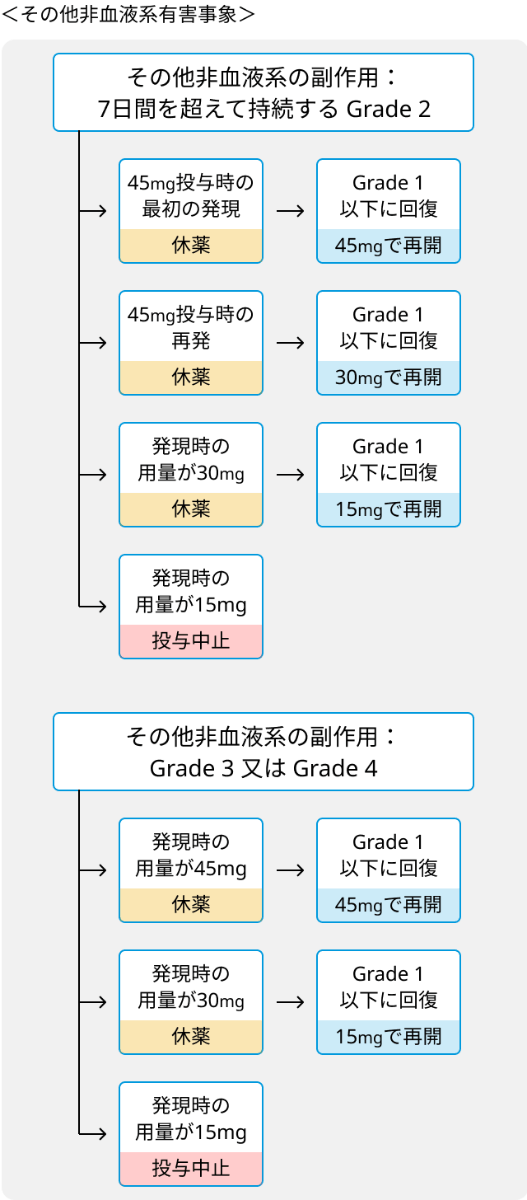
- その他非血液系有害事象と投与量調節の基準.
関連する臨床試験の結果
CP-CML: Chronic Phase-CML (慢性期CML) 、 AP-CML: Accelerated Phase-CML (移行期CML) 、 BP-CML: Blast Phase-CML (急性転化期CML) 、 MMR: Major Molecular Response (分子遺伝学的大奏効) 、 MCyR: Major Cytogenetic Response (細胞遺伝学的大奏効) 、 CCyR: Complete Cytogenic Response (細胞遺伝学的完全寛解) 、 PCyR: Partial Cytogenic Response (細胞遺伝学的部分寛解) 、 MHR: Major Hematologic Response (血液学的大奏効) 、 CHR: Complete Hematologic Response (血液学的完全奏効) 、 OS: Overall Survival (全生存) 、 PFS: Progression Free Survival (無増悪生存) .
国内第I/II相試験¹⁾
概要
- 対象:ダサチニブまたはニロチニブに抵抗性または不耐容であるCML、 若しくはTKIによる前治療に抵抗性または 不耐容であるPh+ALL患者.
- 国内第I/II相試験.
結果
CP-CML
- 12ヵ月時点のMCyR、 CCyR、 PCyR:65%、 59%、 6%.
- 12ヵ月時点のMCyR・MMR維持例:100% (95%CI 85-95).
- 12ヵ月時点の推定PFS:81% (95%CI 52-94).
- 12ヵ月時点の推定OS:100% (95%CI 100-100).
AP-CML、 BP-CMLもしくはPh+ALL
- 6ヵ月時点のMHR、 CHyR:61%、 56%.
- PFS (中央値) :3.3ヵ月 (range 0.3-17.3).
- OS (中央値) :10.2ヵ月 (range 0.3-26.8).
海外第II相試験²⁾
概要
- 対象:CML・Ph陽性ALLで、 複数の全治療歴を有し、 ダサチニブまたはニロチニブに抵抗性を示す患者、 ダサチニブまたはニロチニブに認容できない副作用が生じる患者、 もしくはBCR-ABLにT315I変異を有する患者.
- 海外第II相試験.
- 追跡期間中央値15カ月.
結果
CP-CML
- 12ヵ月時点のMCyR、 CCyR、 MMR:56%、 46%、 34%.
- MCyR維持例 (≧12ヵ月) :91% (95%CI 85-95) .
- 12ヵ月時点のOS:94%.
AP-CML
- 12ヵ月時点のMCyR、 CCyR、 MMR:39%、 24%、 16%.
- MCyR維持例 (≧12ヵ月) :48% (95%CI 32-63) .
- 12ヵ月時点のOS:84%.
BP-CML
- 12ヵ月時点のMHR、 MCyR、 CCyR:31%、 23%、 18%.
- MHR維持例 (≧12ヵ月) :42% (95%CI 19-63) .
- 12ヵ月時点のOS:29%.
Ph+ALL
- 12ヵ月時点のMHR、 MCyR、 CCyR:41%、 47%、 38%.
- MHR維持例 (≧12ヵ月) :8% (95%CI 0.5-29) .
- 12ヵ月時点のOS:40%.
参考文献
最終更新:2023年5月26日
執筆担当:北里大学病院薬剤部 宮島律子
監修医師:東海大学血液腫瘍内科 扇屋大輔
Ponatinibの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
Ponatinib
ポナチニブ(アイクルシグ®)
2023年05月26日更新
Ponatinib:ポナチニブ(アイクルシグ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 45mg 1日1回 経口 | 1~ | Day 1~ |
その他
| 他の抗悪性腫瘍薬との併用について、 有効性及び安全性は確立していない. |
| 有害事象発現時の休薬、減量および投与中止の基準は概要欄参照. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「大塚製薬株式会社」 の外部サイトへ遷移します.
主な有害事象
国内第I/II相試験¹⁾、 海外第II相試験²⁾より引用
骨髄抑制
慢性期CML
- 血小板数減少 (≧Grade3 47.1%¹⁾、 ≧Grade3 31.9%²⁾)
- 好中球数減少 (≧Grade3 23.5%¹⁾、 ≧Grade3 14.8%²⁾)
- 貧血 (≧Grade3 0.0%¹⁾、 ≧Grade3 5.9%²⁾)
- リンパ球数減少 (≧Grade3 5.9%¹⁾、 ≧Grade3 0.4%²⁾)
進行期CML
- 血小板数減少 (≧Grade3 22.2%¹⁾、 ≧Grade3 26.8%²⁾)
- 好中球数減少 (≧Grade3 33.3%¹⁾、 ≧Grade3 21.8%²⁾)
- 貧血 (≧Grade3 5.6%¹⁾、 ≧Grade3 15.1%²⁾)
- リンパ球数減少 (≧Grade3 5.6%¹⁾、 ≧Grade3 0.0%²⁾)
主な有害事象
慢性期CML
- 心血管閉塞性事象 (11.8%¹⁾、 ≧Grade3 11.8%¹⁾、 10.0%²⁾、 ≧Grade3 6.7%²⁾)
- 高血圧 (35.3%¹⁾、 ≧Grade3 23.5%¹⁾、 16.7%²⁾、 ≧Grade3 4.4%²⁾)
- 肝機能障害 (23.5%¹⁾、 ≧Grade3 11.1%¹⁾、 17.8%²⁾、 ≧Grade3 5.9%²⁾)
進行期
- 心血管閉塞性事象 (11.2%¹⁾、 ≧Grade3 5.6%¹⁾、 8.9%²⁾、 ≧Grade3 3.9%²⁾)
- 発熱性好中球減少症 (22.2%¹⁾、 ≧Grade3 22.2%¹⁾、 3.4%²⁾、 ≧Grade3 3.4%²⁾)
- 高血圧 (38.9%¹⁾、 ≧Grade3 33.3%¹⁾、 6.1%²⁾、 ≧Grade3 3.4%²⁾)
- 肝機能障害 (44.4%¹⁾、 ≧Grade3 11.1%¹⁾、 15.6%²⁾、 ≧Grade3 7.8%²⁾)
その他重要な有害事象
慢性期CML
- 脳血管閉塞性事象 (5.9%¹⁾、 ≧Grade3 0.0%¹⁾、 10.0%²⁾、 ≧Grade3 3.7%²⁾)
- 末梢血管閉塞性事象 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 8.5%²⁾、 ≧Grade3 5.6%²⁾)
- 末梢性浮腫 (5.9%¹⁾、 ≧Grade3 0.0%¹⁾、 5.9%²⁾、 ≧Grade3 0.0%²⁾)
- 心嚢液貯留 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 1.9%²⁾、 ≧Grade3 0.7%²⁾)
- 胸水 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 2.2%²⁾、 ≧Grade3 0.7%²⁾)
- 体液貯留 (5.9%¹⁾、 ≧Grade3 5.9%¹⁾、 0.7%²⁾、 ≧Grade3 0.0%²⁾)
- 肺うっ血 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 0.4%²⁾、 ≧Grade3 0.4%²⁾)
進行期
- 脳血管閉塞性事象 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 3.4%²⁾、 ≧Grade3 2.2%²⁾)
- 末梢血管閉塞性事象 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 4.5%²⁾、 ≧Grade3 2.8%²⁾)
- 末梢性浮腫 (16.7%¹⁾、 ≧Grade3 0.0%¹⁾、 6.1%²⁾、 ≧Grade3 0.0%²⁾)
- 心嚢液貯留 (0.0%¹⁾、 ≧Grade3 0.0%¹⁾、 3.4%²⁾、 ≧Grade3 0.6%²⁾)
- 胸水 (5.6%¹⁾、 ≧Grade3 0.0%¹⁾、 6.7%²⁾、 ≧Grade3 0.6%²⁾)
- 体液貯留 (5.6%¹⁾、 ≧Grade3 5.9%¹⁾、 1.1%²⁾、 ≧Grade3 0.6%²⁾)
- 肺水腫 (5.6%¹⁾、 ≧Grade3 0.0%¹⁾、 0.0%²⁾、 ≧Grade3 0.0%²⁾)
特徴と注意点
適応
- 適応疾患は前治療薬に抵抗性または不耐容のCMLと再発・難治Ph染色体陽性急性リンパ性白血病である.
特徴
- 第3世代TKI (tyrosine kinase inhibitor) .
- イマチニブ抵抗性の原因となるBCR-ABL1融合遺伝子の点突然変異の1つであるT315I変異に有効.
- 血管閉塞性事象 (心筋梗塞、 脳梗塞、 網膜動脈閉塞症、 末梢動脈閉塞性疾患、 静脈血栓塞栓症) の死亡報告あり.
- 動脈の血管閉塞性事象は高齢および虚血性疾患の既往歴を有する患者に発現頻度が高い.
- 投与前に必ず血圧、 心電図、 頸動脈エコー、 心エコー、 ABI検査、 血液検査等により心血管系疾患の危険因子を評価.
- 血管閉塞性事象又はGrade 3以上の心不全が発現した場合は直ちに中止.
- 血管閉塞性有害事象発現時の休薬、減量および投与中止の基準.

- 血液系の有害事象と投与量調節の基準.

- 肝機能障害発現時の休薬、減量および投与中止の基準.

- 膵炎/リパーゼおよびアミラーゼの増加に対する休薬、減量および投与中止の基準.

- 心不全に対する休薬、減量および投与中止の基準.

- その他非血液系有害事象と投与量調節の基準.

関連する臨床試験の結果
CP-CML: Chronic Phase-CML (慢性期CML) 、 AP-CML: Accelerated Phase-CML (移行期CML) 、 BP-CML: Blast Phase-CML (急性転化期CML) 、 MMR: Major Molecular Response (分子遺伝学的大奏効) 、 MCyR: Major Cytogenetic Response (細胞遺伝学的大奏効) 、 CCyR: Complete Cytogenic Response (細胞遺伝学的完全寛解) 、 PCyR: Partial Cytogenic Response (細胞遺伝学的部分寛解) 、 MHR: Major Hematologic Response (血液学的大奏効) 、 CHR: Complete Hematologic Response (血液学的完全奏効) 、 OS: Overall Survival (全生存) 、 PFS: Progression Free Survival (無増悪生存) .
国内第I/II相試験¹⁾
概要
- 対象:ダサチニブまたはニロチニブに抵抗性または不耐容であるCML、 若しくはTKIによる前治療に抵抗性または 不耐容であるPh+ALL患者.
- 国内第I/II相試験.
結果
CP-CML
- 12ヵ月時点のMCyR、 CCyR、 PCyR:65%、 59%、 6%.
- 12ヵ月時点のMCyR・MMR維持例:100% (95%CI 85-95).
- 12ヵ月時点の推定PFS:81% (95%CI 52-94).
- 12ヵ月時点の推定OS:100% (95%CI 100-100).
AP-CML、 BP-CMLもしくはPh+ALL
- 6ヵ月時点のMHR、 CHyR:61%、 56%.
- PFS (中央値) :3.3ヵ月 (range 0.3-17.3).
- OS (中央値) :10.2ヵ月 (range 0.3-26.8).
海外第II相試験²⁾
概要
- 対象:CML・Ph陽性ALLで、 複数の全治療歴を有し、 ダサチニブまたはニロチニブに抵抗性を示す患者、 ダサチニブまたはニロチニブに認容できない副作用が生じる患者、 もしくはBCR-ABLにT315I変異を有する患者.
- 海外第II相試験.
- 追跡期間中央値15カ月.
結果
CP-CML
- 12ヵ月時点のMCyR、 CCyR、 MMR:56%、 46%、 34%.
- MCyR維持例 (≧12ヵ月) :91% (95%CI 85-95) .
- 12ヵ月時点のOS:94%.
AP-CML
- 12ヵ月時点のMCyR、 CCyR、 MMR:39%、 24%、 16%.
- MCyR維持例 (≧12ヵ月) :48% (95%CI 32-63) .
- 12ヵ月時点のOS:84%.
BP-CML
- 12ヵ月時点のMHR、 MCyR、 CCyR:31%、 23%、 18%.
- MHR維持例 (≧12ヵ月) :42% (95%CI 19-63) .
- 12ヵ月時点のOS:29%.
Ph+ALL
- 12ヵ月時点のMHR、 MCyR、 CCyR:41%、 47%、 38%.
- MHR維持例 (≧12ヵ月) :8% (95%CI 0.5-29) .
- 12ヵ月時点のOS:40%.
参考文献
最終更新:2023年5月26日
執筆担当:北里大学病院薬剤部 宮島律子
監修医師:東海大学血液腫瘍内科 扇屋大輔
Ponatinibの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




