Venetoclax+Obinutuzumab
ベネトクラクス (ベネクレクスタ®)+オビヌツズマブ (ガザイバ®)
Ven:ベネトクラクス(ベネクレクスタ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 20mg 1日1回 内服 | 1 | Day 22~28 |
| 50mg 1日1回 内服 | 2 | Day 1~7 |
| 100mg 1日1回 内服 | 2 | Day 8~14 |
| 200mg 1日1回 内服 | 2 | Day 15~21 |
| 400mg 1日1回 内服 | 2 | Day 22~28 |
| 400mg 1日1回 内服 | 3~12 | Day 1~28 |
Obi:オビヌツズマブ(ガザイバ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg 点滴静注 | 1 | Day 1 |
| 900mg 点滴静注 | 1 | Day 2 |
| 1000mg 点滴静注 | 1 | Day 8、15 |
| 1000mg 点滴静注 | 2-6 | Day 1 |
前投薬
| オビヌツズマブによるinfusion reactionを軽減するため、投与30分~1時間前に抗ヒスタミン薬と解熱鎮痛薬を前投与する。ステロイドの前投与も考慮する。 |
その他
2025年11月20日に、 オビヌツズマブ併用療法およびイブルチニブ併用療法における未治療CLL (SLLを含む) の効能追加について、 一部変更承認を取得した。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ベネクレクスタ® (ベネトクラクス : Ven)
*アッヴィ合同会社の外部サイトへ遷移します
ガザイバ® (オビヌツズマブ : Obi)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】28日間
【催吐性】 Ven : 軽度、 Obi : 最小度
【FN発症】低リスク*
*CLL14試験のFN発生率0.5%を基に編集部が分類
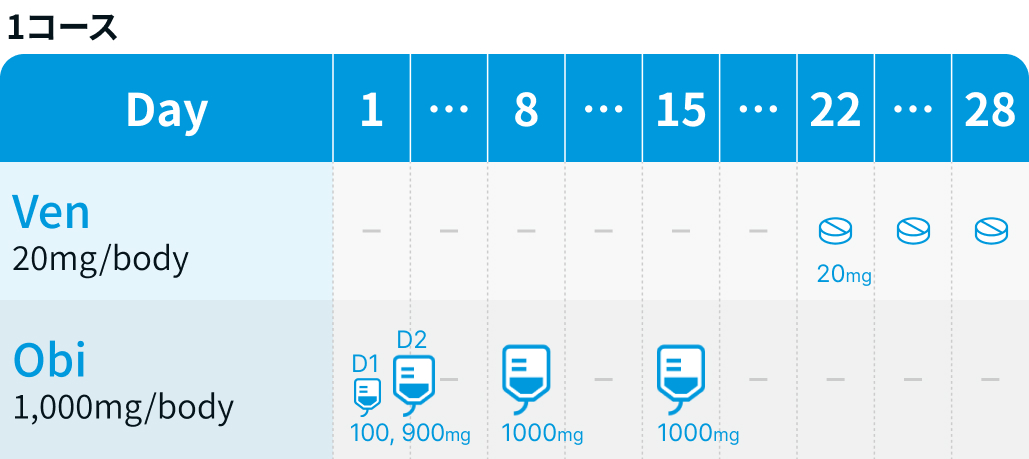
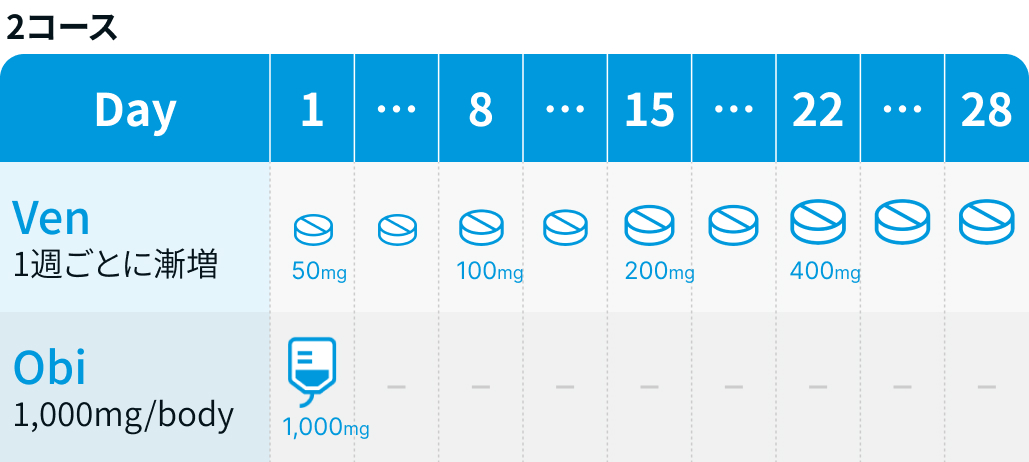

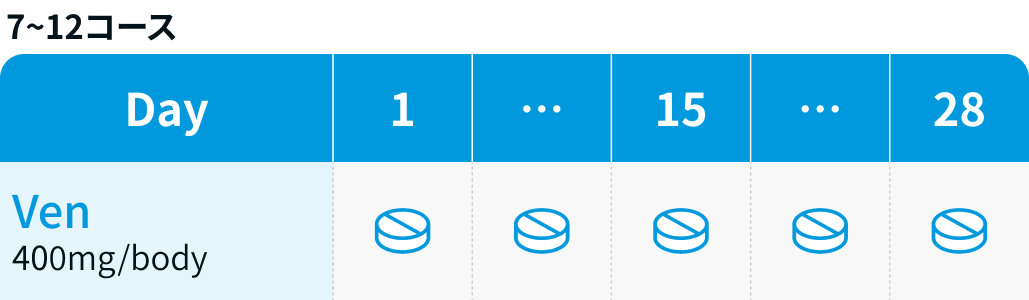
Ven : 1コース22日目から5週間の用量漸増を開始し、 2コース28日目に漸増を完了した後、 3コース1日目から12コース最終日まで28日ごとに投与²⁾
Obi : 1コースでは1日目100mg、 2日目900mg、 8日目と15日目に各1000mgを投与し、 2コース以降は各コース1日目に1000mgを投与して、 28日ごとに計6サイクル投与²⁾
Obiのinfusion reaction対策
Obi投与の30分~1時間前に抗ヒスタミン薬と解熱鎮痛薬を前投与する。 また、 ステロイドの前投与を考慮する。 さらに、 infusion reaction予防のため下表に従って投与速度を管理する。
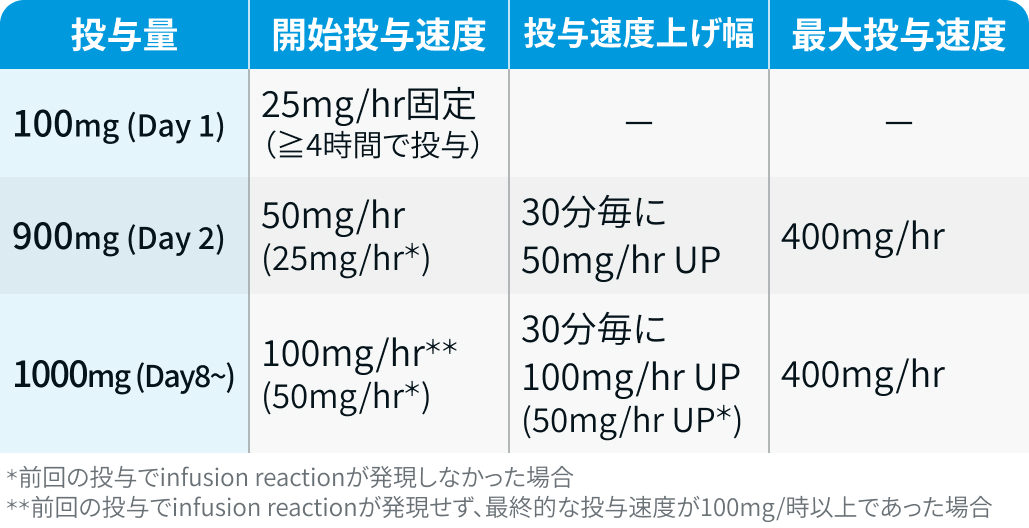
ガザイバ®電子添文を基に編集部作成
Key Data|臨床試験結果
📊 CLL14試験
Blood. 2024;144(18):1924-1935.
治療歴のない併存疾患ありのCLL患者432例を対象とした第III相無作為化比較試験で、 Ven+Obi群216例とchlorambucil (Clb) +Obi群216例を1:1で割り付け、 主要評価項目はPFSとした。
【有効性】Ven+Obi群 (vs Clb+Obi群)
- PFS中央値 76.2ヵ月 ( vs 36.4ヵ月)
- HR 0.40 (95%CI 0.31–0.52、 p<0.0001)
- 6年PFS率 53.1% ( vs 21.7%)
- TTNT中央値 未到達 ( vs 52.9ヵ月)
- HR 0.44 (95%CI 0.33–0.58、 p<0.0001)
- 6年TTNT率 65.2% ( vs 37.1%)
- 6年OS率 78.7% ( vs 69.2%)
- HR 0.69 (95%CI 0.48–1.01、 p=0.05)
- MRD陰性率 76% ( vs 35%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
データはLancet Oncol. 2020;21(9):1188-1200.に基づく
- 好中球減少 58% (52%)
- Infusion reaction 45% (9%)
- 血小板減少 24% (14%)
- 下痢 27% (4%)
- 悪心 18% (0%)
- 貧血 17% (8%)
- 発熱 18% (1%)
- 倦怠感 15% (0%)
- 咳嗽 16% (0%)
- 便秘 13% (0%)
- 頭痛 11% (0.5%)
- AST上昇 6% (2%)
- 無力症 7% (2%)
- 肺炎 9% (6%)
- ALT上昇 5% (2%)
- 高血圧 7% (3%)
- 高血糖 8% (4%)
- 呼吸困難 6% (2%)
- 発熱性好中球減少症 6% (5%)
- 低血圧 5% (1%)
- 高尿酸血症 4% (1%)
- 基底細胞癌 4% (1%)
- 敗血症 4% (4%)
- 失神 3% (2%)
- めまい 3% (1%)
- 心房細動 3% (2%)
- 腫瘍崩壊症候群 1% (0.5%)
- 心不全 2% (2%)
- サイトカイン放出症候群 2% (1%)
- 心筋梗塞 0.5% (0.5%)
- 急性心筋梗塞 1% (1%)
各プロトコル
適格基準
CLL14試験³⁾の主な適格基準
- 18歳以上
- CIRSスコア>6もしくはCrCl<70mL/min
- 好中球≧1000/μL
- 血小板≧3万/μL
- ヘモグロビン>9g/dL
- 腎機能 : CrCl≧30mL/min
- 肝機能 : T-Bil≦2xULN、 AST/ALT≦2xULN
用量レベル
CLL14試験³⁾では、 Obiの減量は認められていない。
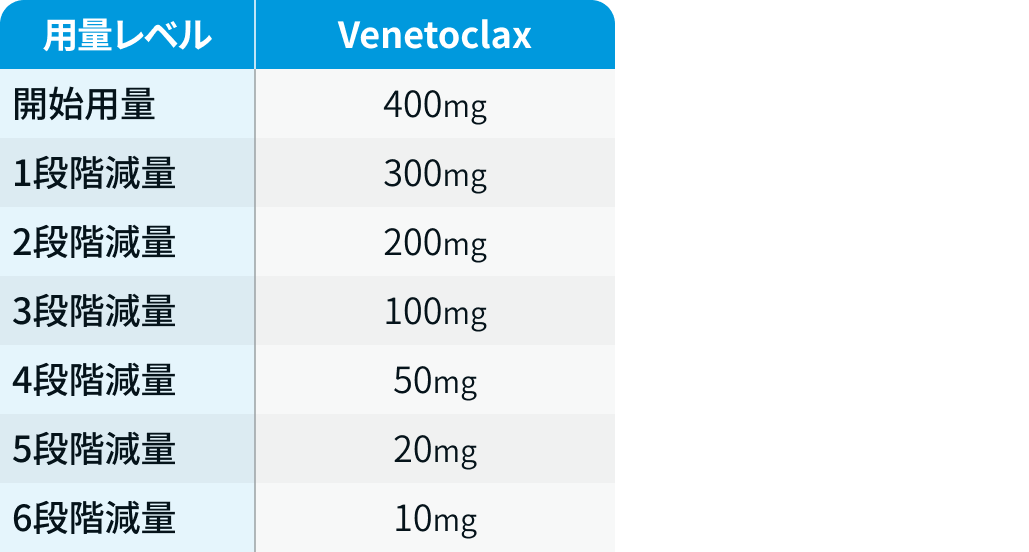
ベネクレクスタ®電子添文情報¹⁾を基に編集部作成
腎障害患者に対する用量調整
Ven : 検討はされていないが、 尿中未変化体排泄率 (推定値) は0.01%未満であり、 減量は不要と考えられる
編集部の見解
Obi : 抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
有害事象発現時の減量・休薬・中止基準
ベネトクラクス :
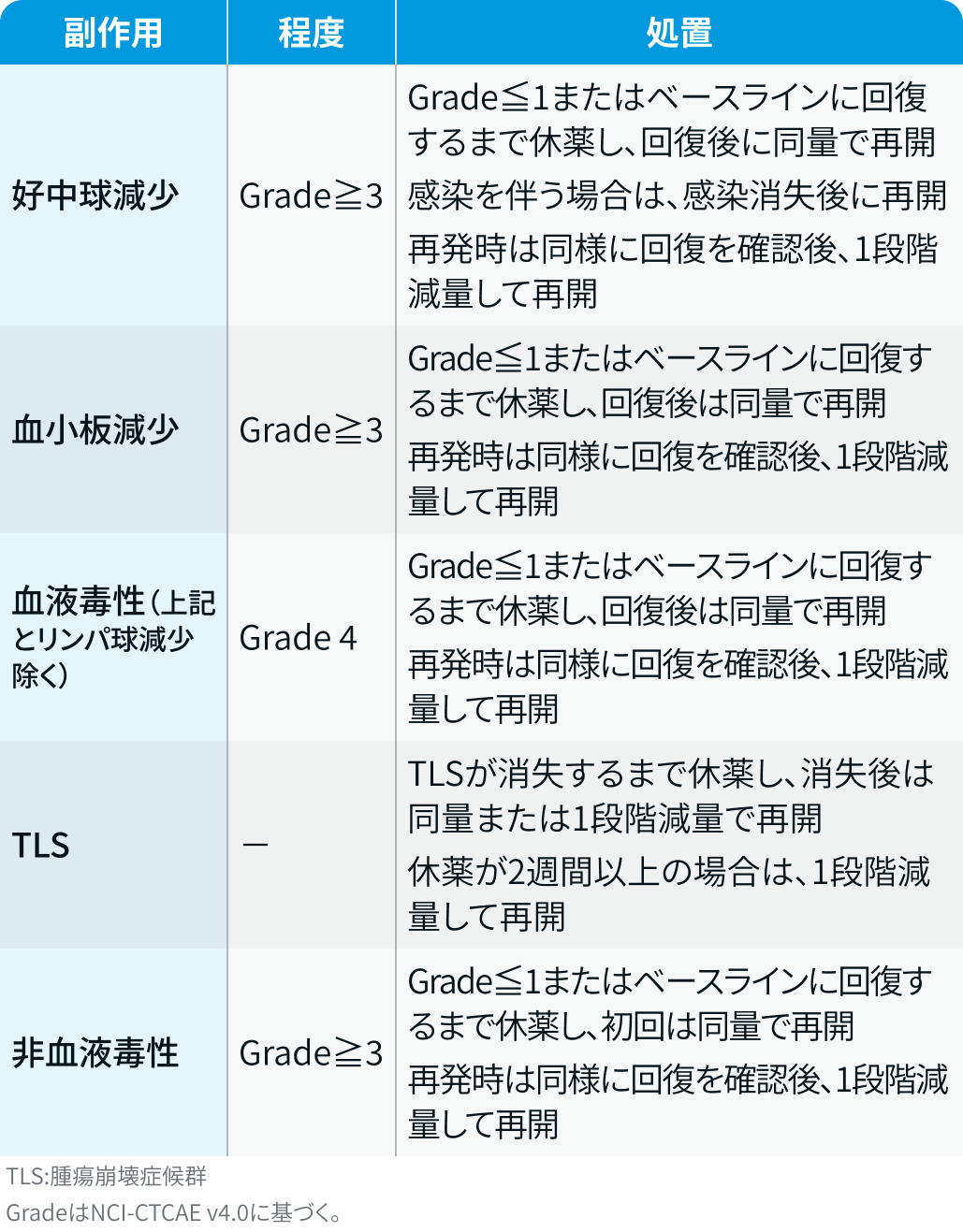
ベネクレクスタ®電子添文情報¹⁾を基に編集部作成
オビヌツズマブ : Infusion reaction発現時の処置および再開時の投与速度は以下のとおり。

ガザイバ®電子添文を基に編集部作成
レジメンの特徴と注意点
作用機序の特徴
ベネトクラクスはBCL2阻害薬であり、 BCL2の抗アポトーシス作用を抑えて細胞死を誘導する。 オビヌツズマブはヒト化抗CD20抗体であり、 CD20に結合してADCCおよびADCPを介し腫瘍増殖を抑制する。 両剤の併用により、 迅速な寛解と高いMRD陰性率が得られ、 一定期間で治療を終了しつつ長期の無治療寛解を維持できる利点がある³⁾。
本レジメンの位置付け
NCCNガイドラインでは、 17p欠失/TP53変異の有無によらず、 CLL/SLL初回治療の推奨レジメンのひとつである。

NCCNガイドラインVersion 1.2026を基に編集部作成
CYP3A4阻害薬併用時の注意事項
ベネトクラクスはCYP3A4の感受性が高い基質であり、 CYP3A4阻害薬との併用で血中濃度が上昇する可能性があるため、 阻害薬の一覧を確認し用量調整を行うこと。

ベネクレクスタ®電子添文³⁾を基に編集部作成
ベネトクラクスのTLS対策
- 血液検査 (K、 Ca、 P、 尿酸、 Cr) を実施し異常あれば補正を行う
- 事前に高尿酸血症治療薬を投与し、CT等で腫瘍量を低・中・高に判定した上で、腫瘍量に応じた対応を行う。

ベネクレクスタ®電子添文³⁾を基に編集部作成
低腫瘍量または中腫瘍量の患者対応 :
- 治療2日前から経口補水 (1.5~2L/日) を開始
- 20mg・50mg投与の前、 6~8時間後、 24時間後、 以降の各増量前に血液検査を実施
高腫瘍量の患者対応 :
- 治療2日前から経口補水 (1.5~2L/日) を開始し、 補液 (150~200mL/時) を併用する
- 20mg・50mg投与の前、 4・8・12・24時間後、 以降の各増量前、 投与6~8時間後、 24時間後に血液検査を実施
中腫瘍量かつCrCl<80mL/minの患者では、 20mgおよび50mg初回投与時の検査頻度は高腫瘍量のスケジュールに準じる。 なお、 ベネクレクスタ®適正使用ガイド²⁾では、 オビヌツズマブ併用の高腫瘍量において、 20mgおよび50mgの各初回投与時は入院下で約2~3L/日を目標に、 必要に応じて静脈内の水分補給を行うよう記載されている。
オビヌツズマブの易感染症と血液毒性
B型肝炎ウイルス再活性化による肝炎が報告されており、 投与前に感染の有無を確認し必要な処置を行う。
また、 好中球減少・発熱性好中球減少・白血球減少・血小板減少が生じ得るため、 治療前後を通じて定期的に血液検査を実施する。 必要に応じてG-CSF製剤の使用も考慮する。
RMP【重要な特定されたリスク】
RMP : 医薬品リスク管理計画書
ベネトクラクス :
- TLS
- 骨髄抑制
- 感染症
- CYP3A阻害剤との薬物相互作用
オビヌツズマブ :
- Infusion reaction
- TLS
- 血小板減少
- 好中球減少、 白血球減少
- 感染症
- B型肝炎ウイルスの再活性化
- 進行性多巣性白質脳症
- 心障害
- 消化管穿孔
- 間質性肺疾患
出典
1) アッヴィ合同株式会社. ベネクレクスタ®錠10mg/50mg/100mg 電子添文 (2025年11月改訂 第10版)
2) アッヴィ合同株式会社. ベネクレクスタ®錠10mg/50mg/100mg 適正使用ガイド (2025年11月作成)
3) Blood. 2024;144(18):1924-1935.
最終更新 : 2025年11月26日
執筆 : HOKUTO編集部がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Venetoclax+Obinutuzumab
Ven:ベネトクラクス(ベネクレクスタ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 20mg 1日1回 内服 | 1 | Day 22~28 |
| 50mg 1日1回 内服 | 2 | Day 1~7 |
| 100mg 1日1回 内服 | 2 | Day 8~14 |
| 200mg 1日1回 内服 | 2 | Day 15~21 |
| 400mg 1日1回 内服 | 2 | Day 22~28 |
| 400mg 1日1回 内服 | 3~12 | Day 1~28 |
Obi:オビヌツズマブ(ガザイバ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg 点滴静注 | 1 | Day 1 |
| 900mg 点滴静注 | 1 | Day 2 |
| 1000mg 点滴静注 | 1 | Day 8、15 |
| 1000mg 点滴静注 | 2-6 | Day 1 |
前投薬
| オビヌツズマブによるinfusion reactionを軽減するため、投与30分~1時間前に抗ヒスタミン薬と解熱鎮痛薬を前投与する。ステロイドの前投与も考慮する。 |
その他
概要
2025年11月20日に、 オビヌツズマブ併用療法およびイブルチニブ併用療法における未治療CLL (SLLを含む) の効能追加について、 一部変更承認を取得した。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ベネクレクスタ® (ベネトクラクス : Ven)
*アッヴィ合同会社の外部サイトへ遷移します
ガザイバ® (オビヌツズマブ : Obi)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】28日間
【催吐性】 Ven : 軽度、 Obi : 最小度
【FN発症】低リスク*
*CLL14試験のFN発生率0.5%を基に編集部が分類




Ven : 1コース22日目から5週間の用量漸増を開始し、 2コース28日目に漸増を完了した後、 3コース1日目から12コース最終日まで28日ごとに投与²⁾
Obi : 1コースでは1日目100mg、 2日目900mg、 8日目と15日目に各1000mgを投与し、 2コース以降は各コース1日目に1000mgを投与して、 28日ごとに計6サイクル投与²⁾
Obiのinfusion reaction対策
Obi投与の30分~1時間前に抗ヒスタミン薬と解熱鎮痛薬を前投与する。 また、 ステロイドの前投与を考慮する。 さらに、 infusion reaction予防のため下表に従って投与速度を管理する。

ガザイバ®電子添文を基に編集部作成
Key Data|臨床試験結果
📊 CLL14試験
Blood. 2024;144(18):1924-1935.
治療歴のない併存疾患ありのCLL患者432例を対象とした第III相無作為化比較試験で、 Ven+Obi群216例とchlorambucil (Clb) +Obi群216例を1:1で割り付け、 主要評価項目はPFSとした。
【有効性】Ven+Obi群 (vs Clb+Obi群)
- PFS中央値 76.2ヵ月 ( vs 36.4ヵ月)
- HR 0.40 (95%CI 0.31–0.52、 p<0.0001)
- 6年PFS率 53.1% ( vs 21.7%)
- TTNT中央値 未到達 ( vs 52.9ヵ月)
- HR 0.44 (95%CI 0.33–0.58、 p<0.0001)
- 6年TTNT率 65.2% ( vs 37.1%)
- 6年OS率 78.7% ( vs 69.2%)
- HR 0.69 (95%CI 0.48–1.01、 p=0.05)
- MRD陰性率 76% ( vs 35%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
データはLancet Oncol. 2020;21(9):1188-1200.に基づく
- 好中球減少 58% (52%)
- Infusion reaction 45% (9%)
- 血小板減少 24% (14%)
- 下痢 27% (4%)
- 悪心 18% (0%)
- 貧血 17% (8%)
- 発熱 18% (1%)
- 倦怠感 15% (0%)
- 咳嗽 16% (0%)
- 便秘 13% (0%)
- 頭痛 11% (0.5%)
- AST上昇 6% (2%)
- 無力症 7% (2%)
- 肺炎 9% (6%)
- ALT上昇 5% (2%)
- 高血圧 7% (3%)
- 高血糖 8% (4%)
- 呼吸困難 6% (2%)
- 発熱性好中球減少症 6% (5%)
- 低血圧 5% (1%)
- 高尿酸血症 4% (1%)
- 基底細胞癌 4% (1%)
- 敗血症 4% (4%)
- 失神 3% (2%)
- めまい 3% (1%)
- 心房細動 3% (2%)
- 腫瘍崩壊症候群 1% (0.5%)
- 心不全 2% (2%)
- サイトカイン放出症候群 2% (1%)
- 心筋梗塞 0.5% (0.5%)
- 急性心筋梗塞 1% (1%)
各プロトコル
適格基準
CLL14試験³⁾の主な適格基準
- 18歳以上
- CIRSスコア>6もしくはCrCl<70mL/min
- 好中球≧1000/μL
- 血小板≧3万/μL
- ヘモグロビン>9g/dL
- 腎機能 : CrCl≧30mL/min
- 肝機能 : T-Bil≦2xULN、 AST/ALT≦2xULN
用量レベル
CLL14試験³⁾では、 Obiの減量は認められていない。

ベネクレクスタ®電子添文情報¹⁾を基に編集部作成
腎障害患者に対する用量調整
Ven : 検討はされていないが、 尿中未変化体排泄率 (推定値) は0.01%未満であり、 減量は不要と考えられる
編集部の見解
Obi : 抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
有害事象発現時の減量・休薬・中止基準
ベネトクラクス :

ベネクレクスタ®電子添文情報¹⁾を基に編集部作成
オビヌツズマブ : Infusion reaction発現時の処置および再開時の投与速度は以下のとおり。

ガザイバ®電子添文を基に編集部作成
レジメンの特徴と注意点
作用機序の特徴
ベネトクラクスはBCL2阻害薬であり、 BCL2の抗アポトーシス作用を抑えて細胞死を誘導する。 オビヌツズマブはヒト化抗CD20抗体であり、 CD20に結合してADCCおよびADCPを介し腫瘍増殖を抑制する。 両剤の併用により、 迅速な寛解と高いMRD陰性率が得られ、 一定期間で治療を終了しつつ長期の無治療寛解を維持できる利点がある³⁾。
本レジメンの位置付け
NCCNガイドラインでは、 17p欠失/TP53変異の有無によらず、 CLL/SLL初回治療の推奨レジメンのひとつである。

NCCNガイドラインVersion 1.2026を基に編集部作成
CYP3A4阻害薬併用時の注意事項
ベネトクラクスはCYP3A4の感受性が高い基質であり、 CYP3A4阻害薬との併用で血中濃度が上昇する可能性があるため、 阻害薬の一覧を確認し用量調整を行うこと。

ベネクレクスタ®電子添文³⁾を基に編集部作成
ベネトクラクスのTLS対策
- 血液検査 (K、 Ca、 P、 尿酸、 Cr) を実施し異常あれば補正を行う
- 事前に高尿酸血症治療薬を投与し、CT等で腫瘍量を低・中・高に判定した上で、腫瘍量に応じた対応を行う。

ベネクレクスタ®電子添文³⁾を基に編集部作成
低腫瘍量または中腫瘍量の患者対応 :
- 治療2日前から経口補水 (1.5~2L/日) を開始
- 20mg・50mg投与の前、 6~8時間後、 24時間後、 以降の各増量前に血液検査を実施
高腫瘍量の患者対応 :
- 治療2日前から経口補水 (1.5~2L/日) を開始し、 補液 (150~200mL/時) を併用する
- 20mg・50mg投与の前、 4・8・12・24時間後、 以降の各増量前、 投与6~8時間後、 24時間後に血液検査を実施
中腫瘍量かつCrCl<80mL/minの患者では、 20mgおよび50mg初回投与時の検査頻度は高腫瘍量のスケジュールに準じる。 なお、 ベネクレクスタ®適正使用ガイド²⁾では、 オビヌツズマブ併用の高腫瘍量において、 20mgおよび50mgの各初回投与時は入院下で約2~3L/日を目標に、 必要に応じて静脈内の水分補給を行うよう記載されている。
オビヌツズマブの易感染症と血液毒性
B型肝炎ウイルス再活性化による肝炎が報告されており、 投与前に感染の有無を確認し必要な処置を行う。
また、 好中球減少・発熱性好中球減少・白血球減少・血小板減少が生じ得るため、 治療前後を通じて定期的に血液検査を実施する。 必要に応じてG-CSF製剤の使用も考慮する。
RMP【重要な特定されたリスク】
RMP : 医薬品リスク管理計画書
ベネトクラクス :
- TLS
- 骨髄抑制
- 感染症
- CYP3A阻害剤との薬物相互作用
オビヌツズマブ :
- Infusion reaction
- TLS
- 血小板減少
- 好中球減少、 白血球減少
- 感染症
- B型肝炎ウイルスの再活性化
- 進行性多巣性白質脳症
- 心障害
- 消化管穿孔
- 間質性肺疾患
出典
1) アッヴィ合同株式会社. ベネクレクスタ®錠10mg/50mg/100mg 電子添文 (2025年11月改訂 第10版)
2) アッヴィ合同株式会社. ベネクレクスタ®錠10mg/50mg/100mg 適正使用ガイド (2025年11月作成)
3) Blood. 2024;144(18):1924-1935.
最終更新 : 2025年11月26日
執筆 : HOKUTO編集部がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。








