Romidepsin
ロミデプシン (イストダックス®)
治療スケジュール
概要
監修医師
ROM:ロミデプシン(イストダックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 14mg/m² 点滴静注 | 全コース | Day 1、8、15 |
前投薬
| 5-HT3受容体拮抗薬、 デキサメタゾン (中等度催吐性リスク) |
その他
| 1コースは4週間. |
| 用量制限毒性:血小板減少、 好中球減少、 心毒性. |
Romidepsinの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「ブリストル・マイヤーズ スクイブ株式会社」 の外部サイトへ遷移します.
主な有害事象
TCL-001試験¹⁾より引用
骨髄抑制
- 血小板減少症 (97.9%、 ≧Grade3 37.5%)
- リンパ球数減少症 (83.3%、 ≧Grade3 66.7%)
- 白血球減少症 (81.3%、 ≧Grade3 47.9%)
- 好中球減少症 (81.3%、 ≧Grade3 54.2%)
- 貧血 (33.3%、 ≧Grade3 12.5%)
- ヘモグロビン減少 (18.8%、 ≧Grade3 6.3%)
主な有害事象
- 感染症 (22.9%、 ≧Grade3 12.5%)
- 心障害 (12.5%、 ≧Grade3 2.1%)
- 味覚異常 (60.4%、 ≧Grade3 0%)
- 悪心 (54.2%、 ≧Grade3 0%)
- 食欲減退 (47.9%、 ≧Grade3 6.3%)
- 発熱 (45.8%、 ≧Grade3 6.3%)
- 嘔吐 (39.6%、 ≧Grade3 0%)
- 疲労 (31.3%、 ≧Grade3 2.1%)
- 便秘 (29.2%、 ≧Grade3 2.1%)
- 倦怠感 (27.1%、 ≧Grade3 2.1%)
- 下痢 (27.1%、 ≧Grade3 0%)
- 低リン酸血症 (18.8%、 ≧Grade3 10.4%)
- ALT増加 (16.7%、 ≧Grade3 2.1%)
- AST増加 (16.7%、 ≧Grade3 0%)
- 口内炎 (14.6%、 ≧Grade3 0%)
- 低カリウム血症 (14.6%、 ≧Grade3 0%)
- 注射部位反応 (12.5%、 ≧Grade3 0%)
- 低カルシウム血症 (10.4%、 ≧Grade3 0%)
- 頭痛 (10.4%、 ≧Grade3 0%)
- 発疹 (10.4%、 ≧Grade3 0%)
その他重要な有害事象
- 腫瘍崩壊症候群 (6.3%、 ≧Grade3 2.1%)
- 過敏症 (頻度不明)
特徴と注意点
- ロミデプシンはヒストン脱アセチル化酵素阻害薬.
- 心電図異常および電解質異常に注意.
- 毎回投与前日または投与日に電解質検査と心電図検査の実施を推奨.
- HBV、 EBVの再活性化に注意、 投与中は定期的に肝機能検査を行う.
- ST合剤および抗ヘルペスウイルス剤投与を推奨 (CD4陽性Tリンパ球減少の場合).
- 肝機能低下患者では、 減量を考慮.
- 血小板減少、 好中球減少、 心毒性には以下の通り対応.
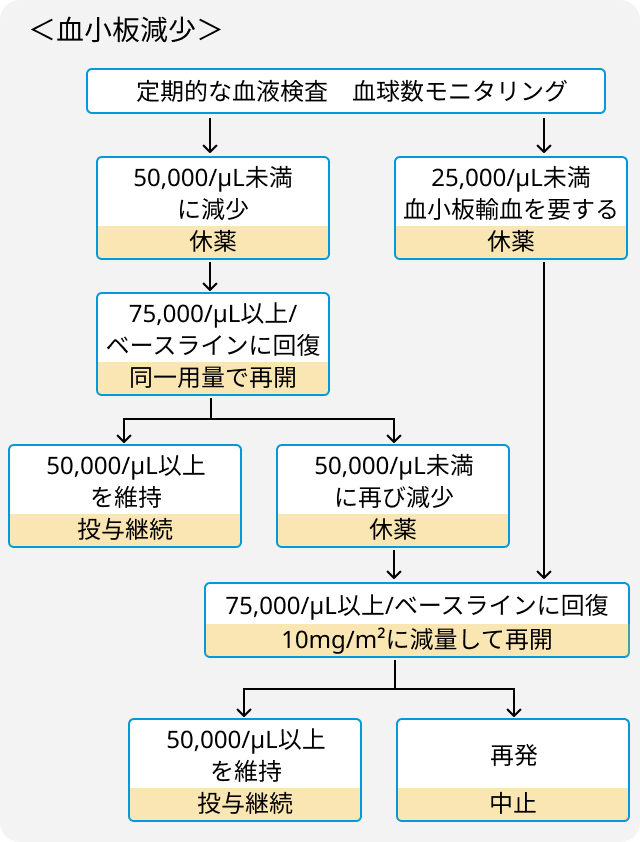
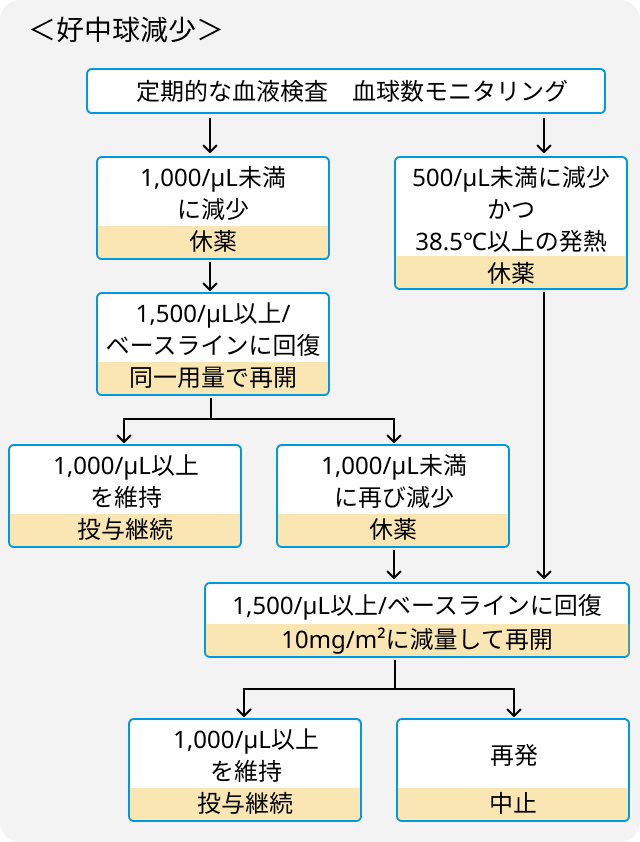
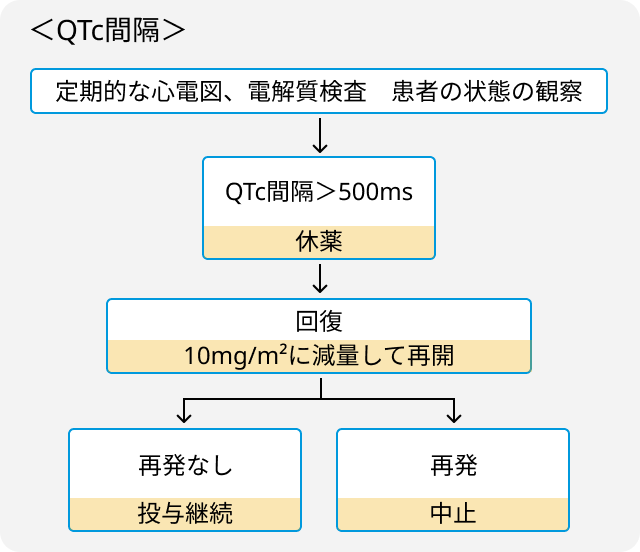

関連する臨床試験の結果
TCL-001試験¹⁾
概要
- 対象:再発難治性PTCL、CTCL日本人患者40例
- シングルアーム試験
- 主要評価項目:ORR
- 副次評価項目:DoR、 PFS、 TTR、 TTP
ORR:全奏効率 DoR:奏効持続期間 PFS:無増悪生存期間 TTR:奏効までの期間 TTP:無増悪期間
結果
- ORR:42.5%
- DoR中央値:337日
- PFS中央値:170日
- TTR中央値:56.0日
- TTP中央値:170日
GPI-06-0002試験²⁾
概要
- 対象:再発難治性PTCL、 CTCL患者130例
- シングルアーム試験
- 主要評価項目:ORR
- 副次評価項目:DoR、 PFS、 OS
結果
- ORR:26.2%
- DoR中央値:28ヵ月
- PFS中央値:4.0ヵ月
- OS中央値:11.3ヵ月
参考文献
最終更新:2021年8月13日
監修医師:東海大学血液腫瘍内科 扇屋大輔
Romidepsinの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
Romidepsin
ロミデプシン (イストダックス®)
2025年01月07日更新
ROM:ロミデプシン(イストダックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 14mg/m² 点滴静注 | 全コース | Day 1、8、15 |
前投薬
| 5-HT3受容体拮抗薬、 デキサメタゾン (中等度催吐性リスク) |
その他
| 1コースは4週間. |
| 用量制限毒性:血小板減少、 好中球減少、 心毒性. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「ブリストル・マイヤーズ スクイブ株式会社」 の外部サイトへ遷移します.
主な有害事象
TCL-001試験¹⁾より引用
骨髄抑制
- 血小板減少症 (97.9%、 ≧Grade3 37.5%)
- リンパ球数減少症 (83.3%、 ≧Grade3 66.7%)
- 白血球減少症 (81.3%、 ≧Grade3 47.9%)
- 好中球減少症 (81.3%、 ≧Grade3 54.2%)
- 貧血 (33.3%、 ≧Grade3 12.5%)
- ヘモグロビン減少 (18.8%、 ≧Grade3 6.3%)
主な有害事象
- 感染症 (22.9%、 ≧Grade3 12.5%)
- 心障害 (12.5%、 ≧Grade3 2.1%)
- 味覚異常 (60.4%、 ≧Grade3 0%)
- 悪心 (54.2%、 ≧Grade3 0%)
- 食欲減退 (47.9%、 ≧Grade3 6.3%)
- 発熱 (45.8%、 ≧Grade3 6.3%)
- 嘔吐 (39.6%、 ≧Grade3 0%)
- 疲労 (31.3%、 ≧Grade3 2.1%)
- 便秘 (29.2%、 ≧Grade3 2.1%)
- 倦怠感 (27.1%、 ≧Grade3 2.1%)
- 下痢 (27.1%、 ≧Grade3 0%)
- 低リン酸血症 (18.8%、 ≧Grade3 10.4%)
- ALT増加 (16.7%、 ≧Grade3 2.1%)
- AST増加 (16.7%、 ≧Grade3 0%)
- 口内炎 (14.6%、 ≧Grade3 0%)
- 低カリウム血症 (14.6%、 ≧Grade3 0%)
- 注射部位反応 (12.5%、 ≧Grade3 0%)
- 低カルシウム血症 (10.4%、 ≧Grade3 0%)
- 頭痛 (10.4%、 ≧Grade3 0%)
- 発疹 (10.4%、 ≧Grade3 0%)
その他重要な有害事象
- 腫瘍崩壊症候群 (6.3%、 ≧Grade3 2.1%)
- 過敏症 (頻度不明)
特徴と注意点
- ロミデプシンはヒストン脱アセチル化酵素阻害薬.
- 心電図異常および電解質異常に注意.
- 毎回投与前日または投与日に電解質検査と心電図検査の実施を推奨.
- HBV、 EBVの再活性化に注意、 投与中は定期的に肝機能検査を行う.
- ST合剤および抗ヘルペスウイルス剤投与を推奨 (CD4陽性Tリンパ球減少の場合).
- 肝機能低下患者では、 減量を考慮.
- 血小板減少、 好中球減少、 心毒性には以下の通り対応.




関連する臨床試験の結果
TCL-001試験¹⁾
概要
- 対象:再発難治性PTCL、CTCL日本人患者40例
- シングルアーム試験
- 主要評価項目:ORR
- 副次評価項目:DoR、 PFS、 TTR、 TTP
ORR:全奏効率 DoR:奏効持続期間 PFS:無増悪生存期間 TTR:奏効までの期間 TTP:無増悪期間
結果
- ORR:42.5%
- DoR中央値:337日
- PFS中央値:170日
- TTR中央値:56.0日
- TTP中央値:170日
GPI-06-0002試験²⁾
概要
- 対象:再発難治性PTCL、 CTCL患者130例
- シングルアーム試験
- 主要評価項目:ORR
- 副次評価項目:DoR、 PFS、 OS
結果
- ORR:26.2%
- DoR中央値:28ヵ月
- PFS中央値:4.0ヵ月
- OS中央値:11.3ヵ月
参考文献
最終更新:2021年8月13日
監修医師:東海大学血液腫瘍内科 扇屋大輔
Romidepsinの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




