Bosutinib
ボスチニブ(ボシュリフ®)
治療スケジュール
概要
監修医師
Bosutinib:ボスチニブ(ボシュリフ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 500mg 1日1回 経口 | 1~ | Day 1~ |
その他
| 初発の慢性期CMLの場合は1日1回400mgを食後に経口投与. |
| 重篤な有害事象がなく、 十分な血液学的効果、細胞遺伝学的効果又は分子遺伝学的効果がみられない場合は、100mgずつ1日1回600mgまで増量可能. 詳細は概要を参照. |
| 有害事象発現時の減量・休薬・中止基準は概要を参照. |
Bosutinibの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「ファイザー株式会社」 の外部サイトへ遷移します.
主な有害事象
1048試験¹⁾、 AV001試験 (BFORE試験) ²⁾より引用.
骨髄抑制
- 血小板数減少 (≧Grade3 5.0%¹⁾、 ≧Grade3 5.6%²⁾).
- 貧血 (≧Grade3 0.0%¹⁾、 ≧Grade3 3.4%²⁾).
- 好中球数減少 (≧Grade3 8.3%¹⁾、 ≧Grade3 0.7%²⁾).
- リンパ球数減少 (≧Grade3 6.7%¹⁾、 ≧Grade3 0.0%²⁾).
主な有害事象
- 肝障害 (80.0%¹⁾、 ≧Grade3 48.3%¹⁾、 39.9%²⁾、 ≧Grade3 24.3%²⁾).
- 下痢 (86.7%¹⁾、 ≧Grade3 15.0%¹⁾、 70.1%²⁾、 ≧Grade3 10.8%²⁾).
- 感染症 (65.0%¹⁾、 ≧Grade3 6.7%¹⁾、 44.4%²⁾、 ≧Grade3 3.4%²⁾).
- 出血 (8.3%¹⁾、 ≧Grade3 0.0%¹⁾、 15.3%²⁾、 ≧Grade3 1.1%²⁾).
- 膵炎/リパーゼ増加 (26.7%¹⁾、 ≧Grade3 15.0%¹⁾、 13.8%²⁾、 ≧Grade3 10.1%²⁾).
その他重要な有害事象
- 体液貯留 (8.3%¹⁾、 ≧Grade3 1.7%¹⁾、 7.8%²⁾、 ≧Grade3 0.4%²⁾).
特徴と注意点
適応
- 第2世代TKI (tyrosine kinase inhibitor).
- ABLキナーゼのみならずSrcファミリーキナーゼを阻害するが、 c-KITやPDGFRに対する抑制効果は弱い.
特徴
- 肝障害があらわれることがあるため、 投与開始後最初の2ヵ月間は2週間毎、 3ヵ月目は1回、 以降状況に応じて検査を行う.
- CYP3A4で代謝されるため相互作用に注意.
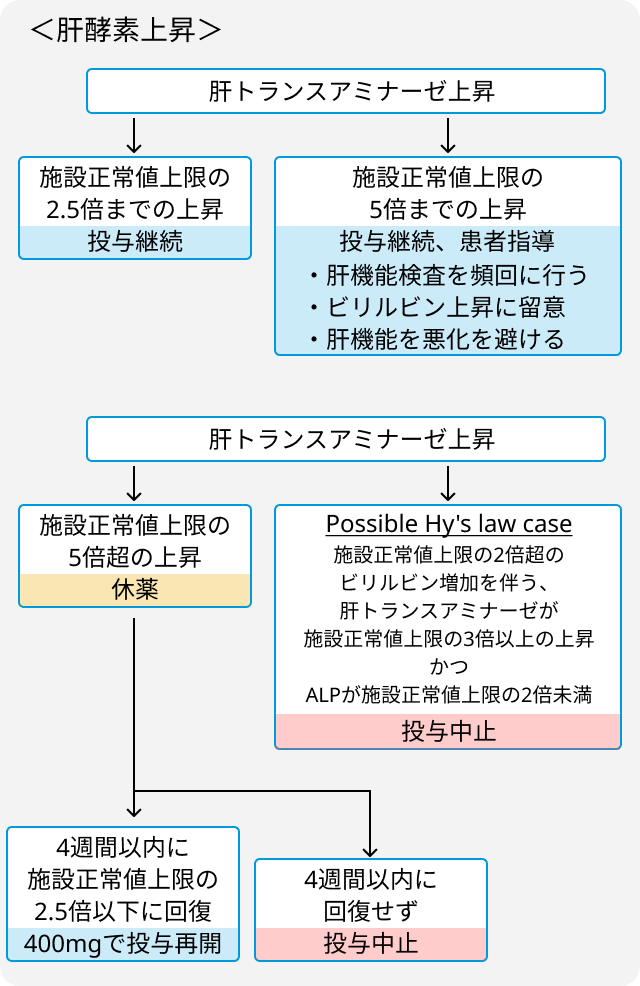
- 肝酵素上昇に対する減量・休薬・中止基準.
- 下痢・悪心・嘔吐に対する減量・休薬・中止基準.
.png?alt=media&token=d3092620-f1c5-447e-9366-05c851b2da1d)
- 好中球減少・血小板減少に対する減量・休薬・中止基準.
%20(1).png?alt=media&token=2367a088-ac55-42f9-b78a-04692ea17703)
- 体液貯留に対する減量・休薬・中止基準.
.png?alt=media&token=fddbd93f-874b-4a94-b18c-a5b51f9253e8)
- QT間隔延長に対する減量・休薬・中止基準.
.png?alt=media&token=444aaa6d-3c83-4d18-b4d6-0e8f52087558)
関連する臨床試験の結果
1048試験¹⁾
概要
- 対象:初発の日本人フィラデルフィア染色体陽性慢性期CML.
- 単群、 非盲検、 国内第II相試験.
MMR: Major Molecular Response (分子遺伝学的大奏効; BCR-ABL1*2≦0.1%) 、 MR4.0: Molecular Response4.0 (BCR-ABL1≦0.01%) 、 MR4.5: Molecular Response4.5 (BCR-ABL1≦0.0032%) 、 CCyR: Complete Cytogenic Response (細胞遺伝学的完全寛解) .
結果
- 12ヵ月時点のMMR:55.0% (90%CI 44.4-65.6、 p<0.0001).
- 3、 6、 9、 12ヵ月時点のMR4.0:0.0%、 18.3%、 25.0%、 31.7%.
- 3、 6、 9、 12ヵ月時点のMR4.5:0.0%、 8.3%、 16.7%、 21.7%.
- MMR、 MR4.0、 MR4.5までの期間中央値:24.1週、 36.0週、 36.2週.
- 12ヵ月時点のCCyR:80.0% (90%CI 71.5-88.5).
AV001試験(BFORE試験)²⁾
概要
- 対象:初発の慢性期CML.
- ボスチニブとイマチニブを比較する国際共同第III相試験.
MMR: Major Molecular Response (分子遺伝学的大奏効; BCR-ABL1*2≦0.1%) 、 MR4.0: Molecular Response4.0 (BCR-ABL1≦0.01%) 、 MR4.5: Molecular Response4.5 (BCR-ABL1≦0.0032%) 、 CCyR: Complete Cytogenic Response (細胞遺伝学的完全寛解) .
結果
- 12ヵ月時点のMMR:ボスチニブ群 47.2% vs イマチニブ群 36.9% (OR 1.55、 95%CI 1.07-2.23、 p=0.0200).
- 3ヵ月時点のMMR:ボスチニブ群 4.1% vs イマチニブ群 1.7% (p=0.0578).
- 6ヵ月時点のMMR:ボスチニブ群 35.0% vs イマチニブ群 18.3% (p<0.0001).
- 9ヵ月時点のMMR:ボスチニブ群 42.3% vs イマチニブ群 29.5% (p=0.0015).
- MMRまでの期間中央値:ボスチニブ群 24.7週 vs イマチニブ群 36.3週.
- 3ヵ月時点のMR4.0:ボスチニブ群 0.4% vs イマチニブ群 0.0% (p=0.1649).
- 6ヵ月時点のMR4.0:ボスチニブ群 9.8% vs イマチニブ群 4.6% (p=0.0145).
- 9ヵ月時点のMR4.0:ボスチニブ群 13.8% vs イマチニブ群 8.3% (p=0.0296).
- 12ヵ月時点のMR4.0:ボスチニブ群 20.7% vs イマチニブ群 12.0% (p=0.0052).
- 3ヵ月時点のMR4.5:ボスチニブ群 0.0% vs イマチニブ群 0.0%.
- 6ヵ月時点のMR4.5:ボスチニブ群 2.0% vs イマチニブ群 0.8% (p=0.1385).
- 9ヵ月時点のMR4.5:ボスチニブ群 4.5% vs イマチニブ群 2.9% (p=0.1879).
- 12ヵ月時点のMR4.5:ボスチニブ群 8.1% vs イマチニブ群 3.3% (p=0.0119).
- 12ヵ月時点のCCyR:ボスチニブ群 7.72% vs イマチニブ群 66.4% (OR 1.74、 95%CI 1.16-2.61、 p=0.0075).
参考文献
最終更新:2023年6月12日
執筆担当:北里大学病院薬剤部 宮島律子
監修医師:東海大学血液腫瘍内科 扇屋大輔
Bosutinibの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
Bosutinib
ボスチニブ(ボシュリフ®)
2023年06月12日更新
Bosutinib:ボスチニブ(ボシュリフ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 500mg 1日1回 経口 | 1~ | Day 1~ |
その他
| 初発の慢性期CMLの場合は1日1回400mgを食後に経口投与. |
| 重篤な有害事象がなく、 十分な血液学的効果、細胞遺伝学的効果又は分子遺伝学的効果がみられない場合は、100mgずつ1日1回600mgまで増量可能. 詳細は概要を参照. |
| 有害事象発現時の減量・休薬・中止基準は概要を参照. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「ファイザー株式会社」 の外部サイトへ遷移します.
主な有害事象
1048試験¹⁾、 AV001試験 (BFORE試験) ²⁾より引用.
骨髄抑制
- 血小板数減少 (≧Grade3 5.0%¹⁾、 ≧Grade3 5.6%²⁾).
- 貧血 (≧Grade3 0.0%¹⁾、 ≧Grade3 3.4%²⁾).
- 好中球数減少 (≧Grade3 8.3%¹⁾、 ≧Grade3 0.7%²⁾).
- リンパ球数減少 (≧Grade3 6.7%¹⁾、 ≧Grade3 0.0%²⁾).
主な有害事象
- 肝障害 (80.0%¹⁾、 ≧Grade3 48.3%¹⁾、 39.9%²⁾、 ≧Grade3 24.3%²⁾).
- 下痢 (86.7%¹⁾、 ≧Grade3 15.0%¹⁾、 70.1%²⁾、 ≧Grade3 10.8%²⁾).
- 感染症 (65.0%¹⁾、 ≧Grade3 6.7%¹⁾、 44.4%²⁾、 ≧Grade3 3.4%²⁾).
- 出血 (8.3%¹⁾、 ≧Grade3 0.0%¹⁾、 15.3%²⁾、 ≧Grade3 1.1%²⁾).
- 膵炎/リパーゼ増加 (26.7%¹⁾、 ≧Grade3 15.0%¹⁾、 13.8%²⁾、 ≧Grade3 10.1%²⁾).
その他重要な有害事象
- 体液貯留 (8.3%¹⁾、 ≧Grade3 1.7%¹⁾、 7.8%²⁾、 ≧Grade3 0.4%²⁾).
特徴と注意点
適応
- 第2世代TKI (tyrosine kinase inhibitor).
- ABLキナーゼのみならずSrcファミリーキナーゼを阻害するが、 c-KITやPDGFRに対する抑制効果は弱い.
特徴
- 肝障害があらわれることがあるため、 投与開始後最初の2ヵ月間は2週間毎、 3ヵ月目は1回、 以降状況に応じて検査を行う.
- CYP3A4で代謝されるため相互作用に注意.
- 肝酵素上昇に対する減量・休薬・中止基準.

- 下痢・悪心・嘔吐に対する減量・休薬・中止基準.
.png?alt=media&token=d3092620-f1c5-447e-9366-05c851b2da1d)
- 好中球減少・血小板減少に対する減量・休薬・中止基準.
%20(1).png?alt=media&token=2367a088-ac55-42f9-b78a-04692ea17703)
- 体液貯留に対する減量・休薬・中止基準.
.png?alt=media&token=fddbd93f-874b-4a94-b18c-a5b51f9253e8)
- QT間隔延長に対する減量・休薬・中止基準.
.png?alt=media&token=444aaa6d-3c83-4d18-b4d6-0e8f52087558)
関連する臨床試験の結果
1048試験¹⁾
概要
- 対象:初発の日本人フィラデルフィア染色体陽性慢性期CML.
- 単群、 非盲検、 国内第II相試験.
MMR: Major Molecular Response (分子遺伝学的大奏効; BCR-ABL1*2≦0.1%) 、 MR4.0: Molecular Response4.0 (BCR-ABL1≦0.01%) 、 MR4.5: Molecular Response4.5 (BCR-ABL1≦0.0032%) 、 CCyR: Complete Cytogenic Response (細胞遺伝学的完全寛解) .
結果
- 12ヵ月時点のMMR:55.0% (90%CI 44.4-65.6、 p<0.0001).
- 3、 6、 9、 12ヵ月時点のMR4.0:0.0%、 18.3%、 25.0%、 31.7%.
- 3、 6、 9、 12ヵ月時点のMR4.5:0.0%、 8.3%、 16.7%、 21.7%.
- MMR、 MR4.0、 MR4.5までの期間中央値:24.1週、 36.0週、 36.2週.
- 12ヵ月時点のCCyR:80.0% (90%CI 71.5-88.5).
AV001試験(BFORE試験)²⁾
概要
- 対象:初発の慢性期CML.
- ボスチニブとイマチニブを比較する国際共同第III相試験.
MMR: Major Molecular Response (分子遺伝学的大奏効; BCR-ABL1*2≦0.1%) 、 MR4.0: Molecular Response4.0 (BCR-ABL1≦0.01%) 、 MR4.5: Molecular Response4.5 (BCR-ABL1≦0.0032%) 、 CCyR: Complete Cytogenic Response (細胞遺伝学的完全寛解) .
結果
- 12ヵ月時点のMMR:ボスチニブ群 47.2% vs イマチニブ群 36.9% (OR 1.55、 95%CI 1.07-2.23、 p=0.0200).
- 3ヵ月時点のMMR:ボスチニブ群 4.1% vs イマチニブ群 1.7% (p=0.0578).
- 6ヵ月時点のMMR:ボスチニブ群 35.0% vs イマチニブ群 18.3% (p<0.0001).
- 9ヵ月時点のMMR:ボスチニブ群 42.3% vs イマチニブ群 29.5% (p=0.0015).
- MMRまでの期間中央値:ボスチニブ群 24.7週 vs イマチニブ群 36.3週.
- 3ヵ月時点のMR4.0:ボスチニブ群 0.4% vs イマチニブ群 0.0% (p=0.1649).
- 6ヵ月時点のMR4.0:ボスチニブ群 9.8% vs イマチニブ群 4.6% (p=0.0145).
- 9ヵ月時点のMR4.0:ボスチニブ群 13.8% vs イマチニブ群 8.3% (p=0.0296).
- 12ヵ月時点のMR4.0:ボスチニブ群 20.7% vs イマチニブ群 12.0% (p=0.0052).
- 3ヵ月時点のMR4.5:ボスチニブ群 0.0% vs イマチニブ群 0.0%.
- 6ヵ月時点のMR4.5:ボスチニブ群 2.0% vs イマチニブ群 0.8% (p=0.1385).
- 9ヵ月時点のMR4.5:ボスチニブ群 4.5% vs イマチニブ群 2.9% (p=0.1879).
- 12ヵ月時点のMR4.5:ボスチニブ群 8.1% vs イマチニブ群 3.3% (p=0.0119).
- 12ヵ月時点のCCyR:ボスチニブ群 7.72% vs イマチニブ群 66.4% (OR 1.74、 95%CI 1.16-2.61、 p=0.0075).
参考文献
最終更新:2023年6月12日
執筆担当:北里大学病院薬剤部 宮島律子
監修医師:東海大学血液腫瘍内科 扇屋大輔
Bosutinibの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




