Vonicog Alfa
ボニコグ アルファ (ボンベンディ®)
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ボニコグアルファ|遺伝子組換えヒトvon Willebrand因子
* 「武田薬品工業株式会社」 の外部サイトへ遷移します。
投与スケジュール
(1) 出血時の止血治療と管理
(2) 周術期の止血管理
(3) 出血傾向抑制のための定期的な投与
(1) 出血時の止血治療と管理
■軽度出血および大出血治療時の推奨用量

FVIII: C<40%もしくは不明の場合は、 初回投与後10分以内にFVIII製剤を投与する。
初回投与後VWFリストセチンコファクター活性 (VWF: RCo) の補充レベルを60%超、 FVIII: Cの補充レベルを40%超となるようにする。
大出血事象の場合は適宜VWF: RCoトラフ値50%超を維持する。
(2) 周術期の止血管理
手術1時間前の投与量は以下の式で算出
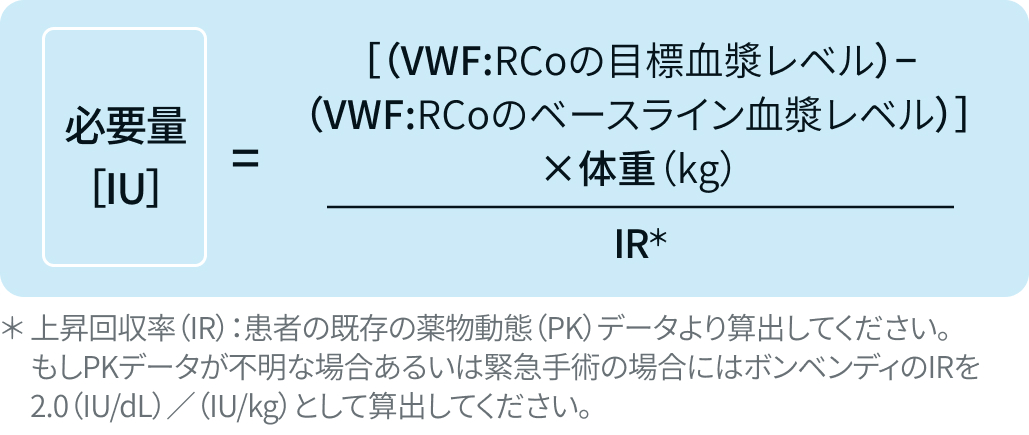
手術ごとの推奨目標ピーク値は以下の通り

手術開始後も上記値をモニタリングする
■待機的手術
FVIII: Cを術前に推奨目標値 (小手術 30%、 大手術 60%) 以上に上昇させるため、 手術を開始する12~24時間前に40~60IU/kgを投与可。
手術開始前3時間以内に血漿中FVIII: Cを測定する。 FVIII: Cが推奨目標値以上の場合は、 手術開始1時間前までに本剤を単剤で投与し、 VWF: RCoおよびFVIII: Cを適切なレベルに維持する。 FVIII: Cが推奨目標値未満の場合は、 本剤に加えてFVIII製剤を投与し、 VWF: RCoおよびFVIII: Cを上昇させる。
■緊急手術
可能であれば、 手術前3時間以内にベースラインVWF: RCoおよびFVIII: Cを測定する。 測定できずベースラインが不明な場合は、 手術1時間前の投与量は40~60IU/kgが推奨される。
手術の1時間前に本剤を単剤もしくはFVIII製剤と併用して初回投与し、 VWF: RCoおよびFVIII: Cが適切な止血レベルまで上昇するよう投与量を調節する。
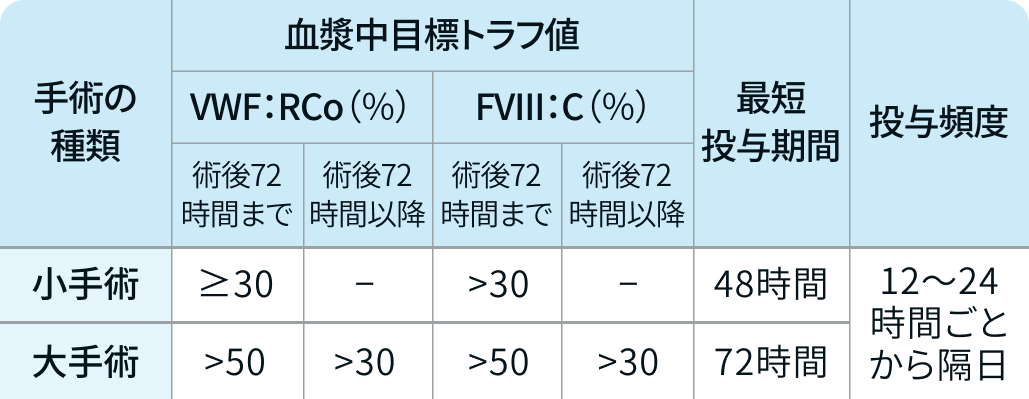
■術後推奨される目標トラフ値・維持投与
(3) 出血傾向抑制のための定期的な投与
1回あたり40~60IU/kgを週1~3回投与する. 状態に応じて1回あたり80IU/kgを超えない範囲で適宜増減可能。
定期時補充療法中に破綻出血が発現し、 内因性FVIII: Cが40%未満または不明な場合には、 本剤投与後にFVIII製剤を併用投与する。
主な有害事象
添付文書より主な有害事象を引用。
主な有害事象 (≧2%)
- 浮動性めまい - 回転性めまい - 嘔吐 - 悪心
重大な有害事象
- ショック、 アナフィラキシー (頻度不明)
- 血栓塞栓症 (1.4%)
特徴と注意点
フォン・ヴィレブランド病と本薬剤
フォン・ヴィレブランド病 (von Willebrand病, VWD) はフォン・ヴィレブランド因子 (von Willebrand因子, VWF) の質的異常または量的欠損に起因する常染色体遺伝性疾患である。
VWFは血管内皮細胞や骨髄巨核球で産生される高分子糖蛋白であり、 止血機構の初期にて血小板膜糖蛋白やコラーゲンに結合し、 血管障害局所に血小板を粘着・凝集させる。 また、 血中では血液凝固第VII因子と結合し、 第VII因子の安定化にも寄与している。
ボニコグ アルファは遺伝子組み換えヒトVWF製剤であり、 VWDにおける出血傾向の抑制に適応を有する。
注意点
■インヒビターについて
VWFまたは血液凝固第VIII因子 (FVIII) に対するインヒビターが発生する恐れがあるため、 予想した止血効果が得られない場合にはインヒビター発生を疑い、 上昇回収率やインヒビターの検査などを行う。 インヒビターはアナフィラキシー反応に伴って発生することがある。
■血栓塞栓症リスクについて
ADAMTS13低値の患者や手術予定患者などでは投与により血栓塞栓症が起こる可能性がある。
■用法及び用量について
血漿第VIII因子活性 (FVIII: C) を測定し、 必要に応じてFVIII製剤を併用投与する。
血液由来のFVIII (乾燥濃縮人血液凝固第VIII因子) 製剤を併用する場合、 当該製剤のVWF含有量に留意し、 ボニコグ アルファの用量を調整する。
必ず付属の溶解器を用いて調製し、 溶解後は3時間以内に使用する。 添付溶解液10mLで溶解し、 4mL/分を超えない速度で緩徐に静注する。
関連する臨床試験の結果
国際共同第II相試験 (071001試験) ¹⁾
海外第II相、 多施設共同、 部分無作為化試験. 重度のVWD患者37例の出血事象に対する止血効果安全性および忍容性の評価等を検討
結果
- 出血事象に対して止血効果判定が1回以上得られた22例のうち、 消化管出血を除外した18例の奏効率 : 100% (90%CI 84.7-100.0)
- 止血効果判定が 「著効」 または 「有効」 であった出血事象の割合 : 100% (90%CI 97.7-100.0)
安全性
- 副作用発現率 : 13.5% (5/37例)
- 胸部不快感、 心拍数増加、 頻脈、 注入部位異常、感覚、 味覚異常、 心電図T波逆転、 全身性掻痒症、 ほてりが各1例 (2.7%)
- 重篤な副作用および投与中止に至った副作用 : 胸部不快感および心拍数増加1例 (2.7%)
- VWDまたはFVIIIに対するインヒビターの発現なし
海外第III相試験 (071101試験)²⁾
海外第III相、 非盲検、 非対称、 非無作為化、 多施設共同試験. 大手術または小手術を受ける18歳以上の重度VWD患者15例の全般的止血効果および安全性等を検討.
結果
- 全般的止血効果 「著効」 または 「有効」 : 100% (90%CI 81.9-100.0)
- 術中の止血効果 「著効」 : 86.7%
- 術中の止血効果 「有効」 : 13.3%
安全性
- 重篤な副作用 : 深部静脈血栓症1例
- 血栓性事象の発現 : 1例
- VWDまたはFVIIIに対するインヒビターの発現なし
海外第III試験 (071301試験)³⁾
海外第III相、 国際共同、 非盲検試験. 重度VWD患者23例を対象に定期補充療法として投与したときの有効性、 免疫原性、 血栓形成および安全性等を評価.
結果
- 年間自然出血率 : 前出血時補充療法群 0.663回/年、 血漿由来VWF製剤からの切り替え群 1.692回/年
- 前出血時補充療法群における年間自然出血率の減少達成割合 : 92.3% (12/13例)
- 切り替え群における年間自然出血率の減少達成割合 : 90.0% (9/10例)
安全性
- 副作用発現率 : 4.3% (1/23例)
- VWDまたはFVIIIに対するインヒビターの発現なし
出典
- Blood. 2015 Oct 22;126(17):2038-46.
- J Thromb Haemost. 2019 Jan;17(1):52-62.
- Blood. 2022 Jul 14;140(2):89-98.
最終更新 : 2025年1月22日
執筆担当 : 北里大学病院薬剤部 宮島律子
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Vonicog Alfa
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ボニコグアルファ|遺伝子組換えヒトvon Willebrand因子
* 「武田薬品工業株式会社」 の外部サイトへ遷移します。
投与スケジュール
(1) 出血時の止血治療と管理
(2) 周術期の止血管理
(3) 出血傾向抑制のための定期的な投与
(1) 出血時の止血治療と管理
■軽度出血および大出血治療時の推奨用量

FVIII: C<40%もしくは不明の場合は、 初回投与後10分以内にFVIII製剤を投与する。
初回投与後VWFリストセチンコファクター活性 (VWF: RCo) の補充レベルを60%超、 FVIII: Cの補充レベルを40%超となるようにする。
大出血事象の場合は適宜VWF: RCoトラフ値50%超を維持する。
(2) 周術期の止血管理
手術1時間前の投与量は以下の式で算出

手術ごとの推奨目標ピーク値は以下の通り

手術開始後も上記値をモニタリングする
■待機的手術
FVIII: Cを術前に推奨目標値 (小手術 30%、 大手術 60%) 以上に上昇させるため、 手術を開始する12~24時間前に40~60IU/kgを投与可。
手術開始前3時間以内に血漿中FVIII: Cを測定する。 FVIII: Cが推奨目標値以上の場合は、 手術開始1時間前までに本剤を単剤で投与し、 VWF: RCoおよびFVIII: Cを適切なレベルに維持する。 FVIII: Cが推奨目標値未満の場合は、 本剤に加えてFVIII製剤を投与し、 VWF: RCoおよびFVIII: Cを上昇させる。
■緊急手術
可能であれば、 手術前3時間以内にベースラインVWF: RCoおよびFVIII: Cを測定する。 測定できずベースラインが不明な場合は、 手術1時間前の投与量は40~60IU/kgが推奨される。
手術の1時間前に本剤を単剤もしくはFVIII製剤と併用して初回投与し、 VWF: RCoおよびFVIII: Cが適切な止血レベルまで上昇するよう投与量を調節する。
■術後推奨される目標トラフ値・維持投与

(3) 出血傾向抑制のための定期的な投与
1回あたり40~60IU/kgを週1~3回投与する. 状態に応じて1回あたり80IU/kgを超えない範囲で適宜増減可能。
定期時補充療法中に破綻出血が発現し、 内因性FVIII: Cが40%未満または不明な場合には、 本剤投与後にFVIII製剤を併用投与する。
主な有害事象
添付文書より主な有害事象を引用。
主な有害事象 (≧2%)
- 浮動性めまい - 回転性めまい - 嘔吐 - 悪心
重大な有害事象
- ショック、 アナフィラキシー (頻度不明)
- 血栓塞栓症 (1.4%)
特徴と注意点
フォン・ヴィレブランド病と本薬剤
フォン・ヴィレブランド病 (von Willebrand病, VWD) はフォン・ヴィレブランド因子 (von Willebrand因子, VWF) の質的異常または量的欠損に起因する常染色体遺伝性疾患である。
VWFは血管内皮細胞や骨髄巨核球で産生される高分子糖蛋白であり、 止血機構の初期にて血小板膜糖蛋白やコラーゲンに結合し、 血管障害局所に血小板を粘着・凝集させる。 また、 血中では血液凝固第VII因子と結合し、 第VII因子の安定化にも寄与している。
ボニコグ アルファは遺伝子組み換えヒトVWF製剤であり、 VWDにおける出血傾向の抑制に適応を有する。
注意点
■インヒビターについて
VWFまたは血液凝固第VIII因子 (FVIII) に対するインヒビターが発生する恐れがあるため、 予想した止血効果が得られない場合にはインヒビター発生を疑い、 上昇回収率やインヒビターの検査などを行う。 インヒビターはアナフィラキシー反応に伴って発生することがある。
■血栓塞栓症リスクについて
ADAMTS13低値の患者や手術予定患者などでは投与により血栓塞栓症が起こる可能性がある。
■用法及び用量について
血漿第VIII因子活性 (FVIII: C) を測定し、 必要に応じてFVIII製剤を併用投与する。
血液由来のFVIII (乾燥濃縮人血液凝固第VIII因子) 製剤を併用する場合、 当該製剤のVWF含有量に留意し、 ボニコグ アルファの用量を調整する。
必ず付属の溶解器を用いて調製し、 溶解後は3時間以内に使用する。 添付溶解液10mLで溶解し、 4mL/分を超えない速度で緩徐に静注する。
関連する臨床試験の結果
国際共同第II相試験 (071001試験) ¹⁾
海外第II相、 多施設共同、 部分無作為化試験. 重度のVWD患者37例の出血事象に対する止血効果安全性および忍容性の評価等を検討
結果
- 出血事象に対して止血効果判定が1回以上得られた22例のうち、 消化管出血を除外した18例の奏効率 : 100% (90%CI 84.7-100.0)
- 止血効果判定が 「著効」 または 「有効」 であった出血事象の割合 : 100% (90%CI 97.7-100.0)
安全性
- 副作用発現率 : 13.5% (5/37例)
- 胸部不快感、 心拍数増加、 頻脈、 注入部位異常、感覚、 味覚異常、 心電図T波逆転、 全身性掻痒症、 ほてりが各1例 (2.7%)
- 重篤な副作用および投与中止に至った副作用 : 胸部不快感および心拍数増加1例 (2.7%)
- VWDまたはFVIIIに対するインヒビターの発現なし
海外第III相試験 (071101試験)²⁾
海外第III相、 非盲検、 非対称、 非無作為化、 多施設共同試験. 大手術または小手術を受ける18歳以上の重度VWD患者15例の全般的止血効果および安全性等を検討.
結果
- 全般的止血効果 「著効」 または 「有効」 : 100% (90%CI 81.9-100.0)
- 術中の止血効果 「著効」 : 86.7%
- 術中の止血効果 「有効」 : 13.3%
安全性
- 重篤な副作用 : 深部静脈血栓症1例
- 血栓性事象の発現 : 1例
- VWDまたはFVIIIに対するインヒビターの発現なし
海外第III試験 (071301試験)³⁾
海外第III相、 国際共同、 非盲検試験. 重度VWD患者23例を対象に定期補充療法として投与したときの有効性、 免疫原性、 血栓形成および安全性等を評価.
結果
- 年間自然出血率 : 前出血時補充療法群 0.663回/年、 血漿由来VWF製剤からの切り替え群 1.692回/年
- 前出血時補充療法群における年間自然出血率の減少達成割合 : 92.3% (12/13例)
- 切り替え群における年間自然出血率の減少達成割合 : 90.0% (9/10例)
安全性
- 副作用発現率 : 4.3% (1/23例)
- VWDまたはFVIIIに対するインヒビターの発現なし
出典
- Blood. 2015 Oct 22;126(17):2038-46.
- J Thromb Haemost. 2019 Jan;17(1):52-62.
- Blood. 2022 Jul 14;140(2):89-98.
最終更新 : 2025年1月22日
執筆担当 : 北里大学病院薬剤部 宮島律子
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




