Ide-cel(Idecabtagene vicleucel)
イデカブタゲン ビクルユーセル (アベクマ®)
Ide-cel:イデカブタゲン ビクルユーセル(アベクマ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| CAR発現T細胞として280×10⁶~540×10⁶個 点滴静注 | 1 | Day1 |
前投薬
| Infusion reaction軽減のため、 投与30~60分前に抗ヒスタミン薬、 解熱鎮痛薬を投与. |
その他
| 細胞採取から本剤投与に至るまでの手順は、 製造販売業者が提供するマニュアル等を参照すること. |
| リンパ球除去化学療法終了3日後に本剤を投与. |
| サイトカイン放出症候群の緊急時に備えて、 トシリズマブの在庫を確保する. |
| 1つの静注用バッグごとに解凍開始から60分以内に投与を完了する. |
| 複数の静注用バッグを用いる際は、 1つ目の投与が完了するまで、 2つ目以降の静注用バッグは解凍しない. |
| カリウムを含有するため、 注入速度は10mL/minを超えない. |
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*ブリストル・マイヤーズ スクイブ株式会社の外部サイトへ遷移します。
投与スケジュール

リンパ球除去化学療法 : Ide-cel投与の5日前から、 1日1回3日間、 シクロホスファミド300mg/m²を30分かけて点滴静注し、 続いてフルダラビン30mg/m²を30分かけて点滴静注 (腎機能に応じて減量)。 前処置期間中には0.9%生理食塩液1,000mLによる補液が推奨され、 制吐薬の使用は可能だがステロイドの投与は避ける。
Ide-cel : 投与前30~60分にアセトアミノフェンおよびヒスタミンH₁受容体拮抗薬を前投与し、 体重にかかわらずCAR-T細胞を4.5×10⁸個 (範囲 : 2.8~5.4×10⁸個) を目標に、 最大速度10mL/分*で単回静注投与。
*カリウムを含有するため投与速度を遵守すること²⁾。
臨床試験では、 Ide-celの投与はリンパ球除去化学療法終了3日後から最長7日間まで延期可能とされていた²⁾。
Key Data|臨床試験結果
📊 KarMMa-3試験
N Engl J Med. 2023;388(11):1002-1014.
免疫調節薬 (IMiD)、 プロテアソーム阻害薬 (PI)、 ダラツムマブを含む2~4レジメンの治療歴があり、 直前レジメンに難治性を示した再発または難治性の多発性骨髄腫患者386例 (うち日本人9例) を対象とした第III相無作為化比較試験。 患者は2:1の比でIde-cel群 (254例) または標準治療群* (132例) に無作為に割り付けられ、 主要評価項目としてPFSが評価された。
*標準治療群 : 以下の5レジメンのいずれかが選択された。
- ダラツムマブ+ポマリドミド+デキサメタゾン
- ダラツムマブ+ボルテゾミブ+デキサメタゾン
- イキサゾミブ+レナリドミド+デキサメタゾン
- カルフィルゾミブ+デキサメタゾン
- エロツズマブ+ポマリドミド+デキサメタゾン
【有効性】Ide-cel群 (vs 標準治療群)
- PFS中央値 13.3ヵ月 (vs 4.4ヵ月)
HR 0.49 (95%CI 0.38ー0.65、 p<0.001)
- 全奏効割合 71% (vs 42%)
- 完全奏効割合 39% (vs 5%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- CRS 88% (5%)
- 好中球減少症 78% (76%)
- 貧血 66% (51%)
- 血小板減少症 54% (42%)
- リンパ球減少症 29% (28%)
- 感染症 58% (24%)
- 神経系事象 15% (3%)
📊 KarMMa試験
N Engl J Med. 2021;384(8):705-716.
IMiD、 PI、 抗CD38抗体を含む3レジメン以上の治療歴を有する再発または難治性の多発性骨髄腫患者140例を対象とした単群非盲検第II相試験。 128例にIde-celを投与し、 主要評価項目として全奏効割合が評価された。
【有効性】
- 全奏効割合 73%
- 完全奏効割合 33%
- PFS中央値 8.8ヵ月
- 奏効期間中央値 10.7ヵ月
- 6ヵ月時点のCAR陽性T細胞検出率 59%
- 12ヵ月時点のCAR陽性T細胞検出率 36%
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 好中球減少症 91% (89%)
- 貧血 70% (60%)
- 血小板減少症 63% (52%)
- サイトカイン放出症候群 84% (5%)
- 神経毒性 18% (3%)
- リンパ球減少症 27% (27%)
- 発熱性好中球減少症 16% (16%)
- 感染症 69% (22%)
各プロトコル
適格基準
KarMMa-3試験³⁾およびKarMMa試験⁴⁾の主な適格基準は以下のとおり。
- 18歳以上
- ECOG PS 0-1
- IMiD、 PI、 抗CD38抗体を含む2レジメン以上 (KarMMa-3) または3レジメン以上 (KarMMa) の治療歴を有する
- 中枢神経系に骨髄腫病変を有さない
腎障害患者に対する用量調整
リンパ球除去化学療法においては、 フルダラビンを腎機能に応じて以下の通り減量する²⁾。
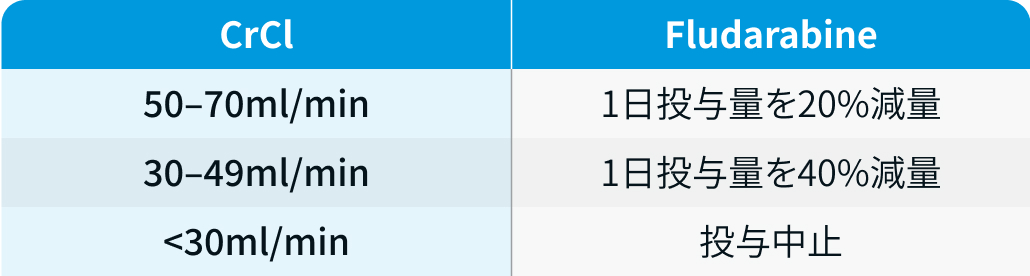
ブリッジング療法
臨床試験では、 白血球アフェレーシス後~リンパ球除去化学療法の間に行うブリッジング療法は、 化学療法開始の14日前までに終了することが規定されていた²⁾。 ピボタル試験におけるブリッジング療法の使用状況は以下のとおり。
KarMMa-3試験³⁾ : 全体225例 (日本人4例)
- デキサメタゾン 84.0%/100%
- ポマリドミド 48.4%/50%
- ダラツムマブ 32.9%/50%
- エロツズマブ 26.2%/0%
- カルフィルゾミブ 14.7%/50%
KarMMa試験⁴⁾ : 全体137例 (日本人9例)
- デキサメタゾン 71.5%/88.9%
- シクロホスファミド 35.8%/22.2%
- ダラツムマブ 27.7%/22.2%
- カルフィルゾミブ 23.4%/22.2%
- ボルテゾミブ 19.7%/22.2%
- ポマリドミド 18.2%/11.1%
レジメンの特徴と注意点
作用機序の特徴
Ide-celは、 BCMAを標的とするCARを患者自身のT細胞に導入した遺伝子改変T細胞製剤である。 CARは、 抗ヒトBCMA抗体由来のscFv、 CD8αヒンジ・膜貫通部位、 4-1BBおよびCD3ζの細胞内シグナルドメインで構成される。 BCMA発現細胞に結合するとT細胞が活性化され、 増殖やサイトカイン産生、 細胞傷害作用を発揮し、 抗腫瘍効果を示すと考えられている。
レジメンの位置付け⁵⁾
本剤の適応症は、 BCMAを標的とするCAR-T療法歴がなく、 IMiD・PI・抗CD38抗体を含む2種類以上の治療歴を有し、 直近治療に難治性または再発を示した再発・難治性多発性骨髄腫である。
中枢神経系病変を有する場合、 形質細胞白血病・ワルデンストレーム・マクログロブリン血症・POEMS症候群・アミロイドーシスに伴う重大な臓器障害の既往がある場合、 同種造血幹細胞移植歴がある場合、 3年以内に治療を要した他の悪性腫瘍を有する場合、 またはECOG PSが2~4である場合は、 適応外。
レジメン適用時の注意事項⁵⁾
Infusion reaction : 投与30~60分前に、 アセトアミノフェンとH1ブロッカーを前投与する。 副腎皮質ステロイド剤は、 生命を脅かす緊急時を除き使用しない。
CRS : 発熱、 低血圧、 頻脈、 悪寒、 CRP上昇、 低酸素、 頭痛、 倦怠感などに留意し、 十分な観察を行う。 異常が認められた場合は、 製造販売業者が提供する最新のCRS管理アルゴリズムおよび関連情報に基づき、 適切に対応する。
神経系事象 (ICANS含む) : 錯乱、 脳症、 失語、 幻覚、 精神状態変化、 譫妄、 嗜眠、 振戦、 傾眠、 意識レベル低下、 注意力・記憶・書字障害などの症状に十分留意して観察を行う。 異常が認められた場合は、 製造販売業者が提供する最新の神経系事象管理アルゴリズムおよび関連情報に基づき、 適切に対応する。
感染症・発熱性好中球減少症 : 活動性の感染症や炎症性疾患がある場合は、 投与を避ける。 細菌・真菌・ウイルスなどによる重度感染症や発熱性好中球減少症が発現し、 死亡例も報告されている。 状態を十分に観察し、 異常時には速やかに抗菌薬など適切な処置を行う。
ウイルス再活性化への注意 : B型・C型肝炎ウイルスキャリアまたは既往感染者では、 肝炎ウイルス再活性化の可能性がある。 HIV感染者ではウイルス増加、 サイトメガロウイルス感染による肺炎や死亡の報告もある。 投与前には各種ウイルス (HBV、 HCV、 HIV、 CMV) の感染有無を確認し、 肝機能やウイルスマーカーのモニタリングを行うなど慎重な対応が求められる。
血球減少 : 好中球・血小板・リンパ球の減少や貧血などが数週間以上持続することがある。 定期的な血液検査を実施し、 患者の状態を継続的に観察する。
低γグロブリン血症 : 必要に応じて免疫グロブリン補充療法を検討する。
腫瘍崩壊症候群 : 血清電解質と腎機能を適宜評価し、 十分な観察を行う。
出典
- ブリストル・マイヤーズ スクイブ株式会社. アベクマ点滴静注 電子添文. 2025年3月改訂 (第1版).
- ブリストル・マイヤーズ スクイブ株式会社. 適正使用ガイド. 2025年3月改訂.
- N Engl J Med. 2023;388(11):1002-1014.
- N Engl J Med. 2021;384(8):705-716.
- 厚生労働省. アベクマ点滴静注 最適使用推進ガイドライン 令和6年5月改訂.
最終更新 : 2025年7月17日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Ide-cel(Idecabtagene vicleucel)
Ide-cel:イデカブタゲン ビクルユーセル(アベクマ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| CAR発現T細胞として280×10⁶~540×10⁶個 点滴静注 | 1 | Day1 |
前投薬
| Infusion reaction軽減のため、 投与30~60分前に抗ヒスタミン薬、 解熱鎮痛薬を投与. |
その他
| 細胞採取から本剤投与に至るまでの手順は、 製造販売業者が提供するマニュアル等を参照すること. |
| リンパ球除去化学療法終了3日後に本剤を投与. |
| サイトカイン放出症候群の緊急時に備えて、 トシリズマブの在庫を確保する. |
| 1つの静注用バッグごとに解凍開始から60分以内に投与を完了する. |
| 複数の静注用バッグを用いる際は、 1つ目の投与が完了するまで、 2つ目以降の静注用バッグは解凍しない. |
| カリウムを含有するため、 注入速度は10mL/minを超えない. |
概要
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*ブリストル・マイヤーズ スクイブ株式会社の外部サイトへ遷移します。
投与スケジュール

リンパ球除去化学療法 : Ide-cel投与の5日前から、 1日1回3日間、 シクロホスファミド300mg/m²を30分かけて点滴静注し、 続いてフルダラビン30mg/m²を30分かけて点滴静注 (腎機能に応じて減量)。 前処置期間中には0.9%生理食塩液1,000mLによる補液が推奨され、 制吐薬の使用は可能だがステロイドの投与は避ける。
Ide-cel : 投与前30~60分にアセトアミノフェンおよびヒスタミンH₁受容体拮抗薬を前投与し、 体重にかかわらずCAR-T細胞を4.5×10⁸個 (範囲 : 2.8~5.4×10⁸個) を目標に、 最大速度10mL/分*で単回静注投与。
*カリウムを含有するため投与速度を遵守すること²⁾。
臨床試験では、 Ide-celの投与はリンパ球除去化学療法終了3日後から最長7日間まで延期可能とされていた²⁾。
Key Data|臨床試験結果
📊 KarMMa-3試験
N Engl J Med. 2023;388(11):1002-1014.
免疫調節薬 (IMiD)、 プロテアソーム阻害薬 (PI)、 ダラツムマブを含む2~4レジメンの治療歴があり、 直前レジメンに難治性を示した再発または難治性の多発性骨髄腫患者386例 (うち日本人9例) を対象とした第III相無作為化比較試験。 患者は2:1の比でIde-cel群 (254例) または標準治療群* (132例) に無作為に割り付けられ、 主要評価項目としてPFSが評価された。
*標準治療群 : 以下の5レジメンのいずれかが選択された。
- ダラツムマブ+ポマリドミド+デキサメタゾン
- ダラツムマブ+ボルテゾミブ+デキサメタゾン
- イキサゾミブ+レナリドミド+デキサメタゾン
- カルフィルゾミブ+デキサメタゾン
- エロツズマブ+ポマリドミド+デキサメタゾン
【有効性】Ide-cel群 (vs 標準治療群)
- PFS中央値 13.3ヵ月 (vs 4.4ヵ月)
HR 0.49 (95%CI 0.38ー0.65、 p<0.001)
- 全奏効割合 71% (vs 42%)
- 完全奏効割合 39% (vs 5%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- CRS 88% (5%)
- 好中球減少症 78% (76%)
- 貧血 66% (51%)
- 血小板減少症 54% (42%)
- リンパ球減少症 29% (28%)
- 感染症 58% (24%)
- 神経系事象 15% (3%)
📊 KarMMa試験
N Engl J Med. 2021;384(8):705-716.
IMiD、 PI、 抗CD38抗体を含む3レジメン以上の治療歴を有する再発または難治性の多発性骨髄腫患者140例を対象とした単群非盲検第II相試験。 128例にIde-celを投与し、 主要評価項目として全奏効割合が評価された。
【有効性】
- 全奏効割合 73%
- 完全奏効割合 33%
- PFS中央値 8.8ヵ月
- 奏効期間中央値 10.7ヵ月
- 6ヵ月時点のCAR陽性T細胞検出率 59%
- 12ヵ月時点のCAR陽性T細胞検出率 36%
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 好中球減少症 91% (89%)
- 貧血 70% (60%)
- 血小板減少症 63% (52%)
- サイトカイン放出症候群 84% (5%)
- 神経毒性 18% (3%)
- リンパ球減少症 27% (27%)
- 発熱性好中球減少症 16% (16%)
- 感染症 69% (22%)
各プロトコル
適格基準
KarMMa-3試験³⁾およびKarMMa試験⁴⁾の主な適格基準は以下のとおり。
- 18歳以上
- ECOG PS 0-1
- IMiD、 PI、 抗CD38抗体を含む2レジメン以上 (KarMMa-3) または3レジメン以上 (KarMMa) の治療歴を有する
- 中枢神経系に骨髄腫病変を有さない
腎障害患者に対する用量調整
リンパ球除去化学療法においては、 フルダラビンを腎機能に応じて以下の通り減量する²⁾。

ブリッジング療法
臨床試験では、 白血球アフェレーシス後~リンパ球除去化学療法の間に行うブリッジング療法は、 化学療法開始の14日前までに終了することが規定されていた²⁾。 ピボタル試験におけるブリッジング療法の使用状況は以下のとおり。
KarMMa-3試験³⁾ : 全体225例 (日本人4例)
- デキサメタゾン 84.0%/100%
- ポマリドミド 48.4%/50%
- ダラツムマブ 32.9%/50%
- エロツズマブ 26.2%/0%
- カルフィルゾミブ 14.7%/50%
KarMMa試験⁴⁾ : 全体137例 (日本人9例)
- デキサメタゾン 71.5%/88.9%
- シクロホスファミド 35.8%/22.2%
- ダラツムマブ 27.7%/22.2%
- カルフィルゾミブ 23.4%/22.2%
- ボルテゾミブ 19.7%/22.2%
- ポマリドミド 18.2%/11.1%
レジメンの特徴と注意点
作用機序の特徴
Ide-celは、 BCMAを標的とするCARを患者自身のT細胞に導入した遺伝子改変T細胞製剤である。 CARは、 抗ヒトBCMA抗体由来のscFv、 CD8αヒンジ・膜貫通部位、 4-1BBおよびCD3ζの細胞内シグナルドメインで構成される。 BCMA発現細胞に結合するとT細胞が活性化され、 増殖やサイトカイン産生、 細胞傷害作用を発揮し、 抗腫瘍効果を示すと考えられている。
レジメンの位置付け⁵⁾
本剤の適応症は、 BCMAを標的とするCAR-T療法歴がなく、 IMiD・PI・抗CD38抗体を含む2種類以上の治療歴を有し、 直近治療に難治性または再発を示した再発・難治性多発性骨髄腫である。
中枢神経系病変を有する場合、 形質細胞白血病・ワルデンストレーム・マクログロブリン血症・POEMS症候群・アミロイドーシスに伴う重大な臓器障害の既往がある場合、 同種造血幹細胞移植歴がある場合、 3年以内に治療を要した他の悪性腫瘍を有する場合、 またはECOG PSが2~4である場合は、 適応外。
レジメン適用時の注意事項⁵⁾
Infusion reaction : 投与30~60分前に、 アセトアミノフェンとH1ブロッカーを前投与する。 副腎皮質ステロイド剤は、 生命を脅かす緊急時を除き使用しない。
CRS : 発熱、 低血圧、 頻脈、 悪寒、 CRP上昇、 低酸素、 頭痛、 倦怠感などに留意し、 十分な観察を行う。 異常が認められた場合は、 製造販売業者が提供する最新のCRS管理アルゴリズムおよび関連情報に基づき、 適切に対応する。
神経系事象 (ICANS含む) : 錯乱、 脳症、 失語、 幻覚、 精神状態変化、 譫妄、 嗜眠、 振戦、 傾眠、 意識レベル低下、 注意力・記憶・書字障害などの症状に十分留意して観察を行う。 異常が認められた場合は、 製造販売業者が提供する最新の神経系事象管理アルゴリズムおよび関連情報に基づき、 適切に対応する。
感染症・発熱性好中球減少症 : 活動性の感染症や炎症性疾患がある場合は、 投与を避ける。 細菌・真菌・ウイルスなどによる重度感染症や発熱性好中球減少症が発現し、 死亡例も報告されている。 状態を十分に観察し、 異常時には速やかに抗菌薬など適切な処置を行う。
ウイルス再活性化への注意 : B型・C型肝炎ウイルスキャリアまたは既往感染者では、 肝炎ウイルス再活性化の可能性がある。 HIV感染者ではウイルス増加、 サイトメガロウイルス感染による肺炎や死亡の報告もある。 投与前には各種ウイルス (HBV、 HCV、 HIV、 CMV) の感染有無を確認し、 肝機能やウイルスマーカーのモニタリングを行うなど慎重な対応が求められる。
血球減少 : 好中球・血小板・リンパ球の減少や貧血などが数週間以上持続することがある。 定期的な血液検査を実施し、 患者の状態を継続的に観察する。
低γグロブリン血症 : 必要に応じて免疫グロブリン補充療法を検討する。
腫瘍崩壊症候群 : 血清電解質と腎機能を適宜評価し、 十分な観察を行う。
出典
- ブリストル・マイヤーズ スクイブ株式会社. アベクマ点滴静注 電子添文. 2025年3月改訂 (第1版).
- ブリストル・マイヤーズ スクイブ株式会社. 適正使用ガイド. 2025年3月改訂.
- N Engl J Med. 2023;388(11):1002-1014.
- N Engl J Med. 2021;384(8):705-716.
- 厚生労働省. アベクマ点滴静注 最適使用推進ガイドライン 令和6年5月改訂.
最終更新 : 2025年7月17日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。





