FCR
フルダラビン、シクロホスファミド、リツキシマブ
治療スケジュール
概要
監修医師
FLU:フルダラビン(フルダラ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 25mg/m² 点滴静注 | 1~6 | Day 1~3 |
CPA:シクロホスファミド(エンドキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 250mg/m² 点滴静注 | 1~6 | Day 1~3 |
RIT:リツキシマブ(リツキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 375mg/m² 点滴静注 | 1 | Day 0 (Day 1の投与も可) |
| 500mg/m² 点滴静注 | 2~6 | Day 1 (Day 0の投与も可) |
前投薬
| RIT投与前に解熱鎮痛薬、 抗ヒスタミン薬を使用. |
| FC投与日は5-HT3受容体拮抗薬を使用. |
その他
| 1コース28日間、 最大6コース投与. |
| RITはFCの前日 or 同日に投与. |
| 本邦でのCLLに対するRITの承認用量は初回375mg/m²、 2回目以降500mg/m². |
| 経口の場合、 FLU 24mg/m²+CPA 150mg/m² を5日間. |
| 経口投与の有効性は示唆されているが、 静脈投与との無作為化比較試験は行われていない. |
FCRの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
主な有害事象
REACH試験¹⁾より引用
骨髄抑制
- 貧血 (≧Grade3 12%)
- 好中球減少 (≧Grade3 42%)
- 血小板減少 (≧Grade3 11%)
主な有害事象
- 発熱性好中球減少症 (≧Grade3 12%)
- 嘔気 (40%)
- 発熱 (25%)
- 嘔吐 (21%)
- 倦怠感 (16%)
- 悪寒 (15%)
- 便秘 (15%)
- 下痢 (12%)
- 咳嗽 (12%)
- 無力症 (10%)
その他
- 肺炎 (≧Grade3 5%)
- 頭痛 (9%)
特徴と注意点
- 標準治療実施可能 (fit) な未治療進行期CLLに対して、 推奨される化学免疫療法の一つ.
- FCR療法の実施条件として、 CLL8試験²⁾ の登録基準が用いられることが多い.
CLL8登録基準:80歳未満、併存疾患指数 (CIRS) スコア 6以下、CrCl 70ml/min以上
- 長期の治療成績も報告されており、 IGHV遺伝子変異のある場合、 特に予後が良好³⁾.
- IGHV変異を有する若年症例の一部には治癒が期待できる可能性があり、 検討すべき治療のひとつと考えられている.
- ただし、 17p欠失症例に対しての効果は乏しく、 予後は不良とされる²⁾.
17p欠失症例に対するFCR効果:3年PFS 18%、 3年OS 38%
- 本療法による初回治療後、 3年以降に再発した場合はFCR療法を繰り返すことで良好な結果が得られており、 再投与は妥当な治療とされる⁴⁾ ⁵⁾.
- FC療法には経口の変法⁶⁾ はあるものの、 投与経路の違い (静脈投与 vs 経口投与) についての無作為化比較試験は、 リツキシマブ等との多剤併用レジメンも含め行われていない.
注射:FLU 25mg/m² +CPA 250mg/m² を3日間
経口:FLU 24mg/m² +CPA 150mg/m² を5日間
- 腫瘍量が多い場合、 腫瘍崩壊症候群が出現するため、 十分な予防が必要.
感染対策
- 発熱性好中球減少症のリスク (年齢>65歳、 Alb≦3.5g/dL、 好中球数<1500/mm³、 肝疾患合併) に応じてG-CSF製剤の投与を考慮.
- 血小板数<2.5万/mm³やG-CSFを併用しても発熱性好中球減少症を合併した場合は、 シクロホスファミドを20%減量する.
- ST合剤の予防内服を考慮 (特にG-CSFやリツキシマブを使用する際).
- HBV再活性化リスクを考慮し、 適切なスクリーニング検査とモニタリングを行う.
各薬剤の副作用と対策
- リツキシマブはinfusion reactionのリスクが高いため、 予防薬の投与を行い、 バイタルサインのモニタリングを行った上で段階的に投与速度を上げる.
- シクロホスファミドは出血性膀胱炎のリスクがあるため、 水分摂取を励行し排尿を促す.
関連する臨床試験の結果
CLL8試験²⁾
概要
- 対象:未治療のCD20陽性CLL患者 817例
- 第3相無作為化比較試験
- FCR療法又はFC療法を投与し、 PFSを比較
PFS:無増悪生存期間 OS:全生存期間
結果
- PFS (3年時点):FCR群 65% vs FC群 45% (HR:0.56 ; P<0.0001)
- FCR群はGrade3以上の好中球減少 (34% vs 21% ;P<0.0001)、および白血球減少 (24% vs 12% ; P<0.0001) をより頻繫に合併した.
- 重篤な感染症を含むその他の副作用や、 治療関連死亡は両群とも同等であった.
CLL8試験の長期追跡調査³⁾
結果
- 追跡期間中央値 5.9年
- PFS:FCR群 56.8ヵ月 vs FC群 32.9ヵ月 (HR:0.59 ; P<0.001)
- OS:FCR群 到達せず vs FC群 86ヵ月 (HR:0.68 ; P=0.001)
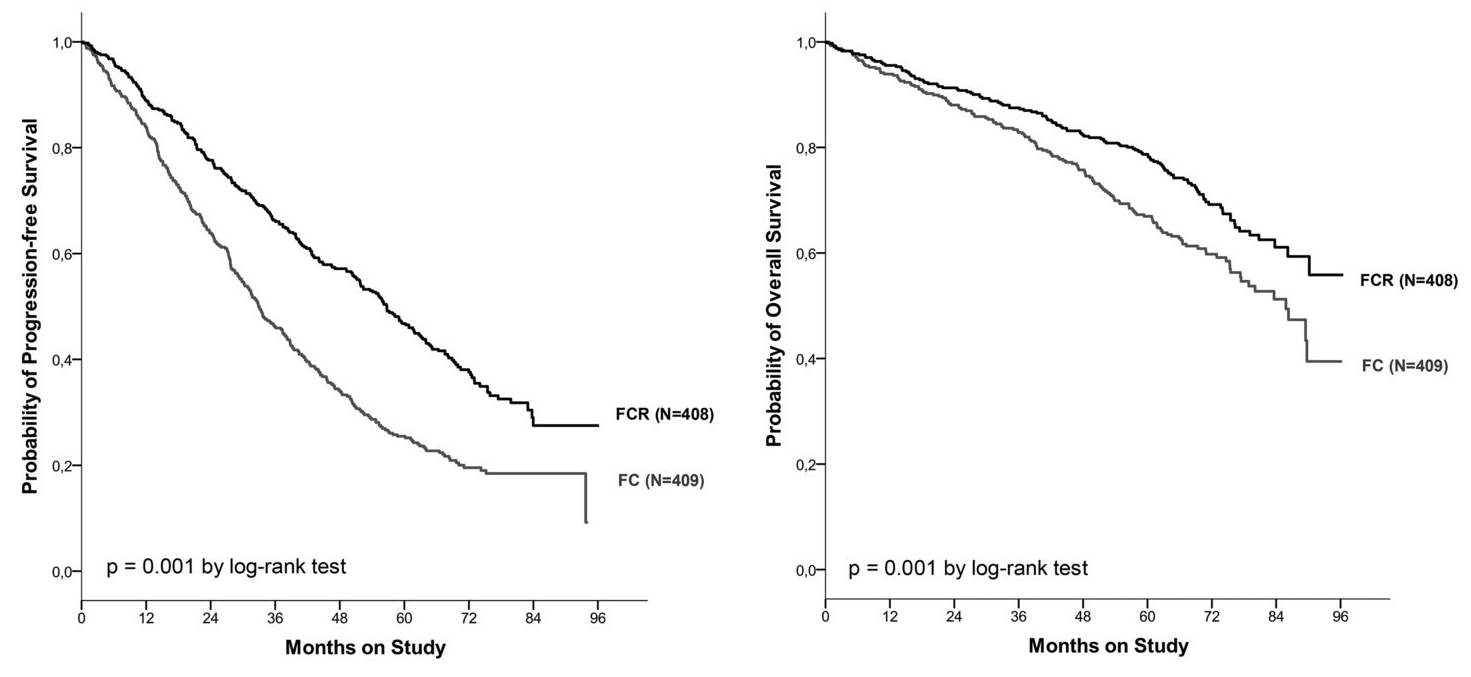
- IGHV変異型患者では、 FCRはFCと比較してPFSとOSを改善した (PFS: HR 0.47 ; P<0.001、 OS: HR 0.62 ; P=0.1). この改善は17p欠失以外のすべての細胞遺伝学的サブグループにも当てはまった.
- FCR群は治療後1年間の好中球減少の長期化率が高かった (16.6% vs 8.8% ; P=0.007).
REACH試験¹⁾
概要
- 対象:再発又は難治性のCD20陽性CLL患者 552例
参加条件:前治療でFC療法、RIT未投与かつFLU感受性患者
- 第3相無作為化比較試験
- FCR療法又はFC療法を投与し、 PFS、 奏効率を比較
結果
- 追跡期間中央値 25ヵ月
- PFS:FCR群 30.6ヵ月 vs FC群 20.6ヵ月 (HR:0.65 P<.001)
- 完全奏効率:FCR群 24.3% vs FC群 13.0%
- 奏効率:FCR群 69.9% vs FC群 58.0%
- OS:FCR群 到達せず vs FC群 52ヵ月
- 副作用は重篤、 軽度を含め、 発熱性好中球減少症、 注射関連反応、 良性・悪性新生物、 B型肝炎がわずかにFCR療法群で多かった.
- 感染症は管理可能であり、 両群とも同等であった.
参考文献
- J Clin Oncol. 2010 Apr 1;28(10):1756-65.
- Lancet. 2010 Oct 2;376(9747):1164-74.
- Blood. 2016 Jan 14;127(2):208-15.
- Blood. 2014 Nov 13;124(20):3059-64.
- Ann Oncol. 2015 Sep;26 Suppl 5:v78-84.
- Cancer. 2011 Jun 1;117(11):2452-60.
最終更新:2022年7月17日
執筆:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:伊勢原協同病院血液内科 扇屋大輔
FCRの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
FCR
フルダラビン、シクロホスファミド、リツキシマブ
2023年06月06日更新
FLU:フルダラビン(フルダラ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 25mg/m² 点滴静注 | 1~6 | Day 1~3 |
CPA:シクロホスファミド(エンドキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 250mg/m² 点滴静注 | 1~6 | Day 1~3 |
RIT:リツキシマブ(リツキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 375mg/m² 点滴静注 | 1 | Day 0 (Day 1の投与も可) |
| 500mg/m² 点滴静注 | 2~6 | Day 1 (Day 0の投与も可) |
前投薬
| RIT投与前に解熱鎮痛薬、 抗ヒスタミン薬を使用. |
| FC投与日は5-HT3受容体拮抗薬を使用. |
その他
| 1コース28日間、 最大6コース投与. |
| RITはFCの前日 or 同日に投与. |
| 本邦でのCLLに対するRITの承認用量は初回375mg/m²、 2回目以降500mg/m². |
| 経口の場合、 FLU 24mg/m²+CPA 150mg/m² を5日間. |
| 経口投与の有効性は示唆されているが、 静脈投与との無作為化比較試験は行われていない. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
主な有害事象
REACH試験¹⁾より引用
骨髄抑制
- 貧血 (≧Grade3 12%)
- 好中球減少 (≧Grade3 42%)
- 血小板減少 (≧Grade3 11%)
主な有害事象
- 発熱性好中球減少症 (≧Grade3 12%)
- 嘔気 (40%)
- 発熱 (25%)
- 嘔吐 (21%)
- 倦怠感 (16%)
- 悪寒 (15%)
- 便秘 (15%)
- 下痢 (12%)
- 咳嗽 (12%)
- 無力症 (10%)
その他
- 肺炎 (≧Grade3 5%)
- 頭痛 (9%)
特徴と注意点
- 標準治療実施可能 (fit) な未治療進行期CLLに対して、 推奨される化学免疫療法の一つ.
- FCR療法の実施条件として、 CLL8試験²⁾ の登録基準が用いられることが多い.
CLL8登録基準:80歳未満、併存疾患指数 (CIRS) スコア 6以下、CrCl 70ml/min以上
- 長期の治療成績も報告されており、 IGHV遺伝子変異のある場合、 特に予後が良好³⁾.
- IGHV変異を有する若年症例の一部には治癒が期待できる可能性があり、 検討すべき治療のひとつと考えられている.
- ただし、 17p欠失症例に対しての効果は乏しく、 予後は不良とされる²⁾.
17p欠失症例に対するFCR効果:3年PFS 18%、 3年OS 38%
- 本療法による初回治療後、 3年以降に再発した場合はFCR療法を繰り返すことで良好な結果が得られており、 再投与は妥当な治療とされる⁴⁾ ⁵⁾.
- FC療法には経口の変法⁶⁾ はあるものの、 投与経路の違い (静脈投与 vs 経口投与) についての無作為化比較試験は、 リツキシマブ等との多剤併用レジメンも含め行われていない.
注射:FLU 25mg/m² +CPA 250mg/m² を3日間
経口:FLU 24mg/m² +CPA 150mg/m² を5日間
- 腫瘍量が多い場合、 腫瘍崩壊症候群が出現するため、 十分な予防が必要.
感染対策
- 発熱性好中球減少症のリスク (年齢>65歳、 Alb≦3.5g/dL、 好中球数<1500/mm³、 肝疾患合併) に応じてG-CSF製剤の投与を考慮.
- 血小板数<2.5万/mm³やG-CSFを併用しても発熱性好中球減少症を合併した場合は、 シクロホスファミドを20%減量する.
- ST合剤の予防内服を考慮 (特にG-CSFやリツキシマブを使用する際).
- HBV再活性化リスクを考慮し、 適切なスクリーニング検査とモニタリングを行う.
各薬剤の副作用と対策
- リツキシマブはinfusion reactionのリスクが高いため、 予防薬の投与を行い、 バイタルサインのモニタリングを行った上で段階的に投与速度を上げる.
- シクロホスファミドは出血性膀胱炎のリスクがあるため、 水分摂取を励行し排尿を促す.
関連する臨床試験の結果
CLL8試験²⁾
概要
- 対象:未治療のCD20陽性CLL患者 817例
- 第3相無作為化比較試験
- FCR療法又はFC療法を投与し、 PFSを比較
PFS:無増悪生存期間 OS:全生存期間
結果
- PFS (3年時点):FCR群 65% vs FC群 45% (HR:0.56 ; P<0.0001)
- FCR群はGrade3以上の好中球減少 (34% vs 21% ;P<0.0001)、および白血球減少 (24% vs 12% ; P<0.0001) をより頻繫に合併した.
- 重篤な感染症を含むその他の副作用や、 治療関連死亡は両群とも同等であった.
CLL8試験の長期追跡調査³⁾
結果
- 追跡期間中央値 5.9年
- PFS:FCR群 56.8ヵ月 vs FC群 32.9ヵ月 (HR:0.59 ; P<0.001)
- OS:FCR群 到達せず vs FC群 86ヵ月 (HR:0.68 ; P=0.001)

- IGHV変異型患者では、 FCRはFCと比較してPFSとOSを改善した (PFS: HR 0.47 ; P<0.001、 OS: HR 0.62 ; P=0.1). この改善は17p欠失以外のすべての細胞遺伝学的サブグループにも当てはまった.
- FCR群は治療後1年間の好中球減少の長期化率が高かった (16.6% vs 8.8% ; P=0.007).
REACH試験¹⁾
概要
- 対象:再発又は難治性のCD20陽性CLL患者 552例
参加条件:前治療でFC療法、RIT未投与かつFLU感受性患者
- 第3相無作為化比較試験
- FCR療法又はFC療法を投与し、 PFS、 奏効率を比較
結果
- 追跡期間中央値 25ヵ月
- PFS:FCR群 30.6ヵ月 vs FC群 20.6ヵ月 (HR:0.65 P<.001)
- 完全奏効率:FCR群 24.3% vs FC群 13.0%
- 奏効率:FCR群 69.9% vs FC群 58.0%
- OS:FCR群 到達せず vs FC群 52ヵ月
- 副作用は重篤、 軽度を含め、 発熱性好中球減少症、 注射関連反応、 良性・悪性新生物、 B型肝炎がわずかにFCR療法群で多かった.
- 感染症は管理可能であり、 両群とも同等であった.
参考文献
- J Clin Oncol. 2010 Apr 1;28(10):1756-65.
- Lancet. 2010 Oct 2;376(9747):1164-74.
- Blood. 2016 Jan 14;127(2):208-15.
- Blood. 2014 Nov 13;124(20):3059-64.
- Ann Oncol. 2015 Sep;26 Suppl 5:v78-84.
- Cancer. 2011 Jun 1;117(11):2452-60.
最終更新:2022年7月17日
執筆:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:伊勢原協同病院血液内科 扇屋大輔
FCRの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




