D-BLd (D-VRd) 移植適応
ダラツムマブ、ボルテゾミブ、 レナリドミド、 デキサメタゾン
DARA-sc:ダラツムマブ(ダラキューロ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,800mg/body 皮下注 | 1~2 | Day 1、8、15、22 |
| 1,800mg/body 皮下注 | 3~6 | Day 1、15 |
| 1,800mg/body 皮下注 | 7~ | Day 1 |
BOR:ボルテゾミブ(ベルケイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1.3mg/m² 皮下注 | 1~6 | Day 1、4、8、11 |
LEN:レナリドミド(レブラミド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 25mg/body 経口 | 1~6 | Day 1~21 |
| 10mg/body 経口 | 7~ | Day 1~28 |
| 15mg/body 経口 (忍容性がある場合のみ) | 10~ | Day 1~28 |
DEX:デキサメタゾン(デカドロン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg/body 経口 | 1~6 | Day 1-4、9-12 |
前投薬
| Infusion reaction軽減のため、 ダラツムマブ投与開始1~3時間前に副腎皮質ホルモン、 解熱鎮痛薬、 抗ヒスタミン薬を投与。 必要に応じて、 遅発性反応に備え投与後にも副腎皮質ホルモン等を投与。 初回投与時はモンテルカスト10mgの前投薬を推奨。 |
その他
| 1コースは4週間 |
| 寛解導入療法を4サイクル施行後、自家造血幹細胞移植を行い、地固め療法を2サイクル実施したのち、維持療法へ移行する。 |
| 維持療法期は、レナリドミドをPDまたは許容できない毒性が生じるまで継続。ダラツムマブはCR以上かつMRD陰性(感度10⁻⁵以下)が12ヵ月以上持続し、かつ維持療法を24ヵ月以上実施した場合に中止可。 |
2025年6月25日、 造血幹細胞移植の適応となる未治療の多発性骨髄腫患者、 ならびに適応とならない未治療患者に対し、 ボルテゾミブ・レナリドミド・デキサメタゾンとの併用療法について、 新たに用法および用量が追加された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- ダラキューロ® (添付文書¹⁾ / 適正使用情報²⁾*)
*ヤンセンファーマ株式会社の外部サイトへ遷移します
- ベルケイド® (添付文書)
- レブラミド® (添付文書)
- レナデックス® (添付文書)
投与スケジュール
【1コース】28日間
【催吐性】 DARA: 最小度、 BOR/LEN: 軽度
【FN発症】低リスク**
**PERSEUS試験³⁾のFN発生率9.4%より編集部が分類
寛解導入療法を4サイクル施行後、 自家造血幹細胞移植を行い、 地固め療法を2サイクル実施したのち、 維持療法へ移行する。



ダラツムマブ : 1800mgをサイクル1・2では週1回、 サイクル3~6では2週に1回、 サイクル7以降では4週に1回皮下投与
インフュージョンリアクション軽減のため、 投与開始1~3時間前に副腎皮質ホルモン、 解熱鎮痛薬、 抗ヒスタミン薬を投与する。 必要に応じて、 遅発性反応に備え投与後にも副腎皮質ホルモン等を投与する¹⁾。 なお、 PERSEUS試験では初回投与時にモンテルカスト10mgの前投薬が推奨された。
ボルテゾミブ : 1.3 mg/m²をサイクル1~6の各サイクル1、 4、 8、 11日目に皮下投与
レナリドミド : 25mgをサイクル1~6の各サイクル1~21日目に経口投与。 サイクル7以降は10mgを連日経口投与し、 忍容性があれば3サイクル後に15mgへ増量可能
デキサメタゾン : 40mgをサイクル1~6の各サイクル1~4日目および9~12日目に経口投与
ダラツムマブ投与日は静脈内投与も選択可能
ダラツムマブは、 完全奏効 (CR) 以上を達成し、 MRD陰性 (感度10⁻⁵以下) の状態が12ヵ月以上持続し、 かつ維持療法を24ヵ月以上実施した場合に投与を中止する。 中止後、 CRの確定的消失 (免疫電気泳動または免疫固定法によるM蛋白の再出現、 または骨髄中の形質細胞が5%以上) またはMRDの再出現 (感度10⁻⁴以上) が認められた場合には、 ダラツムマブを再開する。
PERSEUS試験³⁾のプロトコルより引用
Key Data|臨床試験結果
📊 PERSEUS試験
新たに診断された自家造血幹細胞移植の適応となる多発性骨髄腫患者709例を対象とした多施設共同の第III相無作為化比較試験。 患者は皮下投与ダラツムマブ+ボルテゾミブ、 レナリドミド、 デキサメタゾン (D-VRd) 群355例と、 ボルテゾミブ、 レナリドミド、 デキサメタゾン (VRd) 単独群354例に1:1の比率で無作為に割り付けられ、 主要評価項目として無増悪生存期間 (PFS) が設定された。
【有効性】D-VRd群 (vs VRd群)
- PFS中央値 : 未到達 (vs 未到達)
- ハザード比 (HR) 0.42、 p<0.001
- 48ヵ月時点のPFS率 : 84.3% (vs 67.7%)
サブグループ解析 : ISS病期IIIの患者でHR 0.42 、 高リスクの細胞遺伝学的異常を持つ患者でHR 0.59
- CR+sCR率 : 87.9% (vs 70.1%、 p<0.001)
- MRD陰性率 (10⁻⁵閾値) : 75.2% (vs 47.5%)
【安全性】主な有害事象 : 全Grade (Grade 3/4)
- 好中球減少症 69.2% (62.1%)
- 血小板減少症 48.4% (29.1%)
- 貧血 22.2% (6.0%)
- 発熱性好中球減少症 9.7% (9.4%)
- 下痢 61.0% (10.5%)
- 末梢性感覚ニューロパチー 53.6% (4.3%)
- 便秘 33.9% (2.3%)
- 発熱 31.6% (2.3%)
- 不眠 27.1% (2.3%)
- 無力症 26.8% (3.4%)
- 咳嗽 24.2% (0.3%)
- 疲労 23.9% (2.8%)
- 皮疹 23.4% (2.6%)
- 背部痛 22.8% (0.6%)
- 末梢性浮腫 20.5% (1.1%)
- 悪心 20.2% (0.6%)
- 感染症全体 86.9% (35.3%)
- COVID-19 35.0% (3.4%)
- 上気道感染 31.6% (0.6%)
- 肺炎 18.2% (10.5%)
- 二次癌 10.5%
- Infusion reaction 6.0% (0.9%)
各プロトコル
適格基準
- 年齢 : 18歳~70歳
- ECOG PS : 0~2
- 好中球数 : ≧1,000/mm³
- 血小板数 : 骨髄の50%超が病変に関与している場合は ≧5万/mm³、 それ以外の場合は ≧7.5万/mm³
- ヘモグロビン : ≧7.5g/dL
- 腎機能 : CrCl ≧30mL/min
- 肝機能 : AST、 ALT ≦2.5× ULN、 総ビリルビン ≦1.5× ULN
用量レベル
ダラツムマブの減量は行わない。 ボルテゾミブ、 レナリドミド、 デキサメタゾンの用量レベルは以下のとおり。
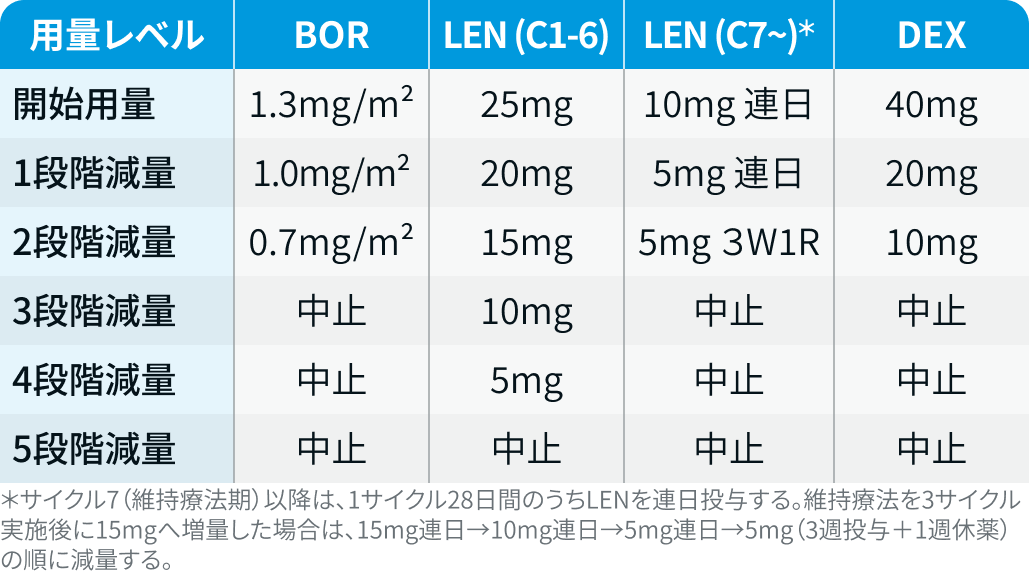
PERSEUS試験³⁾のプロトコルを基に編集部作成
腎障害患者に対する用量調整
レナリドミドの用量は腎機能に応じて以下のとおり調整する。

PERSEUS試験³⁾のプロトコルを基に編集部作成
有害事象発現時の減量・休薬・中止基準
ダラツムマブ

ダラキューロ®電子添文¹⁾、 PERSEUS試験³⁾のプロトコルを基に編集部作成
ボルテゾミブ、 レナリドミド、 デキサメタゾン
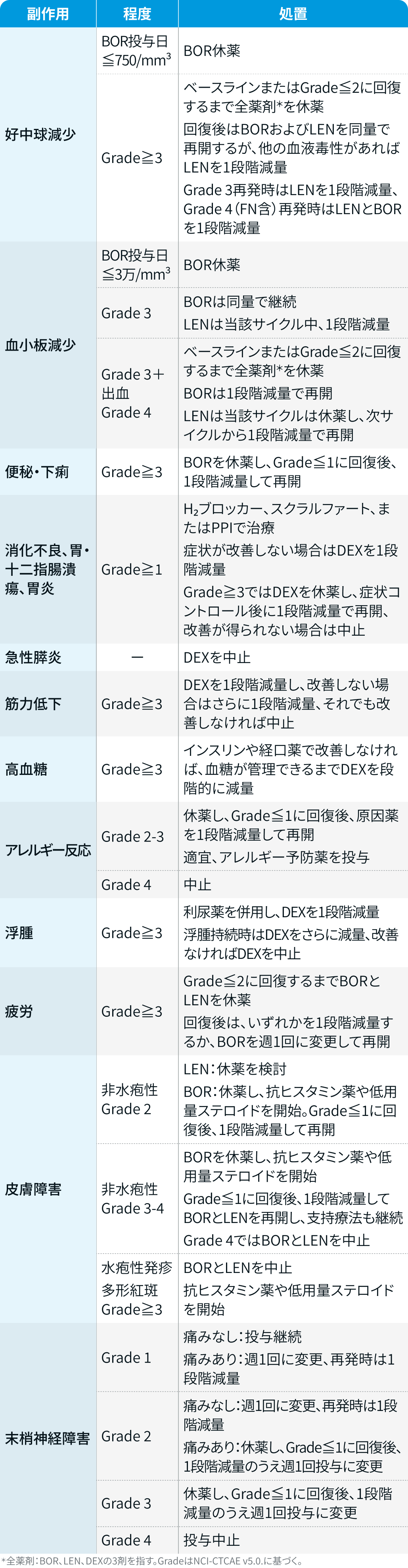
ダラキューロ®電子添文¹⁾、 PERSEUS試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
本レジメンの位置づけ
本レジメンは、 自家移植適応の未治療多発性骨髄腫に適用される。
🧑⚕️移植適応骨髄腫患者に対するD-BLd×4→自家移植→D-BLd×2→維持療法の有用性が示されました。 DARAとBORが皮下投与で点滴静注する薬剤が含まれないため利便性は高いです。 DEXの使い方と、 LEN維持療法が10mgを”連日”であることが従来のレジメンと異なるため、 慣れる必要があります。
東海大学医学部血液腫瘍内科 扇屋大輔先生
レジメン適用時の注意事項¹⁾
- ダラツムマブはヒトIgGκ型モノクローナル抗体であり、 IgGκ型骨髄腫においては血清中Mタンパクの測定に干渉し、 CRや再発の評価に影響を及ぼす可能性があるため注意が必要。
- ダラツムマブは赤血球上のCD38と結合し、 抗体スクリーニングや交差試験に干渉し、 間接クームス試験を偽陽性とする可能性がある。 影響は最終投与後約6ヵ月持続するため、 投与前に輸血前検査を行い、 輸血予定がある場合は関係者に周知すること。 干渉回避にはDTT処理が有効だが、 Kell抗原が変性するため、 当該抗体の評価が不能となる点に留意する。
- 腫瘍崩壊症候群の発現に備え、 血清電解質と腎機能を定期的に確認することが推奨される。
- 65歳以上では重篤な有害事象 (主に肺炎・敗血症) の発現頻度が高く、 未治療例では75歳以上で肺炎の発現が多く認められているため、 十分に注意する。
- COPDや喘息の既往がある患者ではInfusion Reactionのリスクが高いため、 気管支拡張薬や吸入ステロイドの投与を考慮する。
- 体重65kg以下では、 好中球減少など骨髄抑制のリスクが増加する可能性がある。
RMP【重要な特定されたリスク】
医薬品リスク管理計画書 (RMP)
ダラツムマブ :
- Infusion reaction
- 間接クームス試験への干渉
- 骨髄抑制
- 感染症
- 腫瘍崩壊症候群
ボルテゾミブ :
- 末梢神経障害
- 自律神経ニューロパチー
- 骨髄抑制
- 感染症
- 心障害
- 肺障害
- 腫瘍崩壊症候群
- 可逆性後白質脳症症候群
- 視神経症および視力障害
- 肝機能障害
- 低血圧
- イレウス
- 皮膚粘膜眼症候群、 中毒性表皮壊死症
- ギラン・バレー症候群・脱髄性多発ニューロパチー
レナリドミド :
- 催奇形性
- 骨髄抑制
- 出血
- 感染症
- 血栓塞栓症
- 過敏症 (皮膚反応を含む)
- 腫瘍崩壊症候群
- 末梢性ニューロパチー
- 虚血性心疾患
出典
1) ヤンセンファーマ株式会社. ダラキューロ®配合皮下注 電子添文 (2025年11月改訂 第8版)
2) ヤンセンファーマ株式会社. ダラキューロ配合皮下注 適正使用ガイド (2025年11月改訂)
3)N Engl J Med 2024;390:301-13.
最終更新 : 2025年11月25日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
D-BLd (D-VRd) 移植適応
DARA-sc:ダラツムマブ(ダラキューロ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,800mg/body 皮下注 | 1~2 | Day 1、8、15、22 |
| 1,800mg/body 皮下注 | 3~6 | Day 1、15 |
| 1,800mg/body 皮下注 | 7~ | Day 1 |
BOR:ボルテゾミブ(ベルケイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1.3mg/m² 皮下注 | 1~6 | Day 1、4、8、11 |
LEN:レナリドミド(レブラミド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 25mg/body 経口 | 1~6 | Day 1~21 |
| 10mg/body 経口 | 7~ | Day 1~28 |
| 15mg/body 経口 (忍容性がある場合のみ) | 10~ | Day 1~28 |
DEX:デキサメタゾン(デカドロン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg/body 経口 | 1~6 | Day 1-4、9-12 |
前投薬
| Infusion reaction軽減のため、 ダラツムマブ投与開始1~3時間前に副腎皮質ホルモン、 解熱鎮痛薬、 抗ヒスタミン薬を投与。 必要に応じて、 遅発性反応に備え投与後にも副腎皮質ホルモン等を投与。 初回投与時はモンテルカスト10mgの前投薬を推奨。 |
その他
| 1コースは4週間 |
| 寛解導入療法を4サイクル施行後、自家造血幹細胞移植を行い、地固め療法を2サイクル実施したのち、維持療法へ移行する。 |
| 維持療法期は、レナリドミドをPDまたは許容できない毒性が生じるまで継続。ダラツムマブはCR以上かつMRD陰性(感度10⁻⁵以下)が12ヵ月以上持続し、かつ維持療法を24ヵ月以上実施した場合に中止可。 |
概要
2025年6月25日、 造血幹細胞移植の適応となる未治療の多発性骨髄腫患者、 ならびに適応とならない未治療患者に対し、 ボルテゾミブ・レナリドミド・デキサメタゾンとの併用療法について、 新たに用法および用量が追加された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- ダラキューロ® (添付文書¹⁾ / 適正使用情報²⁾*)
*ヤンセンファーマ株式会社の外部サイトへ遷移します
- ベルケイド® (添付文書)
- レブラミド® (添付文書)
- レナデックス® (添付文書)
投与スケジュール
【1コース】28日間
【催吐性】 DARA: 最小度、 BOR/LEN: 軽度
【FN発症】低リスク**
**PERSEUS試験³⁾のFN発生率9.4%より編集部が分類
寛解導入療法を4サイクル施行後、 自家造血幹細胞移植を行い、 地固め療法を2サイクル実施したのち、 維持療法へ移行する。



ダラツムマブ : 1800mgをサイクル1・2では週1回、 サイクル3~6では2週に1回、 サイクル7以降では4週に1回皮下投与
インフュージョンリアクション軽減のため、 投与開始1~3時間前に副腎皮質ホルモン、 解熱鎮痛薬、 抗ヒスタミン薬を投与する。 必要に応じて、 遅発性反応に備え投与後にも副腎皮質ホルモン等を投与する¹⁾。 なお、 PERSEUS試験では初回投与時にモンテルカスト10mgの前投薬が推奨された。
ボルテゾミブ : 1.3 mg/m²をサイクル1~6の各サイクル1、 4、 8、 11日目に皮下投与
レナリドミド : 25mgをサイクル1~6の各サイクル1~21日目に経口投与。 サイクル7以降は10mgを連日経口投与し、 忍容性があれば3サイクル後に15mgへ増量可能
デキサメタゾン : 40mgをサイクル1~6の各サイクル1~4日目および9~12日目に経口投与
ダラツムマブ投与日は静脈内投与も選択可能
ダラツムマブは、 完全奏効 (CR) 以上を達成し、 MRD陰性 (感度10⁻⁵以下) の状態が12ヵ月以上持続し、 かつ維持療法を24ヵ月以上実施した場合に投与を中止する。 中止後、 CRの確定的消失 (免疫電気泳動または免疫固定法によるM蛋白の再出現、 または骨髄中の形質細胞が5%以上) またはMRDの再出現 (感度10⁻⁴以上) が認められた場合には、 ダラツムマブを再開する。
PERSEUS試験³⁾のプロトコルより引用
Key Data|臨床試験結果
📊 PERSEUS試験
新たに診断された自家造血幹細胞移植の適応となる多発性骨髄腫患者709例を対象とした多施設共同の第III相無作為化比較試験。 患者は皮下投与ダラツムマブ+ボルテゾミブ、 レナリドミド、 デキサメタゾン (D-VRd) 群355例と、 ボルテゾミブ、 レナリドミド、 デキサメタゾン (VRd) 単独群354例に1:1の比率で無作為に割り付けられ、 主要評価項目として無増悪生存期間 (PFS) が設定された。
【有効性】D-VRd群 (vs VRd群)
- PFS中央値 : 未到達 (vs 未到達)
- ハザード比 (HR) 0.42、 p<0.001
- 48ヵ月時点のPFS率 : 84.3% (vs 67.7%)
サブグループ解析 : ISS病期IIIの患者でHR 0.42 、 高リスクの細胞遺伝学的異常を持つ患者でHR 0.59
- CR+sCR率 : 87.9% (vs 70.1%、 p<0.001)
- MRD陰性率 (10⁻⁵閾値) : 75.2% (vs 47.5%)
【安全性】主な有害事象 : 全Grade (Grade 3/4)
- 好中球減少症 69.2% (62.1%)
- 血小板減少症 48.4% (29.1%)
- 貧血 22.2% (6.0%)
- 発熱性好中球減少症 9.7% (9.4%)
- 下痢 61.0% (10.5%)
- 末梢性感覚ニューロパチー 53.6% (4.3%)
- 便秘 33.9% (2.3%)
- 発熱 31.6% (2.3%)
- 不眠 27.1% (2.3%)
- 無力症 26.8% (3.4%)
- 咳嗽 24.2% (0.3%)
- 疲労 23.9% (2.8%)
- 皮疹 23.4% (2.6%)
- 背部痛 22.8% (0.6%)
- 末梢性浮腫 20.5% (1.1%)
- 悪心 20.2% (0.6%)
- 感染症全体 86.9% (35.3%)
- COVID-19 35.0% (3.4%)
- 上気道感染 31.6% (0.6%)
- 肺炎 18.2% (10.5%)
- 二次癌 10.5%
- Infusion reaction 6.0% (0.9%)
各プロトコル
適格基準
- 年齢 : 18歳~70歳
- ECOG PS : 0~2
- 好中球数 : ≧1,000/mm³
- 血小板数 : 骨髄の50%超が病変に関与している場合は ≧5万/mm³、 それ以外の場合は ≧7.5万/mm³
- ヘモグロビン : ≧7.5g/dL
- 腎機能 : CrCl ≧30mL/min
- 肝機能 : AST、 ALT ≦2.5× ULN、 総ビリルビン ≦1.5× ULN
用量レベル
ダラツムマブの減量は行わない。 ボルテゾミブ、 レナリドミド、 デキサメタゾンの用量レベルは以下のとおり。

PERSEUS試験³⁾のプロトコルを基に編集部作成
腎障害患者に対する用量調整
レナリドミドの用量は腎機能に応じて以下のとおり調整する。

PERSEUS試験³⁾のプロトコルを基に編集部作成
有害事象発現時の減量・休薬・中止基準
ダラツムマブ

ダラキューロ®電子添文¹⁾、 PERSEUS試験³⁾のプロトコルを基に編集部作成
ボルテゾミブ、 レナリドミド、 デキサメタゾン

ダラキューロ®電子添文¹⁾、 PERSEUS試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
本レジメンの位置づけ
本レジメンは、 自家移植適応の未治療多発性骨髄腫に適用される。
🧑⚕️移植適応骨髄腫患者に対するD-BLd×4→自家移植→D-BLd×2→維持療法の有用性が示されました。 DARAとBORが皮下投与で点滴静注する薬剤が含まれないため利便性は高いです。 DEXの使い方と、 LEN維持療法が10mgを”連日”であることが従来のレジメンと異なるため、 慣れる必要があります。
東海大学医学部血液腫瘍内科 扇屋大輔先生
レジメン適用時の注意事項¹⁾
- ダラツムマブはヒトIgGκ型モノクローナル抗体であり、 IgGκ型骨髄腫においては血清中Mタンパクの測定に干渉し、 CRや再発の評価に影響を及ぼす可能性があるため注意が必要。
- ダラツムマブは赤血球上のCD38と結合し、 抗体スクリーニングや交差試験に干渉し、 間接クームス試験を偽陽性とする可能性がある。 影響は最終投与後約6ヵ月持続するため、 投与前に輸血前検査を行い、 輸血予定がある場合は関係者に周知すること。 干渉回避にはDTT処理が有効だが、 Kell抗原が変性するため、 当該抗体の評価が不能となる点に留意する。
- 腫瘍崩壊症候群の発現に備え、 血清電解質と腎機能を定期的に確認することが推奨される。
- 65歳以上では重篤な有害事象 (主に肺炎・敗血症) の発現頻度が高く、 未治療例では75歳以上で肺炎の発現が多く認められているため、 十分に注意する。
- COPDや喘息の既往がある患者ではInfusion Reactionのリスクが高いため、 気管支拡張薬や吸入ステロイドの投与を考慮する。
- 体重65kg以下では、 好中球減少など骨髄抑制のリスクが増加する可能性がある。
RMP【重要な特定されたリスク】
医薬品リスク管理計画書 (RMP)
ダラツムマブ :
- Infusion reaction
- 間接クームス試験への干渉
- 骨髄抑制
- 感染症
- 腫瘍崩壊症候群
ボルテゾミブ :
- 末梢神経障害
- 自律神経ニューロパチー
- 骨髄抑制
- 感染症
- 心障害
- 肺障害
- 腫瘍崩壊症候群
- 可逆性後白質脳症症候群
- 視神経症および視力障害
- 肝機能障害
- 低血圧
- イレウス
- 皮膚粘膜眼症候群、 中毒性表皮壊死症
- ギラン・バレー症候群・脱髄性多発ニューロパチー
レナリドミド :
- 催奇形性
- 骨髄抑制
- 出血
- 感染症
- 血栓塞栓症
- 過敏症 (皮膚反応を含む)
- 腫瘍崩壊症候群
- 末梢性ニューロパチー
- 虚血性心疾患
出典
1) ヤンセンファーマ株式会社. ダラキューロ®配合皮下注 電子添文 (2025年11月改訂 第8版)
2) ヤンセンファーマ株式会社. ダラキューロ配合皮下注 適正使用ガイド (2025年11月改訂)
3)N Engl J Med 2024;390:301-13.
最終更新 : 2025年11月25日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。







