Mosunetuzumab
モスネツズマブ(ルンスミオ®)
治療スケジュール
概要
監修医師
Mosunetuzumab:モスネツズマブ(ルンスミオ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1mg | 1 | Day 1 |
| 2mg | 1 | Day 8 |
| 60mg | 1 | Day 15 |
| 60mg | 2 | Day 1 |
| 30mg | 3~ | Day 1 |
前投薬
| 投与の1~2日前から十分な水分補給 (1コース目は必須、 以降任意). |
| 投与の1時間前に副腎皮質ステロイド剤を投与 (1~2コース目は必須、 以降任意). |
| 投与の0.5~1時間前に解熱鎮痛剤及び抗ヒスタミン剤を投与 (任意). |
その他
| CRSは投与初期に多く認められることから、 1コース目の各投与後には入院管理を検討. |
| 初回の60mg投与開始後48時間は、 必ず入院管理. |
Mosunetuzumabの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
「再発または難治性の濾胞性リンパ腫」 に対して、 2024年12月27日に正式承認され、 2025年3月19日に薬価収載・同日発売された (1mg/1mL・1瓶 : 8万1,434円、 30mg/30mL・1瓶 : 2,32万7,790円)。
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
抗CD20/CD3ヒト化二重特異性抗体 モスネツズマブ
*中外製薬株式会社の外部サイトへ遷移します
主な有害事象
FLMOON-1試験より引用
骨髄抑制
- リンパ球数減少 (68.4%)
- 好中球数減少 (26.3%)
- 白血球数減少 (15.8%)
- 血小板数減少 (10.5%)
主な有害事象
- サイトカイン放出症候群 (CRS) (47.4%)
- AST増加 (31.6%)
- ALT増加 (31.6%)
- 発疹 (26.3%)
- 便秘 (21.1%)
- そう痒症 (21.1%)
- 注入に伴う反応 (21.1%)
- 高血糖 (21.1%)
- 悪心 (15.8%)
- 帯状疱疹 (15.8%)
- 血中ビリルビン増加 (15.8%)
- 多形紅斑 (15.8%)
その他重大な有害事象
- 神経毒性 (ICANS) (5.3%)
GO29781試験より引用
骨髄抑制
- 好中球減少症 (20.0%)
主な有害事象
- CRS (45.6%)
- 疲労 (36.7%)
- 頭痛 (31.1%)
- 発熱 (28.9%)
- 低リン血症 (26.7%)
- そう痒感 (21.1%)
- 低カリウム血症 (18.9%)
- 便秘 (17.8%)
- 咳嗽 (17.8%)
- 下痢 (16.7%)
- 悪心 (16.7%)
- 発疹 (15.6%)
- 皮膚乾燥 (15.6%)
その他重大な有害事象
- 急性腎障害 (3.3%)
- 腫瘍フレア (2.2%)
特徴と注意点
特徴
- モスネツズマブはCD3及びCD20に対する二重特異性モノクローナル抗体.
- T細胞に発現するCD3とB細胞腫瘍に発現するCD20に結合し、 T細胞を活性化させることでCD20陽性の腫瘍細胞を傷害する.
適応
- 再発又は難治性の濾胞性リンパ腫.
- 抗CD20モノクローナル抗体製剤を含む少なくとも2つの標準的な治療が無効または治療後に再発した患者が対象.
- 十分な経験を有する病理医によりGrade1~3Aと診断された患者に投与.
投与スケジュール

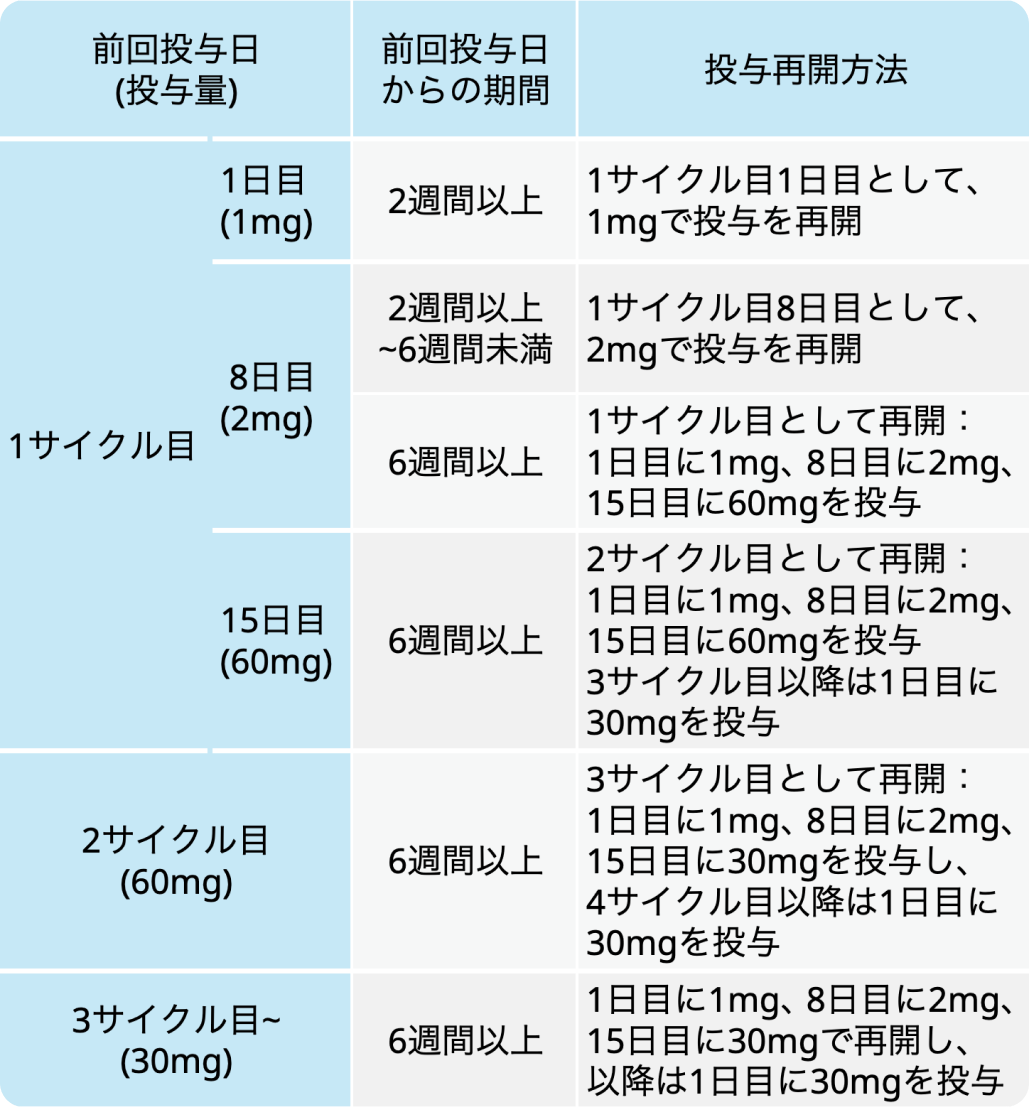
投与延期後の再開時の投与方法
投与延期後の再開時の投与方法はCRSを予防するため以下の通り。
副作用と対策
- 腫瘍崩壊症候群を予防するため投与前に水分摂取を十分に行う.
- サイトカイン放出症候群 (CRS)があらわれることがあるので、 1~2コース目は投与の60分前に副腎皮質ホルモン剤を投与.
- 3コース目以降は前回投与後にCRSがあらわれた患者には、 CRSがあらわれなくなるまで副腎皮質ステロイド剤を前投与.
- コースによらず必要に応じて解熱鎮痛剤や抗ヒスタミン剤を前投与.
- 1コース目は4時間以上かけて投与.
- 2コース目以降の投与速度は2時間まで短縮可.
- 以下の副作用が発現した場合には適正使用ガイドを参照に投与の中断等を考慮.
1.CRS 2.免疫エフェクター細胞関連神経毒性症候群 (ICANS) 3.好中球減少 4.血小板減少
- 緊急時に備えてトシリズマブを速やかに使用できるように準備しておく.
- インラインフィルターを使用しない.
関連する臨床試験の結果
FLMOON-1試験 (JO40295試験)
- 過去に2レジメン以上の全身療法を受けたことがある再発又は難治性のFL患者19例を対象としてルンスミオ®単剤療法の有効性及び安全性を検討した国内第Ⅰ相臨床試験.
- 結果 : CRRは68.4% (90%CI : 47.0-85.3)
GO29781試験
- 過去に2レジメン以上の全身療法を受けたことがある再発又は難治性のFL患者90例を対象としてルンスミオ単剤療法の有効性及び安全性を検討した海外第I/II相臨床試験.
- 結果 : 中間解析時のCRRは57.8% (95%CI : 46.9-68.1)
- 追加解析時のCRRは60.0% ( 95%CI : 49.1-70.2)
出典
最終更新:2025年8月1日
執筆担当 : 小澤病院薬剤部 長剛広
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Mosunetuzumabの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
Mosunetuzumab
モスネツズマブ(ルンスミオ®)
2025年08月01日更新
Mosunetuzumab:モスネツズマブ(ルンスミオ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1mg | 1 | Day 1 |
| 2mg | 1 | Day 8 |
| 60mg | 1 | Day 15 |
| 60mg | 2 | Day 1 |
| 30mg | 3~ | Day 1 |
前投薬
| 投与の1~2日前から十分な水分補給 (1コース目は必須、 以降任意). |
| 投与の1時間前に副腎皮質ステロイド剤を投与 (1~2コース目は必須、 以降任意). |
| 投与の0.5~1時間前に解熱鎮痛剤及び抗ヒスタミン剤を投与 (任意). |
その他
| CRSは投与初期に多く認められることから、 1コース目の各投与後には入院管理を検討. |
| 初回の60mg投与開始後48時間は、 必ず入院管理. |
概要
「再発または難治性の濾胞性リンパ腫」 に対して、 2024年12月27日に正式承認され、 2025年3月19日に薬価収載・同日発売された (1mg/1mL・1瓶 : 8万1,434円、 30mg/30mL・1瓶 : 2,32万7,790円)。
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
抗CD20/CD3ヒト化二重特異性抗体 モスネツズマブ
*中外製薬株式会社の外部サイトへ遷移します
主な有害事象
FLMOON-1試験より引用
骨髄抑制
- リンパ球数減少 (68.4%)
- 好中球数減少 (26.3%)
- 白血球数減少 (15.8%)
- 血小板数減少 (10.5%)
主な有害事象
- サイトカイン放出症候群 (CRS) (47.4%)
- AST増加 (31.6%)
- ALT増加 (31.6%)
- 発疹 (26.3%)
- 便秘 (21.1%)
- そう痒症 (21.1%)
- 注入に伴う反応 (21.1%)
- 高血糖 (21.1%)
- 悪心 (15.8%)
- 帯状疱疹 (15.8%)
- 血中ビリルビン増加 (15.8%)
- 多形紅斑 (15.8%)
その他重大な有害事象
- 神経毒性 (ICANS) (5.3%)
GO29781試験より引用
骨髄抑制
- 好中球減少症 (20.0%)
主な有害事象
- CRS (45.6%)
- 疲労 (36.7%)
- 頭痛 (31.1%)
- 発熱 (28.9%)
- 低リン血症 (26.7%)
- そう痒感 (21.1%)
- 低カリウム血症 (18.9%)
- 便秘 (17.8%)
- 咳嗽 (17.8%)
- 下痢 (16.7%)
- 悪心 (16.7%)
- 発疹 (15.6%)
- 皮膚乾燥 (15.6%)
その他重大な有害事象
- 急性腎障害 (3.3%)
- 腫瘍フレア (2.2%)
特徴と注意点
特徴
- モスネツズマブはCD3及びCD20に対する二重特異性モノクローナル抗体.
- T細胞に発現するCD3とB細胞腫瘍に発現するCD20に結合し、 T細胞を活性化させることでCD20陽性の腫瘍細胞を傷害する.
適応
- 再発又は難治性の濾胞性リンパ腫.
- 抗CD20モノクローナル抗体製剤を含む少なくとも2つの標準的な治療が無効または治療後に再発した患者が対象.
- 十分な経験を有する病理医によりGrade1~3Aと診断された患者に投与.
投与スケジュール

投与延期後の再開時の投与方法
投与延期後の再開時の投与方法はCRSを予防するため以下の通り。

副作用と対策
- 腫瘍崩壊症候群を予防するため投与前に水分摂取を十分に行う.
- サイトカイン放出症候群 (CRS)があらわれることがあるので、 1~2コース目は投与の60分前に副腎皮質ホルモン剤を投与.
- 3コース目以降は前回投与後にCRSがあらわれた患者には、 CRSがあらわれなくなるまで副腎皮質ステロイド剤を前投与.
- コースによらず必要に応じて解熱鎮痛剤や抗ヒスタミン剤を前投与.
- 1コース目は4時間以上かけて投与.
- 2コース目以降の投与速度は2時間まで短縮可.
- 以下の副作用が発現した場合には適正使用ガイドを参照に投与の中断等を考慮.
1.CRS 2.免疫エフェクター細胞関連神経毒性症候群 (ICANS) 3.好中球減少 4.血小板減少
- 緊急時に備えてトシリズマブを速やかに使用できるように準備しておく.
- インラインフィルターを使用しない.
関連する臨床試験の結果
FLMOON-1試験 (JO40295試験)
- 過去に2レジメン以上の全身療法を受けたことがある再発又は難治性のFL患者19例を対象としてルンスミオ®単剤療法の有効性及び安全性を検討した国内第Ⅰ相臨床試験.
- 結果 : CRRは68.4% (90%CI : 47.0-85.3)
GO29781試験
- 過去に2レジメン以上の全身療法を受けたことがある再発又は難治性のFL患者90例を対象としてルンスミオ単剤療法の有効性及び安全性を検討した海外第I/II相臨床試験.
- 結果 : 中間解析時のCRRは57.8% (95%CI : 46.9-68.1)
- 追加解析時のCRRは60.0% ( 95%CI : 49.1-70.2)
出典
最終更新:2025年8月1日
執筆担当 : 小澤病院薬剤部 長剛広
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Mosunetuzumabの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。





