BelaPd
ベランタマブ マホドチン+ポマリドミド+デキサメタゾン
Bela:ベランタマブ マホドチン(ブーレンレップ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2.5mg/kg (1.9mg/kg) 静脈内投与 | 1~ | Day 1 |
POM:ポマリドミド(ポマリスト®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 4mg 経口投与 | 1~ | Day 1~21 |
DEX:デキサメタゾン(レナデックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg 経口投与 | 1~ | Day 1, 8, 15, 22 |
前投薬
その他
| Belaは初回2.5mg/kg、2回目以降は1.9mg/kgで投与。 |
| DEXは、75歳超、高リスク併存疾患、または40mgに忍容性がない場合に20mg/日で開始可能。 |
| 治療開始前に眼科医の診察を行う。初回から4回目までの各投与前は必ず、以降は必要に応じて、視力検査・細隙灯顕微鏡検査を含む眼科検査を実施し、患者の状態を十分に観察する。 |
ブーレンレップ® : 2024年9月17日、 「再発又は難治性の多発性骨髄腫」 を対象として承認申請、 2025年5月19日に正式承認
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*グラクソ・スミスクライン株式会社の外部サイトへ遷移します
- ポマリスト® (添付文書)
- レナデックス® (添付文書)
投与スケジュール
【1コース】28日間
【催吐性】未分類*
【FN発症】未報告**
*NCCN Guidelines Version 2.2025 Antiemesis未記載 (ボルテゾミブは最小度催吐性リスクに分類)
**DREAMM-8試験で未報告

ベランタマブ マホドチン : 初回2.5mg/kg、 以降1.9mg/kgを4週間隔で30分以上かけ点滴静注
ポマリドミド : 1~21日目に4mg/日を経口投与
デキサメタゾン : 40mgを週1回経口投与
75歳超、 高リスク患者、 または忍容性が低い場合は20mgに減量
Key Data|臨床試験結果
📊 DREAMM-8試験
レナリドミドを含む1レジメン以上の前治療歴を有する再発又は難治性の多発性骨髄腫患者302例を対象とした無作為化非盲検国際共同第III相比較試験。 ベランタマブ マホドチン、 ポマリドミド、 デキサメタゾン併用療法 (BPd群) とポマリドミド、 ボルテゾミブ、 デキサメタゾン併用療法 (PVd群) に1:1の比率で無作為に割り付け、 主要評価項目として無増悪生存期間 (PFS) が設定された。
【有効性】 BPd群 (vs PVd群)
- PFS
- 25パーセンタイル値 : 10.3ヵ月 (vs 5.5ヵ月)
- ハザード比 : 0.52、 p<0.001
- 12ヵ月PFS率 : 71% (vs 51%)
- CR+sCR率 : 40% (vs 16%)
- MRD陰性化率 : 24% (vs 5%)
- OS
- 25パーセンタイル値 : 19ヵ月 (vs 12.7ヵ月)
- ハザード比 : 0.77
- 12ヵ月OS率 : 83% (vs 76%)
【安全性】主な有害事象 : 全Grade (≧Grade3)
- 霧視 79% (17%)
- ドライアイ 61% (8%)
- 眼異物感 61% (6%)
- 眼刺激 50% (4%)
- 好中球減少症 48% (42%)
- 羞明 44% (3%)
- COVID-19 37% (7%)
- 血小板減少症 36% (24%)
- 眼痛 33% (2%)
- 白内障 27% (6%)
- 倦怠感 27% (6%)
- 上気道感染 27% (1%)
- 肺炎 24% (17%)
- 貧血 23% (10%)
- 下痢 23% (1%)
- 角膜上皮微小嚢胞 23% (8%)
- 点状角膜炎 23% (6%)
- 視力低下 23% (13%)
- 好中球数減少 21% (21%)
- 血小板数減少 20% (15%)
- 便秘 15% (1%)
- 末梢神経障害 7% (1%)
各プロトコル
適格基準
DREAMM-8試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–2
- 前治療歴が少なくとも1レジメン以上あり、 レナリドミドを含む治療を受けていること
- ECOG PS 0–2
- 好中球数 ≧1,500/mm³
- ヘモグロビン ≧8.0g/dL
- 血小板数 >7.5万/mm³
- 腎機能 : eGFR ≧30 mL/min/1.73 m²
- 肝機能 : 総ビリルビン ≦1.5 x ULN、 ALT ≦2.5 x ULN
用量レベル
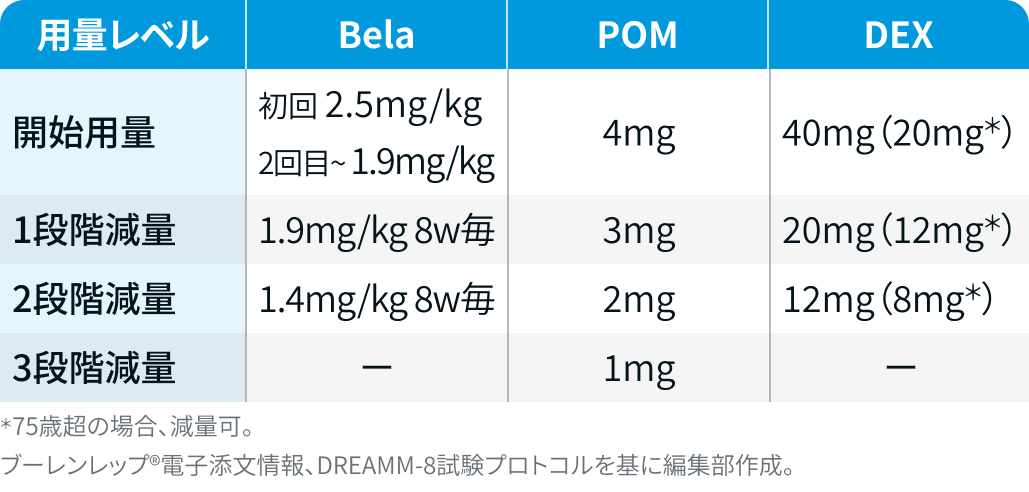
減量・休薬・中止基準
ベランタマブ マホドチン
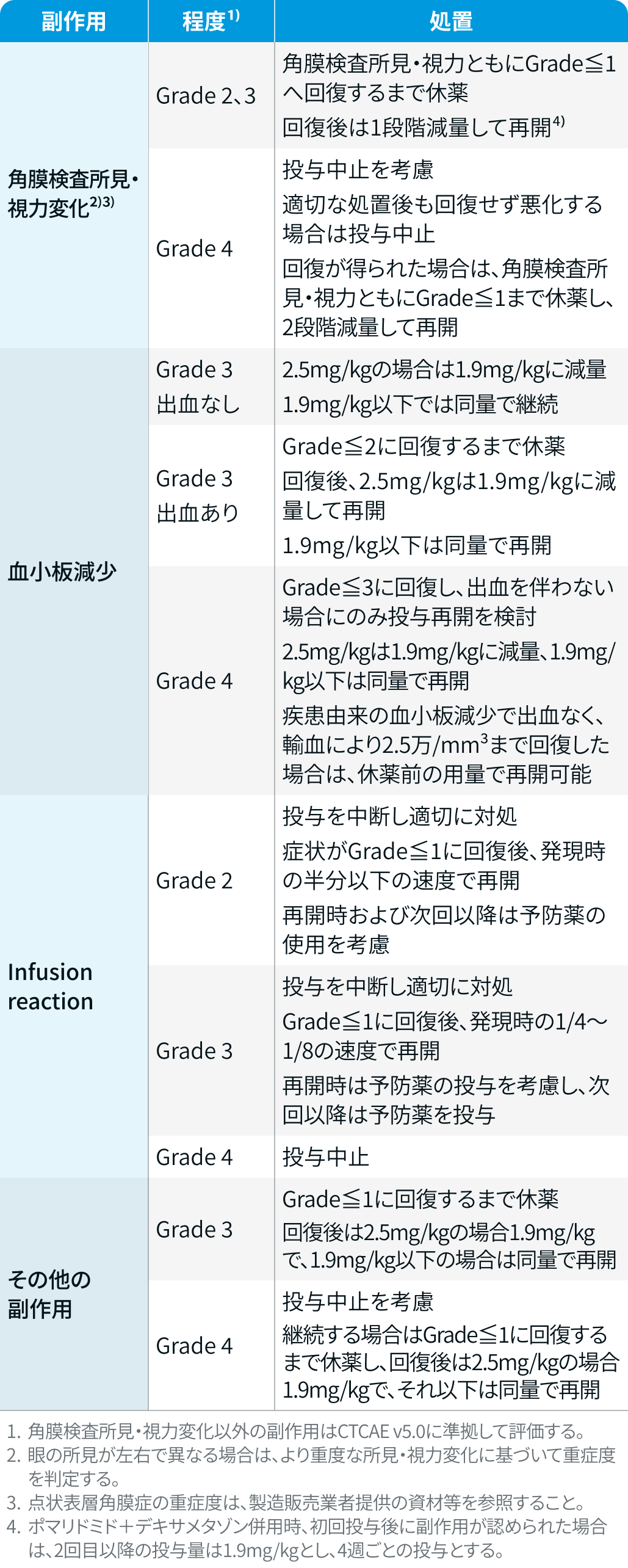
ブーレンレップ®電子添文¹⁾を基に編集部作成
ポマリドミド
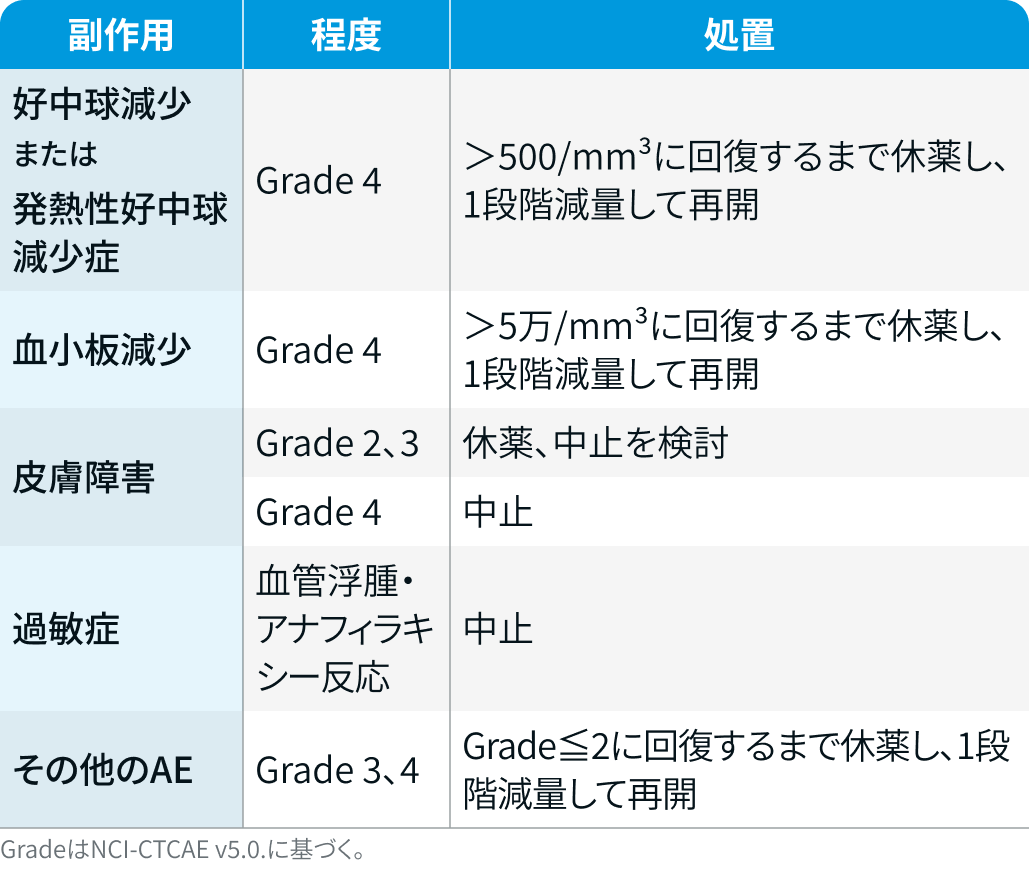
DREAMM-8試験³⁾のプロトコルを基に編集部作成
デキサメタゾン
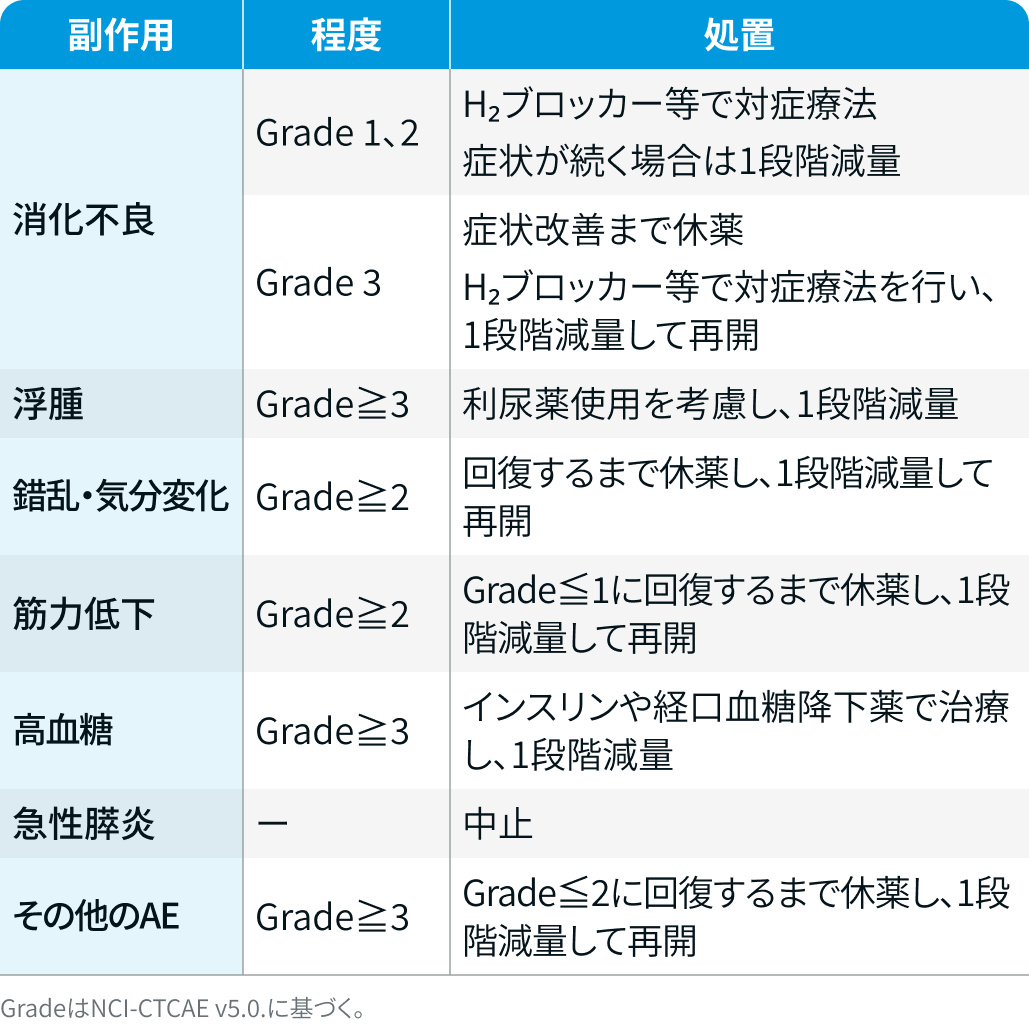
DREAMM-8試験³⁾のプロトコルを基に編集部作成
眼障害のマネジメント
眼科医師との連携
視力低下を含む眼障害が高頻度にみられることから、 ベランタマブマホドチンの投与に際しては眼科医との連携が不可欠である。 眼科検査の結果は、 休薬や減量の判断に不可欠な情報であるため、 速やかに共有する必要がある。
『ブーレンレップ手帳』や『眼科検査結果記入用紙』を活用し、 検査結果の共有を徹底する。
眼科検査の頻度
初回~4回目までは各投与前に、 以降は必要に応じて視力検査・細隙灯顕微鏡検査を含む眼科的評価を行い、 状態を十分に観察する。
眼障害の評価方法
眼障害の評価は、 角膜検査所見および最高矯正視力の変化に基づいて重症度を判定する。 詳細は『眼科医向けブーレンレップ眼障害マネジメントガイド』を参照。
角膜検査所見の重症度 (KVAスケール) : 軽度の点状表層角膜症 (Grade 1) から角膜上皮欠損 (Grade 4) までの所見に基づき評価される。
最高矯正視力の変化による重症度 (KVAスケール) : ベースラインの最高矯正視力からの低下の程度により、 Grade 1~4に分類される。
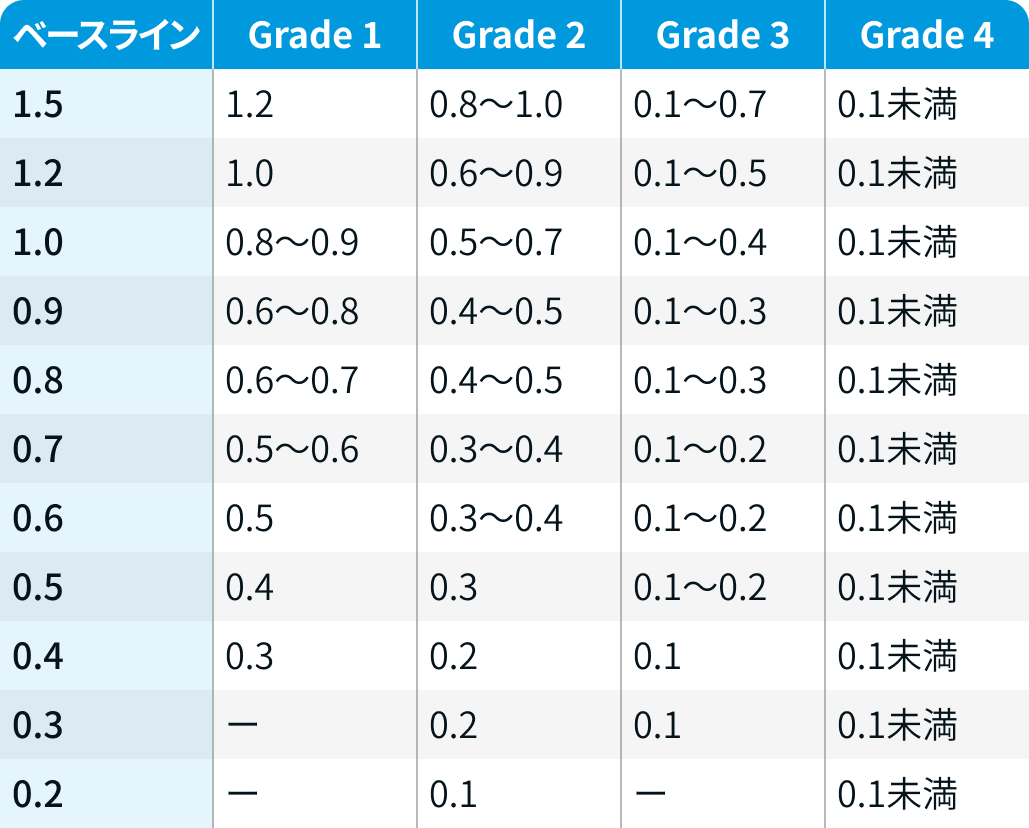
マネジメント
- 眼障害の重症度に応じて、 適切に休薬や減量を行う
- ドライアイなどの眼症状軽減のため、 防腐剤無添加の人工涙液を1日4回以上点眼する
点眼薬の例 : ヒアルロン酸ナトリウムPF点眼液0.1%/0.3% 「日点」、 ヒアレインミニ点眼液0.1%/0.3%、 ソフトサンティアなど
- 治療中はコンタクトレンズの装着を避ける
- 霧視など視力低下を伴う眼障害が高頻度に発現するため、 自動車運転や機械操作時は注意が必要
レジメンの特徴と注意点
作用機序の特徴
ベランタマブ マホドチンは、 BCMAに対するヒト化IgG1抗体に、 微小管重合阻害薬MMAFをペプチドリンカーで結合させた抗体薬物複合体である。 BCMA陽性腫瘍細胞に結合・取り込まれ、 MMAF複合体がアポトーシスを誘導することで抗腫瘍効果を発揮する。 また、 本剤は低フコース化抗体によりADCC・ADCP活性を高め、 Fcγ受容体への結合親和性が強化されている。
レジメン適用時の注意事項
- ボルテゾミブおよびデキサメタゾンとの併用療法 (BelaVd) とは用法・用量が異なるため注意する
- 感染症 (特に日和見感染症) の発現や悪化があり得るため、 投与前にニューモシスチス・イロベチイなどの感染有無を確認する
RMP【重要な特定されたリスク】
ブーレンレップ®医薬品リスク管理計画書 (RMP)
- 眼障害
- 血球減少
- 感染症
出典
- グラクソ・スミスクライン株式会社. ブーレンレップ点滴静注用100mg 電子添文 2025年5月 (第1版) [最終確認: 2025/6/4]
- グラクソ・スミスクライン株式会社. ブーレンレップ点滴静注用100mg 適正使用ガイド [最終確認: 2025/6/4]
- N Engl J Med. 2024;391(5):408-421.
最終更新 : 2025年5月29日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
BelaPd
Bela:ベランタマブ マホドチン(ブーレンレップ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2.5mg/kg (1.9mg/kg) 静脈内投与 | 1~ | Day 1 |
POM:ポマリドミド(ポマリスト®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 4mg 経口投与 | 1~ | Day 1~21 |
DEX:デキサメタゾン(レナデックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg 経口投与 | 1~ | Day 1, 8, 15, 22 |
前投薬
その他
| Belaは初回2.5mg/kg、2回目以降は1.9mg/kgで投与。 |
| DEXは、75歳超、高リスク併存疾患、または40mgに忍容性がない場合に20mg/日で開始可能。 |
| 治療開始前に眼科医の診察を行う。初回から4回目までの各投与前は必ず、以降は必要に応じて、視力検査・細隙灯顕微鏡検査を含む眼科検査を実施し、患者の状態を十分に観察する。 |
概要
ブーレンレップ® : 2024年9月17日、 「再発又は難治性の多発性骨髄腫」 を対象として承認申請、 2025年5月19日に正式承認
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*グラクソ・スミスクライン株式会社の外部サイトへ遷移します
- ポマリスト® (添付文書)
- レナデックス® (添付文書)
投与スケジュール
【1コース】28日間
【催吐性】未分類*
【FN発症】未報告**
*NCCN Guidelines Version 2.2025 Antiemesis未記載 (ボルテゾミブは最小度催吐性リスクに分類)
**DREAMM-8試験で未報告

ベランタマブ マホドチン : 初回2.5mg/kg、 以降1.9mg/kgを4週間隔で30分以上かけ点滴静注
ポマリドミド : 1~21日目に4mg/日を経口投与
デキサメタゾン : 40mgを週1回経口投与
75歳超、 高リスク患者、 または忍容性が低い場合は20mgに減量
Key Data|臨床試験結果
📊 DREAMM-8試験
レナリドミドを含む1レジメン以上の前治療歴を有する再発又は難治性の多発性骨髄腫患者302例を対象とした無作為化非盲検国際共同第III相比較試験。 ベランタマブ マホドチン、 ポマリドミド、 デキサメタゾン併用療法 (BPd群) とポマリドミド、 ボルテゾミブ、 デキサメタゾン併用療法 (PVd群) に1:1の比率で無作為に割り付け、 主要評価項目として無増悪生存期間 (PFS) が設定された。
【有効性】 BPd群 (vs PVd群)
- PFS
- 25パーセンタイル値 : 10.3ヵ月 (vs 5.5ヵ月)
- ハザード比 : 0.52、 p<0.001
- 12ヵ月PFS率 : 71% (vs 51%)
- CR+sCR率 : 40% (vs 16%)
- MRD陰性化率 : 24% (vs 5%)
- OS
- 25パーセンタイル値 : 19ヵ月 (vs 12.7ヵ月)
- ハザード比 : 0.77
- 12ヵ月OS率 : 83% (vs 76%)
【安全性】主な有害事象 : 全Grade (≧Grade3)
- 霧視 79% (17%)
- ドライアイ 61% (8%)
- 眼異物感 61% (6%)
- 眼刺激 50% (4%)
- 好中球減少症 48% (42%)
- 羞明 44% (3%)
- COVID-19 37% (7%)
- 血小板減少症 36% (24%)
- 眼痛 33% (2%)
- 白内障 27% (6%)
- 倦怠感 27% (6%)
- 上気道感染 27% (1%)
- 肺炎 24% (17%)
- 貧血 23% (10%)
- 下痢 23% (1%)
- 角膜上皮微小嚢胞 23% (8%)
- 点状角膜炎 23% (6%)
- 視力低下 23% (13%)
- 好中球数減少 21% (21%)
- 血小板数減少 20% (15%)
- 便秘 15% (1%)
- 末梢神経障害 7% (1%)
各プロトコル
適格基準
DREAMM-8試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–2
- 前治療歴が少なくとも1レジメン以上あり、 レナリドミドを含む治療を受けていること
- ECOG PS 0–2
- 好中球数 ≧1,500/mm³
- ヘモグロビン ≧8.0g/dL
- 血小板数 >7.5万/mm³
- 腎機能 : eGFR ≧30 mL/min/1.73 m²
- 肝機能 : 総ビリルビン ≦1.5 x ULN、 ALT ≦2.5 x ULN
用量レベル

減量・休薬・中止基準
ベランタマブ マホドチン

ブーレンレップ®電子添文¹⁾を基に編集部作成
ポマリドミド

DREAMM-8試験³⁾のプロトコルを基に編集部作成
デキサメタゾン

DREAMM-8試験³⁾のプロトコルを基に編集部作成
眼障害のマネジメント
眼科医師との連携
視力低下を含む眼障害が高頻度にみられることから、 ベランタマブマホドチンの投与に際しては眼科医との連携が不可欠である。 眼科検査の結果は、 休薬や減量の判断に不可欠な情報であるため、 速やかに共有する必要がある。
『ブーレンレップ手帳』や『眼科検査結果記入用紙』を活用し、 検査結果の共有を徹底する。
眼科検査の頻度
初回~4回目までは各投与前に、 以降は必要に応じて視力検査・細隙灯顕微鏡検査を含む眼科的評価を行い、 状態を十分に観察する。
眼障害の評価方法
眼障害の評価は、 角膜検査所見および最高矯正視力の変化に基づいて重症度を判定する。 詳細は『眼科医向けブーレンレップ眼障害マネジメントガイド』を参照。
角膜検査所見の重症度 (KVAスケール) : 軽度の点状表層角膜症 (Grade 1) から角膜上皮欠損 (Grade 4) までの所見に基づき評価される。
最高矯正視力の変化による重症度 (KVAスケール) : ベースラインの最高矯正視力からの低下の程度により、 Grade 1~4に分類される。

マネジメント
- 眼障害の重症度に応じて、 適切に休薬や減量を行う
- ドライアイなどの眼症状軽減のため、 防腐剤無添加の人工涙液を1日4回以上点眼する
点眼薬の例 : ヒアルロン酸ナトリウムPF点眼液0.1%/0.3% 「日点」、 ヒアレインミニ点眼液0.1%/0.3%、 ソフトサンティアなど
- 治療中はコンタクトレンズの装着を避ける
- 霧視など視力低下を伴う眼障害が高頻度に発現するため、 自動車運転や機械操作時は注意が必要
レジメンの特徴と注意点
作用機序の特徴
ベランタマブ マホドチンは、 BCMAに対するヒト化IgG1抗体に、 微小管重合阻害薬MMAFをペプチドリンカーで結合させた抗体薬物複合体である。 BCMA陽性腫瘍細胞に結合・取り込まれ、 MMAF複合体がアポトーシスを誘導することで抗腫瘍効果を発揮する。 また、 本剤は低フコース化抗体によりADCC・ADCP活性を高め、 Fcγ受容体への結合親和性が強化されている。
レジメン適用時の注意事項
- ボルテゾミブおよびデキサメタゾンとの併用療法 (BelaVd) とは用法・用量が異なるため注意する
- 感染症 (特に日和見感染症) の発現や悪化があり得るため、 投与前にニューモシスチス・イロベチイなどの感染有無を確認する
RMP【重要な特定されたリスク】
ブーレンレップ®医薬品リスク管理計画書 (RMP)
- 眼障害
- 血球減少
- 感染症
出典
- グラクソ・スミスクライン株式会社. ブーレンレップ点滴静注用100mg 電子添文 2025年5月 (第1版) [最終確認: 2025/6/4]
- グラクソ・スミスクライン株式会社. ブーレンレップ点滴静注用100mg 適正使用ガイド [最終確認: 2025/6/4]
- N Engl J Med. 2024;391(5):408-421.
最終更新 : 2025年5月29日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。





