mFOLFIRINOX
レボホリナート + フルオロウラシル + イリノテカン + オキサリプラチン
L-OHP:オキサリプラチン(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
l-LV:レボホリナートカルシウム(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
CPT-11:イリノテカン塩酸塩水和物(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150mg/m² 点滴 | 1~ | Day1 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
前投薬
その他
| 1コース14日間。 |
| L-OHP+l-LV+CPT-11+5−FUでFOLFIRINOX療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- エルプラット® (添付文書)
- アイソボリン® (添付文書)
- トポテシン® (添付文書)
- フルオロウラシル® (添付文書)
投与スケジュール
1コース 2週間

各プロトコル
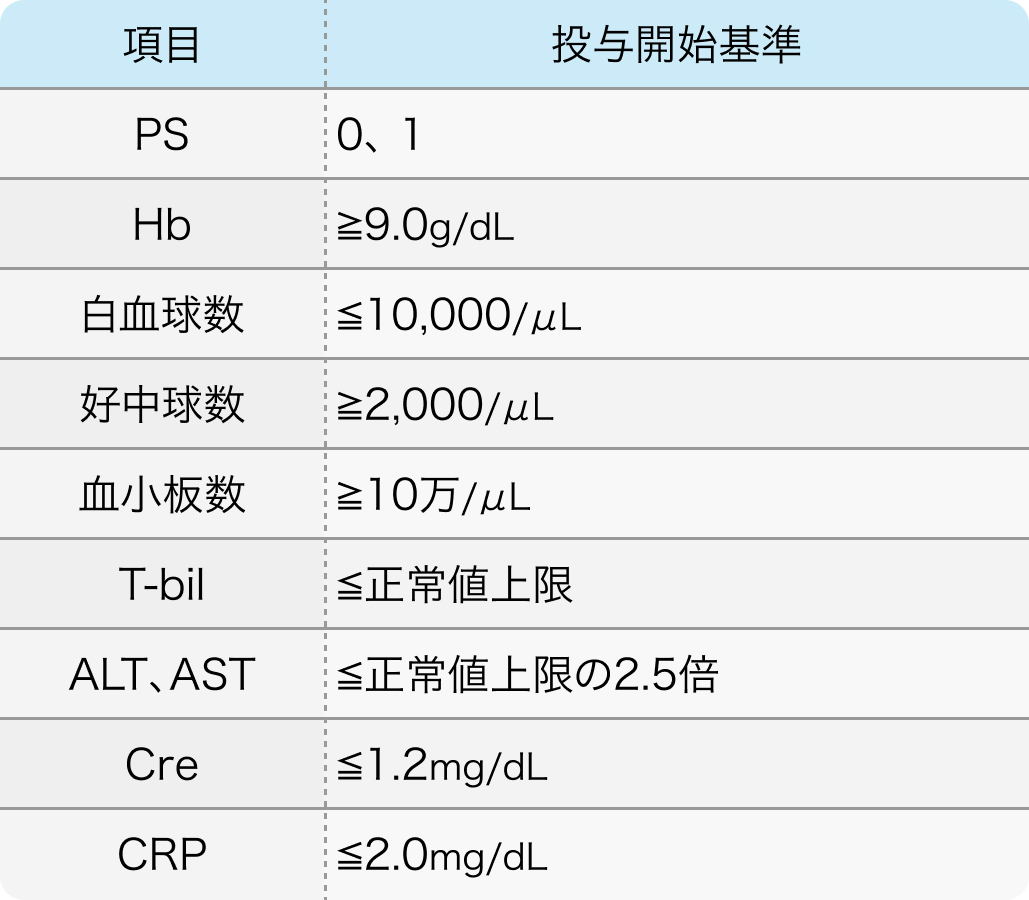
適格基準例
Cancer Chemother Pharmacol. 2018 Jun;81(6):1017-1023¹⁾より抜粋
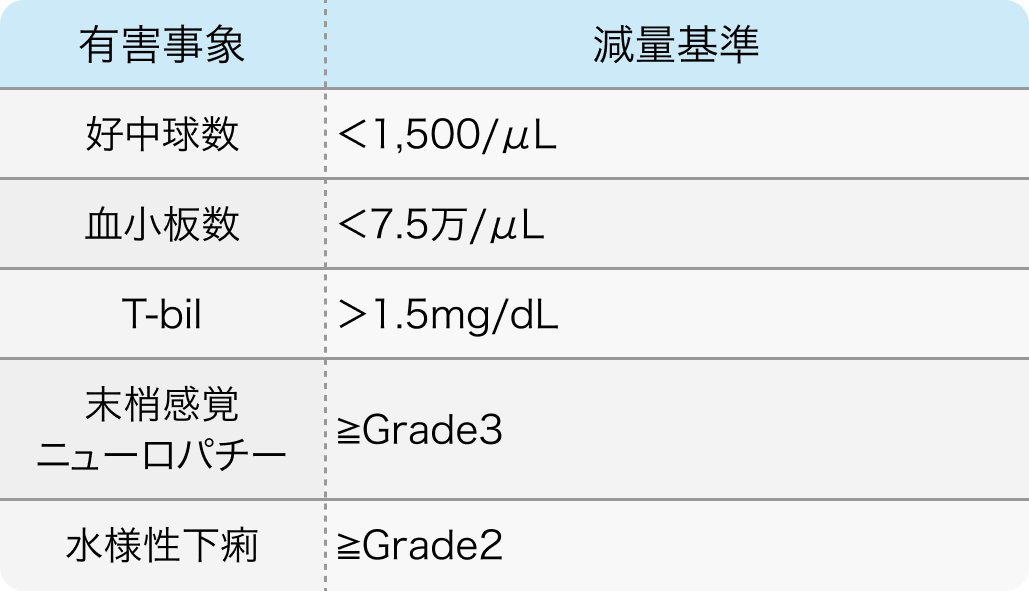
減量基準
Cancer Chemother Pharmacol. 2018 Jun;81(6):1017-1023¹⁾より抜粋
初回基準量と減量レベル

主な有害事象
第Ⅱ相試験¹⁾
Grade3以上の有害事象データを一部引用
主な有害事象
- 好中球数減少 47.8%
- 白血球数減少 29.0%
- 発熱性好中球減少症 8.7%
- 貧血 4.3%
- 血小板減少 2.9%
- 下痢 10.1%
- 悪心 8.7%
- 倦怠感 5.8%
注意すべき有害事象
- 末梢感覚ニューロパチー 5.8%
上手に使うためのワンポイント
UGT1A1遺伝子多型検査の必要性
UGT1A1遺伝子多型検査が投与前に必要であるが、 結果が得られるまでに1週間前後かかるため、 本レジメン開始時に結果が得られているよう、 早めに検査をしておく。
また、 UGT1A1遺伝子が*6または*28のホモ接合体、 *6と*28のヘテロ接合体のいずれかの患者において本レジメンの有効性、 安全性は確立していないため、 他のレジメンを選択もしくは、 少なくともイリノテカンを減量する。
催吐性リスク
本レジメンは使用する薬剤を個別に見ると催吐性リスクは中等度だが、 複数の薬剤を併用して行うため、 高度催吐性リスク (90%以上に症状が発現) に分類されている。 そのため予防的制吐療法を行う。
毒性の対処法
毒性によりコース開始が延期となった場合、 次コースから減量し、 2週毎の投与を目指す。
オキサリプラチンに伴う末梢感覚性/運動性ニューロパチーは蓄積性に増悪するため、 ミロガバリン、 プレガバリンなどの支持療法を行いながら、 増悪時は減量、 休薬し症状改善を図る。
生殖細胞系列BRCA遺伝子異常のオラパリブへの切り替え
生殖細胞系列BRCA遺伝子異常を認め、 かつ本レジメンが16週を超えて効果を認めている場合は、 オラパリブへの切り替えを検討する。
特徴と注意点
mFOLFIRINOX療法の特徴
mFOLFIRINOX療法はFOLFIRINOX原法における、 フルオロウラシルのボーラス投与を行わず、 イリノテカンの投与量を180mg/m²から150mg/m²に減量したレジメンである。
国内で行われた単群Ⅱ相試験では、 発熱性好中球減少症の発現割合は8.7%と高くなく、 生存期間中央値は11.2ヶ月とFOLFIRINOX原法と遜色ない結果であった。 この結果から、 臨床の現場ではFOLFIRINOX原法よりmFOLFIRINOXが頻用されている。
mFOLFIRINOX療法の対象となる患者
5-FUの持続点滴を行うため、 中心静脈ポートが必要である。 血液毒性、 消化器毒性がともに強いことから、 本レジメンの適用は75歳以下、 かつPS 0-1の全身状態が良好な患者に限る。
関連する臨床試験|第Ⅱ相試験¹⁾
未治療の転移性膵癌において、 modified FOLFIRINOXレジメン (mFOLFIRINOX) の効果を検証した単群コホートの第II相試験の結果より、 mFOLFIRINOXレジメンは、 予防的G-CSFを使用せず、 有効性を維持したまま安全性を改善させることが示された。
OS中央値
11.2ヵ月
(95%CI 9.0ヵ月-)
OS率 (1年時)
48.1%
(95%CI 36.1-60.1%)
PFS中央値
5.5ヵ月
(95%CI 4.1-6.7ヵ月)
PFS率 (1年時)
21%
(95%CI 11.2-30.7%)
ORR
37.7%
(95%CI 26.3-50.2%)
病勢コントロール率
78.3%
(95%CI 66.7-87.3%)
ORRと病勢コントロール率は、 FOLFIRINOX治療を受けたヒストリカルコントロール群の患者の奏効率と有意差はなかった。
奏効期間 (中央値)
167日
出典
最終更新日:2024年1月26日
執筆医:神奈川県立がんセンター 消化器内科 朝井靖二先生
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
mFOLFIRINOX
L-OHP:オキサリプラチン(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
l-LV:レボホリナートカルシウム(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
CPT-11:イリノテカン塩酸塩水和物(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150mg/m² 点滴 | 1~ | Day1 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
前投薬
その他
| 1コース14日間。 |
| L-OHP+l-LV+CPT-11+5−FUでFOLFIRINOX療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- エルプラット® (添付文書)
- アイソボリン® (添付文書)
- トポテシン® (添付文書)
- フルオロウラシル® (添付文書)
投与スケジュール
1コース 2週間

各プロトコル
適格基準例
Cancer Chemother Pharmacol. 2018 Jun;81(6):1017-1023¹⁾より抜粋

減量基準
Cancer Chemother Pharmacol. 2018 Jun;81(6):1017-1023¹⁾より抜粋

初回基準量と減量レベル

主な有害事象
第Ⅱ相試験¹⁾
Grade3以上の有害事象データを一部引用
主な有害事象
- 好中球数減少 47.8%
- 白血球数減少 29.0%
- 発熱性好中球減少症 8.7%
- 貧血 4.3%
- 血小板減少 2.9%
- 下痢 10.1%
- 悪心 8.7%
- 倦怠感 5.8%
注意すべき有害事象
- 末梢感覚ニューロパチー 5.8%
上手に使うためのワンポイント
UGT1A1遺伝子多型検査の必要性
UGT1A1遺伝子多型検査が投与前に必要であるが、 結果が得られるまでに1週間前後かかるため、 本レジメン開始時に結果が得られているよう、 早めに検査をしておく。
また、 UGT1A1遺伝子が*6または*28のホモ接合体、 *6と*28のヘテロ接合体のいずれかの患者において本レジメンの有効性、 安全性は確立していないため、 他のレジメンを選択もしくは、 少なくともイリノテカンを減量する。
催吐性リスク
本レジメンは使用する薬剤を個別に見ると催吐性リスクは中等度だが、 複数の薬剤を併用して行うため、 高度催吐性リスク (90%以上に症状が発現) に分類されている。 そのため予防的制吐療法を行う。
毒性の対処法
毒性によりコース開始が延期となった場合、 次コースから減量し、 2週毎の投与を目指す。
オキサリプラチンに伴う末梢感覚性/運動性ニューロパチーは蓄積性に増悪するため、 ミロガバリン、 プレガバリンなどの支持療法を行いながら、 増悪時は減量、 休薬し症状改善を図る。
生殖細胞系列BRCA遺伝子異常のオラパリブへの切り替え
生殖細胞系列BRCA遺伝子異常を認め、 かつ本レジメンが16週を超えて効果を認めている場合は、 オラパリブへの切り替えを検討する。
特徴と注意点
mFOLFIRINOX療法の特徴
mFOLFIRINOX療法はFOLFIRINOX原法における、 フルオロウラシルのボーラス投与を行わず、 イリノテカンの投与量を180mg/m²から150mg/m²に減量したレジメンである。
国内で行われた単群Ⅱ相試験では、 発熱性好中球減少症の発現割合は8.7%と高くなく、 生存期間中央値は11.2ヶ月とFOLFIRINOX原法と遜色ない結果であった。 この結果から、 臨床の現場ではFOLFIRINOX原法よりmFOLFIRINOXが頻用されている。
mFOLFIRINOX療法の対象となる患者
5-FUの持続点滴を行うため、 中心静脈ポートが必要である。 血液毒性、 消化器毒性がともに強いことから、 本レジメンの適用は75歳以下、 かつPS 0-1の全身状態が良好な患者に限る。
関連する臨床試験|第Ⅱ相試験¹⁾
未治療の転移性膵癌において、 modified FOLFIRINOXレジメン (mFOLFIRINOX) の効果を検証した単群コホートの第II相試験の結果より、 mFOLFIRINOXレジメンは、 予防的G-CSFを使用せず、 有効性を維持したまま安全性を改善させることが示された。
OS中央値
11.2ヵ月
(95%CI 9.0ヵ月-)
OS率 (1年時)
48.1%
(95%CI 36.1-60.1%)
PFS中央値
5.5ヵ月
(95%CI 4.1-6.7ヵ月)
PFS率 (1年時)
21%
(95%CI 11.2-30.7%)
ORR
37.7%
(95%CI 26.3-50.2%)
病勢コントロール率
78.3%
(95%CI 66.7-87.3%)
ORRと病勢コントロール率は、 FOLFIRINOX治療を受けたヒストリカルコントロール群の患者の奏効率と有意差はなかった。
奏効期間 (中央値)
167日
出典
最終更新日:2024年1月26日
執筆医:神奈川県立がんセンター 消化器内科 朝井靖二先生
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。






