Sorafenib
ソラフェニブ (ネクサバール®)
Sorafenib:Sorafenib(ネクサバール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 800mg/日 経口分2 | 1~ | 連日投与 |
前投薬
その他
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*バイエル薬品株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
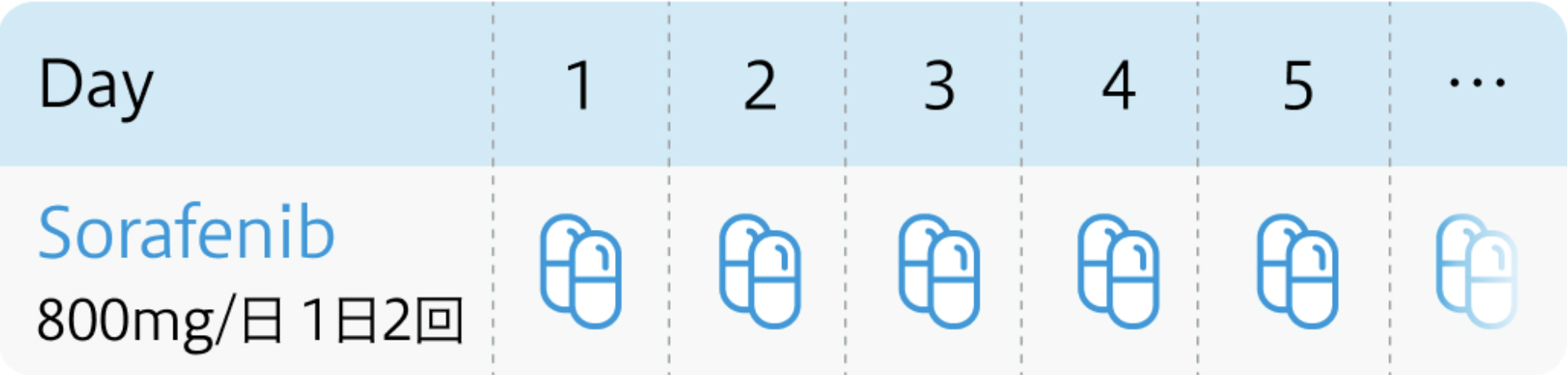
ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
投与開始基準
SHARP試験³⁾のプロトコル
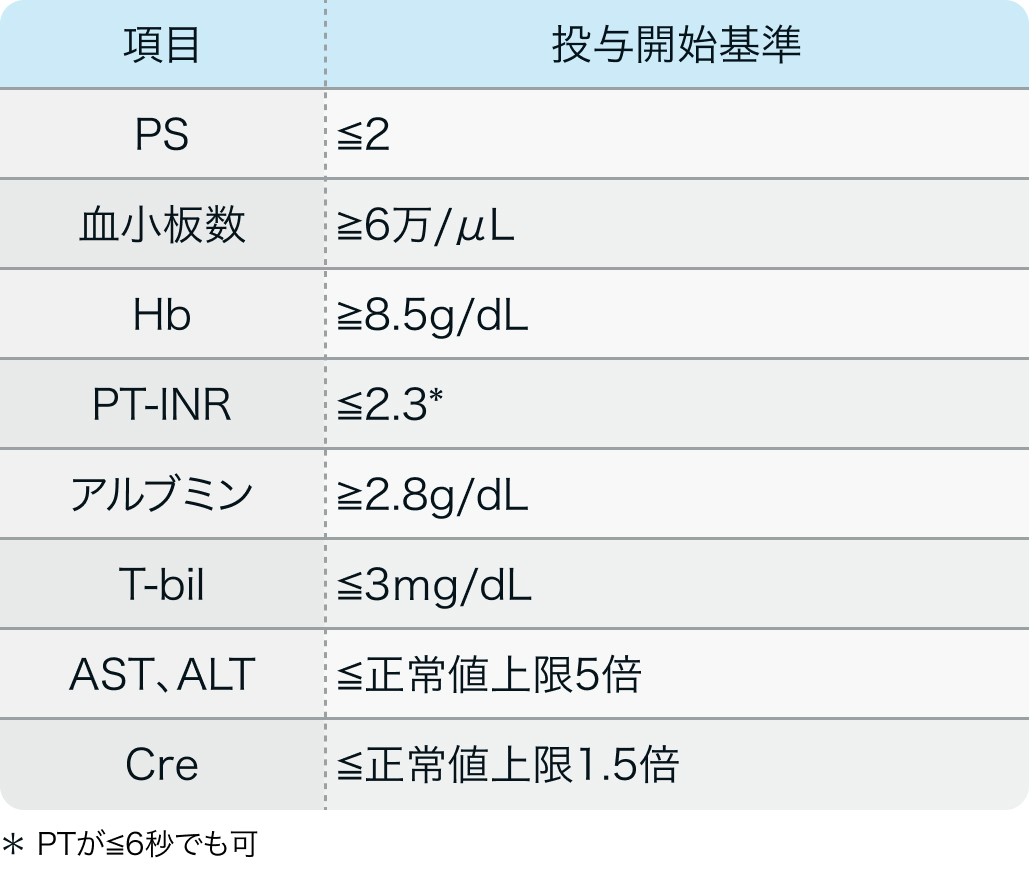
N Engl J Med. 2008 Jul 24;359(4):378-90³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
初回基準量と減量レベル

ネクサバール®適正使用ガイド (2024年5月作成)²⁾より作図
主な有害事象
SHARP試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 7.4% (1.3%)
- 体重減少 3.0% (0.7%)
- 脱毛症 4.7% (0%)
- 手足症候群 7.1% (2.7%)
- 下痢 13.1% (2.7%)
- 悪心 3.7% (0.3%)
- 嘔吐 1.7% (0.3%)
- 高血圧 1.7% (0.7%)
N Engl J Med. 2008 Jul 24;359(4):378-90³⁾より引用
特徴と注意点
進行肝細胞癌の薬物療法として、 最初に第Ⅲ相試験で優越性が検証されたチロシンキナーゼ阻害薬である。 現在の複合免疫療法の時代には、 使用する機会がかなり減少したが、 シーケンシャルな肝細胞癌の薬物療法として、 依然、 重要な役割を担っている。
監修 : 神奈川県立がんセンター 消化器内科 上野 誠先生
関連する臨床試験①|第I相試験⁴⁾
単施設第Ⅰ相試験である本試験では、 肝機能障害を有する日本人の肝細胞癌患者を対象に、 ソラフェニブの安全性および有効性が評価された。 その結果、 ソラフェニブは日本人の肝細胞癌患者において良好な忍容性と安全性を示し、 さらに有望な抗腫瘍活性が観察された。
全奏効率 (ORR)
3.7%
(95%CI 0.1-14.0%)
部分奏効 (PR) の1例のみ、 完全奏効 (CR) なし
病勢コントロール率 (DCR)
81.5%
病勢安定 (SD) は21例 (77.8%)、 病勢進行 (PD) は3例 (11.1%) だった。
無増悪期間 (TTP) 中央値
4.9ヵ月
6ヵ月の無増悪率は46.2%
全生存期間 (OS) 中央値
15.6ヵ月
1年時および2年時OS率はそれぞれ59.3%、 30.9%だった。
関連する臨床試験②|SHARP試験³⁾
本試験では、 進行性肝細胞癌患者を対象に、 ソラフェニブの有効性および安全性が多施設共同第Ⅲ相プラセボ対照二重盲検無作為化比較試験で検証された。 その結果、 主要評価項目の全生存期間 (OS) において、 有意な延長が示された。
OS中央値
- ソラフェニブ群 : 10.7ヵ月
- プラセボ群 : 7.9ヵ月
HR 0.69 (95%CI 0.55-0.87)、 p<0.001
症状増悪までの時間の中央値
- ソラフェニブ群 : 4.1ヵ月
- プラセボ群 : 4.9ヵ月
HR 1.08 (95%CI 0.88-1.31)、 p=0.77
放射線学的進行までの時間の中央値
- ソラフェニブ群 : 5.5ヵ月
- プラセボ群 : 2.8ヵ月
HR 0.58 (95%CI 0.45-0.74)、 p<0.001
病勢コントロール率
- ソラフェニブ群 : 43%
完全奏効 (CR) 0例、 部分奏効 (PR) 7例 (2%)、 安定 (SD) 211例 (71%)
- プラセボ群 : 32%
CR 0例、 PR 2例 (1%)、 SD 204例 (67%)
p=0.002
治療完遂率
- ソラフェニブ群 : 71例
- プラセボ群 : 60例
両群で最も多かった治療中止の理由は、 有害事象 (176例)、 および症状/放射線学的進行 (123例) であった。 治療期間中央値はソラフェニブ群で5.3ヵ月、 プラセボ群で4.3ヵ月だった。
出典
- バイエル薬品株式会社. ネクサバール®電子添文 (2024年2月改訂 第3版) [最終閲覧 : 2024/5/8]
- バイエル薬品株式会社. ネクサバール®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/7/3]
- Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008 Jul 24;359(4):378-90. PMID: 18650514
- Phase I study of sorafenib in Japanese patients with hepatocellular carcinoma. Cancer Sci. 2008 Jan;99(1):159-65. PMID: 17953709
最終更新日 : 2024年7月8日
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
Sorafenib
Sorafenib:Sorafenib(ネクサバール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 800mg/日 経口分2 | 1~ | 連日投与 |
前投薬
その他
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*バイエル薬品株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量

ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
投与開始基準
SHARP試験³⁾のプロトコル

N Engl J Med. 2008 Jul 24;359(4):378-90³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
初回基準量と減量レベル

ネクサバール®適正使用ガイド (2024年5月作成)²⁾より作図
主な有害事象
SHARP試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 7.4% (1.3%)
- 体重減少 3.0% (0.7%)
- 脱毛症 4.7% (0%)
- 手足症候群 7.1% (2.7%)
- 下痢 13.1% (2.7%)
- 悪心 3.7% (0.3%)
- 嘔吐 1.7% (0.3%)
- 高血圧 1.7% (0.7%)
N Engl J Med. 2008 Jul 24;359(4):378-90³⁾より引用
特徴と注意点
進行肝細胞癌の薬物療法として、 最初に第Ⅲ相試験で優越性が検証されたチロシンキナーゼ阻害薬である。 現在の複合免疫療法の時代には、 使用する機会がかなり減少したが、 シーケンシャルな肝細胞癌の薬物療法として、 依然、 重要な役割を担っている。
監修 : 神奈川県立がんセンター 消化器内科 上野 誠先生
関連する臨床試験①|第I相試験⁴⁾
単施設第Ⅰ相試験である本試験では、 肝機能障害を有する日本人の肝細胞癌患者を対象に、 ソラフェニブの安全性および有効性が評価された。 その結果、 ソラフェニブは日本人の肝細胞癌患者において良好な忍容性と安全性を示し、 さらに有望な抗腫瘍活性が観察された。
全奏効率 (ORR)
3.7%
(95%CI 0.1-14.0%)
部分奏効 (PR) の1例のみ、 完全奏効 (CR) なし
病勢コントロール率 (DCR)
81.5%
病勢安定 (SD) は21例 (77.8%)、 病勢進行 (PD) は3例 (11.1%) だった。
無増悪期間 (TTP) 中央値
4.9ヵ月
6ヵ月の無増悪率は46.2%
全生存期間 (OS) 中央値
15.6ヵ月
1年時および2年時OS率はそれぞれ59.3%、 30.9%だった。
関連する臨床試験②|SHARP試験³⁾
本試験では、 進行性肝細胞癌患者を対象に、 ソラフェニブの有効性および安全性が多施設共同第Ⅲ相プラセボ対照二重盲検無作為化比較試験で検証された。 その結果、 主要評価項目の全生存期間 (OS) において、 有意な延長が示された。
OS中央値
- ソラフェニブ群 : 10.7ヵ月
- プラセボ群 : 7.9ヵ月
HR 0.69 (95%CI 0.55-0.87)、 p<0.001
症状増悪までの時間の中央値
- ソラフェニブ群 : 4.1ヵ月
- プラセボ群 : 4.9ヵ月
HR 1.08 (95%CI 0.88-1.31)、 p=0.77
放射線学的進行までの時間の中央値
- ソラフェニブ群 : 5.5ヵ月
- プラセボ群 : 2.8ヵ月
HR 0.58 (95%CI 0.45-0.74)、 p<0.001
病勢コントロール率
- ソラフェニブ群 : 43%
完全奏効 (CR) 0例、 部分奏効 (PR) 7例 (2%)、 安定 (SD) 211例 (71%)
- プラセボ群 : 32%
CR 0例、 PR 2例 (1%)、 SD 204例 (67%)
p=0.002
治療完遂率
- ソラフェニブ群 : 71例
- プラセボ群 : 60例
両群で最も多かった治療中止の理由は、 有害事象 (176例)、 および症状/放射線学的進行 (123例) であった。 治療期間中央値はソラフェニブ群で5.3ヵ月、 プラセボ群で4.3ヵ月だった。
出典
- バイエル薬品株式会社. ネクサバール®電子添文 (2024年2月改訂 第3版) [最終閲覧 : 2024/5/8]
- バイエル薬品株式会社. ネクサバール®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/7/3]
- Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008 Jul 24;359(4):378-90. PMID: 18650514
- Phase I study of sorafenib in Japanese patients with hepatocellular carcinoma. Cancer Sci. 2008 Jan;99(1):159-65. PMID: 17953709
最終更新日 : 2024年7月8日
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。





