SOX+Nivo
S-1+オキサリプラチン+ニボルマブ
Nivolumab:ニボルマブ(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 360mg/body 点滴 | 1~ | Day1 |
L-OHP:オキサリプラチン(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 130mg/m² 点滴 | 1~ | Day1 |
S-1:テガフール・ギメラシル・オテラシルカリウム(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80mg/m² 経口 (40mg/m²朝夕) | 1~ | Day1~14 |
その他
| 1コース21日間。 |
| S-1+L-OHPをSOX療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
SOX療法¹⁾²⁾
有害事象が発現した場合、 オキサリプラチンは3段階、 S-1は2段階まで減量レベルを設定。 S-1が投与中止となった場合は、 オキサリプラチンの投与を中止したが、 オキサリプラチンが投与中止となった場合はS-1の投与は継続可能であった。
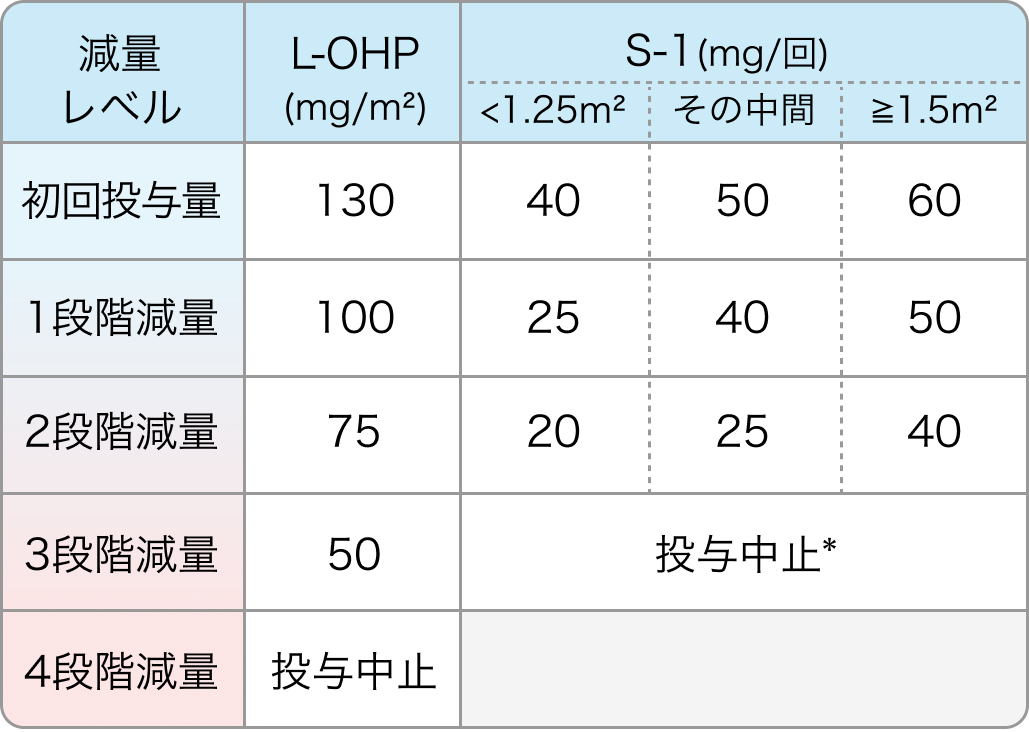
*S-1の投与中止時にはオキサリプラチンの投与も中止する
体表面積計算式 (DuBois)はこちらから算出いただけます
Nivolmab¹⁾²⁾
オプジーボの減量基準は設定されなかった
投与開始基準
SOX療法¹⁾²⁾
投与開始予定日に以下のいずれかの投与開始基準を満たさなかった場合、 当該条件を満たす状態へ回復するまで投与を延期していた。
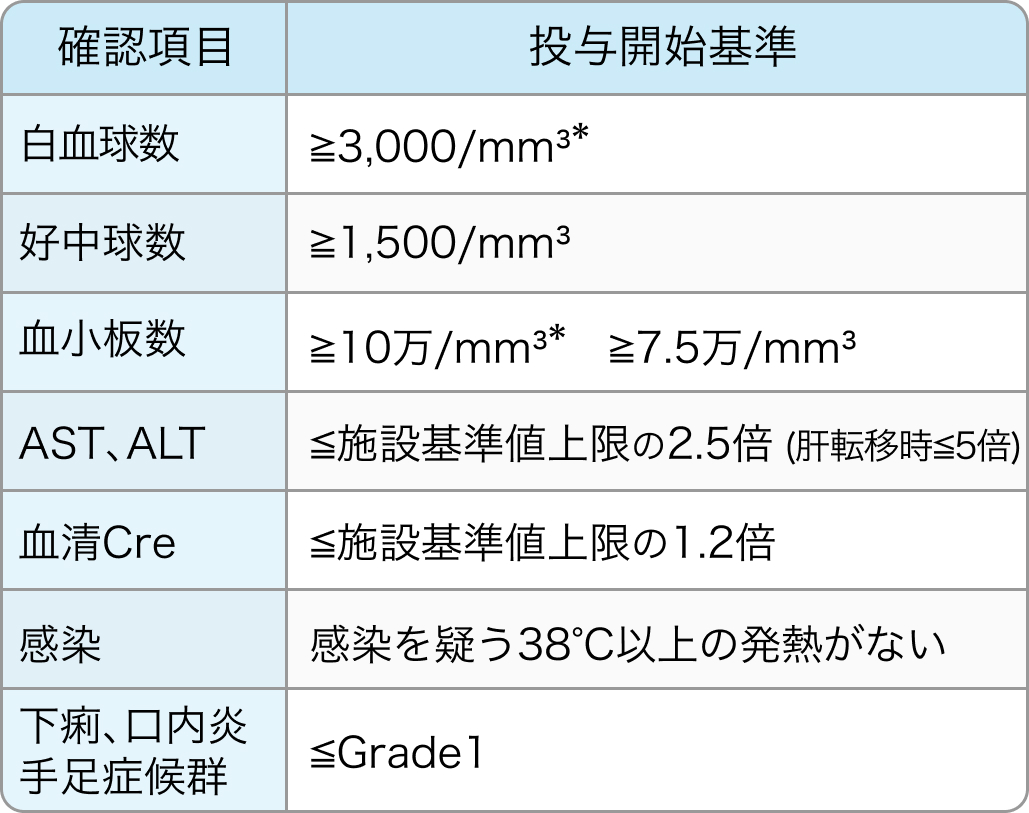
*オキサリプラチン130mg/m³投与時のみ
Nivolmab¹⁾²⁾
いずれかの基準に合致しない場合、 予定されたオプジーボの投与をスキップ (ただし、 臨床的ベネフィットが期待され、 症例のベースライン及び併用薬の影響を考慮して安全に投与を継続可能と判断された場合に限り、 オプジーボの投与継続が可能とした)。
- 治験薬との因果関係が否定できないGrade 3以上の有害事象が発現していない
- 治験薬との因果関係が否定できないGrade 2以上の下痢又は大腸炎が発現していない
- 治験薬との因果関係が否定できないGrade 2以上のCre増加が発現していない
- 治験薬との因果関係が否定できないGrade 2以上の神経毒性が発現していない
- 治験薬との因果関係が否定できない治験薬投与開始前の結果から2Grade以上のAST、 ALTまたはT-Bilの上昇が認められない
例えば、Grade1からGrade3への上昇、 またはGrade 0からGrade 2への上昇
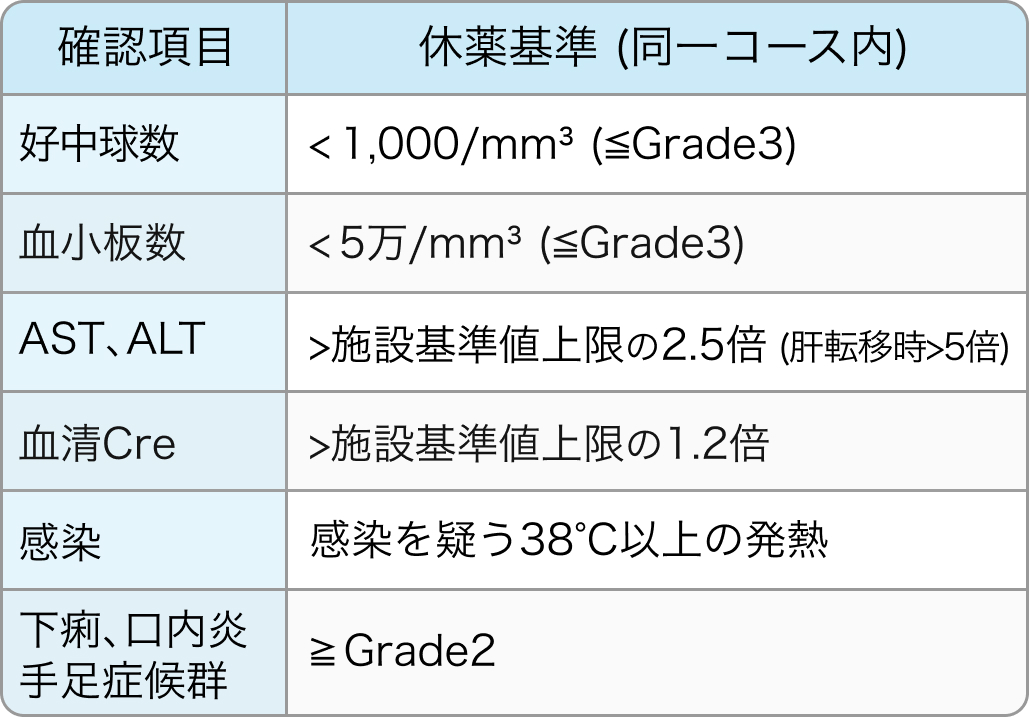
休薬・中止基準
S-1の休薬基準¹⁾²⁾
S-1投与開始後、 投与期間中にS-1休薬基準のいずれかの項目に抵触した場合はS-1を休薬し、 当該基準を満たさなくなってから投与再開していた。 ただし、 投与再開後の投与期間は休薬前のS-1投与開始15日目の朝までとしていた。
減量基準
SOX療法¹⁾²⁾
有害事象が発現した場合は、 以下のように減量を行っていた。なお、 いずれの薬剤においても減量後の増量は実施しなかった。
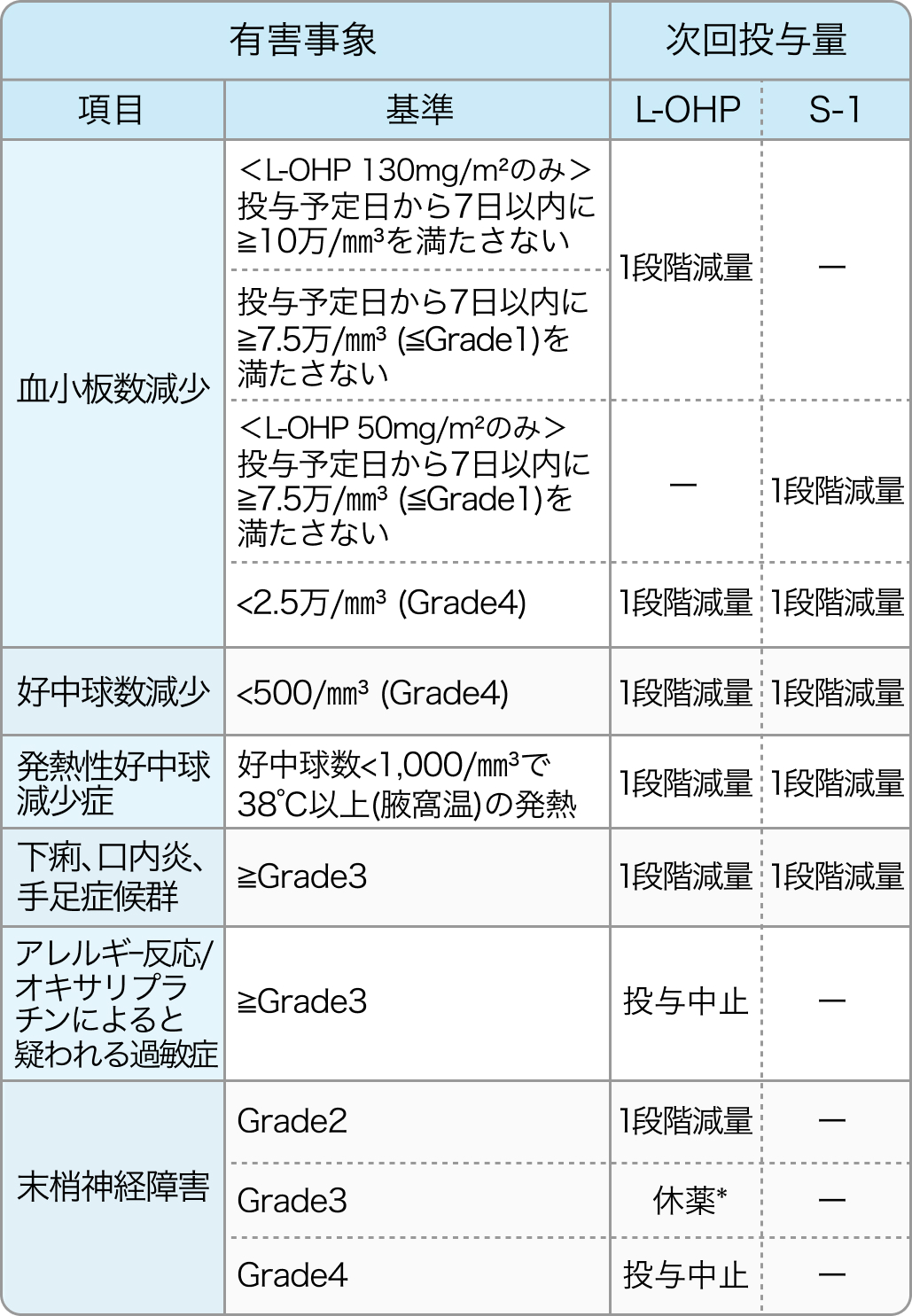
*Grade2以下に回復後の1段階減量からの再開
主な有害事象
ATTRACTION-4試験²⁾
SOX /CapeOX+Nivolumabでの有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 好中球減少 44% (20%)
- 血小板減少 41% (10%)
- 食欲減退 52% (8%)
- 貧血 19% (8%)
- 下痢 34% (4%)
注意すべき有害事象
- 末梢性感覚ニューロパチー 56% (4%)
上手に使うためのワンポイント
オキサリプラチンの中止について
2次治療でのパクリタキセル投与を考慮するとCIPN (化学療法誘発性末梢神経障害) Grade1の時点でも腫瘍縮小が得られているのであればオキサリプラチン終了を考慮してよいと考える。
オキサリプラチン130mg/m²なら6コース、 オキサリプラチン100mg/m²なら8コースでの投与終了も選択肢となる。
神奈川県立がんセンター消化器内科部長 町田望先生
CPS<5 (+MSS+EBV-) のとき
治療中止となるirAE出現の際、 再投与は積極的には行わない。
神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
ガイドラインでは、 HER2陰性胃癌1次治療において 「推奨される化学療法レジメン」 である³⁾。
CheckMate649試験において、 CPS低値の場合にニボルマブ併用のSurvival Benefit低下が指摘されているが、 奏効割合はCPS低値でもニボルマブの上乗せ効果が認められている⁴⁾。
vulnerableな高齢患者への適用には、 オキサリプラチン併用を要するため、 注意が必要である。
診療報酬明細書の摘要欄にHER2陰性を確認した検査実施日の記載が求められることから、 事前のHER2検査は必須である⁵⁾。
関連する臨床試験
ATTRACTION-4試験¹⁾²⁾
アジア (日本・韓国・台湾)にて実施された第 II/III 相試験であり、 HER2陰性の未治療胃癌患者を対象に標準治療 (SOX療法もしくはCapeOX 療法)に対するニボルマブの上乗せによるPFSとOSにおける優越性が検討された (PFSとOSともに主要評価項目)。
Ann Oncol. 2019 Feb 1;30(2):250-258.
Lancet Oncol. 2022 Feb;23(2):234-247.
CheckMate649試験³⁾
日本を含む国際共同非盲検無作為化比較第III 相試験で、 HER2陰性の未治療胃癌患者を対象に、 コントロールアームをCapeOX 療法もしくはFOLFOXとし、 イピリムマブ+ニボルマブもしくは化学療法+ニボルマブ併用のPFSとOSにおける優越性が検討された (PFSとOSともに主要評価項目)。
Lancet. 2021 Jul 3;398(10294):27-40.
参考文献
- Nivolumab plus S-1/capecitabine plus oxaliplatin versus placebo plus S-1/capecitabine plus oxaliplatin in patients with previously untreated, unresectable advanced or recurrent HER2-negative gastric/gastroesophageal junction cancer: a multi-centre, randomised, double-blind, phase 3 trial (ATTRACTION-4). Ann Oncol. 2019 Feb 1;30(2):250-258. PMID: 30566590
- Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022 Feb;23(2):234-247. PMID: 35030335
- Japanese Gastric Cancer Treatment Guidelines 2021 (6th edition). Gastric Cancer. 2023 Jan;26(1):1-25. PMID: 36342574
- First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021 Jul 3;398(10294):27-40. PMID: 34102137
- 抗PD―1抗体抗悪性腫瘍剤に係る最適使用推進ガイドラインの策定に伴う留意事項の一部改正について (令和3年11月25日) https://www.mhlw.go.jp/web/t_doc?dataId=00tc6311&dataType=1&pageNo=1 [最終確認 2023/01/30]
最終更新日:2023年1月31日
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
SOX+Nivo
Nivolumab:ニボルマブ(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 360mg/body 点滴 | 1~ | Day1 |
L-OHP:オキサリプラチン(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 130mg/m² 点滴 | 1~ | Day1 |
S-1:テガフール・ギメラシル・オテラシルカリウム(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80mg/m² 経口 (40mg/m²朝夕) | 1~ | Day1~14 |
その他
| 1コース21日間。 |
| S-1+L-OHPをSOX療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
SOX療法¹⁾²⁾
有害事象が発現した場合、 オキサリプラチンは3段階、 S-1は2段階まで減量レベルを設定。 S-1が投与中止となった場合は、 オキサリプラチンの投与を中止したが、 オキサリプラチンが投与中止となった場合はS-1の投与は継続可能であった。

*S-1の投与中止時にはオキサリプラチンの投与も中止する
体表面積計算式 (DuBois)はこちらから算出いただけます
Nivolmab¹⁾²⁾
オプジーボの減量基準は設定されなかった
投与開始基準
SOX療法¹⁾²⁾
投与開始予定日に以下のいずれかの投与開始基準を満たさなかった場合、 当該条件を満たす状態へ回復するまで投与を延期していた。

*オキサリプラチン130mg/m³投与時のみ
Nivolmab¹⁾²⁾
いずれかの基準に合致しない場合、 予定されたオプジーボの投与をスキップ (ただし、 臨床的ベネフィットが期待され、 症例のベースライン及び併用薬の影響を考慮して安全に投与を継続可能と判断された場合に限り、 オプジーボの投与継続が可能とした)。
- 治験薬との因果関係が否定できないGrade 3以上の有害事象が発現していない
- 治験薬との因果関係が否定できないGrade 2以上の下痢又は大腸炎が発現していない
- 治験薬との因果関係が否定できないGrade 2以上のCre増加が発現していない
- 治験薬との因果関係が否定できないGrade 2以上の神経毒性が発現していない
- 治験薬との因果関係が否定できない治験薬投与開始前の結果から2Grade以上のAST、 ALTまたはT-Bilの上昇が認められない
例えば、Grade1からGrade3への上昇、 またはGrade 0からGrade 2への上昇
休薬・中止基準
S-1の休薬基準¹⁾²⁾
S-1投与開始後、 投与期間中にS-1休薬基準のいずれかの項目に抵触した場合はS-1を休薬し、 当該基準を満たさなくなってから投与再開していた。 ただし、 投与再開後の投与期間は休薬前のS-1投与開始15日目の朝までとしていた。

減量基準
SOX療法¹⁾²⁾
有害事象が発現した場合は、 以下のように減量を行っていた。なお、 いずれの薬剤においても減量後の増量は実施しなかった。

*Grade2以下に回復後の1段階減量からの再開
主な有害事象
ATTRACTION-4試験²⁾
SOX /CapeOX+Nivolumabでの有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 好中球減少 44% (20%)
- 血小板減少 41% (10%)
- 食欲減退 52% (8%)
- 貧血 19% (8%)
- 下痢 34% (4%)
注意すべき有害事象
- 末梢性感覚ニューロパチー 56% (4%)
上手に使うためのワンポイント
オキサリプラチンの中止について
2次治療でのパクリタキセル投与を考慮するとCIPN (化学療法誘発性末梢神経障害) Grade1の時点でも腫瘍縮小が得られているのであればオキサリプラチン終了を考慮してよいと考える。
オキサリプラチン130mg/m²なら6コース、 オキサリプラチン100mg/m²なら8コースでの投与終了も選択肢となる。
神奈川県立がんセンター消化器内科部長 町田望先生
CPS<5 (+MSS+EBV-) のとき
治療中止となるirAE出現の際、 再投与は積極的には行わない。
神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
ガイドラインでは、 HER2陰性胃癌1次治療において 「推奨される化学療法レジメン」 である³⁾。
CheckMate649試験において、 CPS低値の場合にニボルマブ併用のSurvival Benefit低下が指摘されているが、 奏効割合はCPS低値でもニボルマブの上乗せ効果が認められている⁴⁾。
vulnerableな高齢患者への適用には、 オキサリプラチン併用を要するため、 注意が必要である。
診療報酬明細書の摘要欄にHER2陰性を確認した検査実施日の記載が求められることから、 事前のHER2検査は必須である⁵⁾。
関連する臨床試験
ATTRACTION-4試験¹⁾²⁾
アジア (日本・韓国・台湾)にて実施された第 II/III 相試験であり、 HER2陰性の未治療胃癌患者を対象に標準治療 (SOX療法もしくはCapeOX 療法)に対するニボルマブの上乗せによるPFSとOSにおける優越性が検討された (PFSとOSともに主要評価項目)。
Ann Oncol. 2019 Feb 1;30(2):250-258.
Lancet Oncol. 2022 Feb;23(2):234-247.
CheckMate649試験³⁾
日本を含む国際共同非盲検無作為化比較第III 相試験で、 HER2陰性の未治療胃癌患者を対象に、 コントロールアームをCapeOX 療法もしくはFOLFOXとし、 イピリムマブ+ニボルマブもしくは化学療法+ニボルマブ併用のPFSとOSにおける優越性が検討された (PFSとOSともに主要評価項目)。
Lancet. 2021 Jul 3;398(10294):27-40.
参考文献
- Nivolumab plus S-1/capecitabine plus oxaliplatin versus placebo plus S-1/capecitabine plus oxaliplatin in patients with previously untreated, unresectable advanced or recurrent HER2-negative gastric/gastroesophageal junction cancer: a multi-centre, randomised, double-blind, phase 3 trial (ATTRACTION-4). Ann Oncol. 2019 Feb 1;30(2):250-258. PMID: 30566590
- Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022 Feb;23(2):234-247. PMID: 35030335
- Japanese Gastric Cancer Treatment Guidelines 2021 (6th edition). Gastric Cancer. 2023 Jan;26(1):1-25. PMID: 36342574
- First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021 Jul 3;398(10294):27-40. PMID: 34102137
- 抗PD―1抗体抗悪性腫瘍剤に係る最適使用推進ガイドラインの策定に伴う留意事項の一部改正について (令和3年11月25日) https://www.mhlw.go.jp/web/t_doc?dataId=00tc6311&dataType=1&pageNo=1 [最終確認 2023/01/30]
最終更新日:2023年1月31日
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。