REGO
レゴラフェニブ
治療スケジュール
概要
監修医師
REGO:レゴラフェニブ(スチバーガ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 160mg/日 経口分1朝食後 | 1~ | day1~21 |
前投薬
その他
| 1コース28日間。 |
REGOの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
用法用量 (1コース4週間)
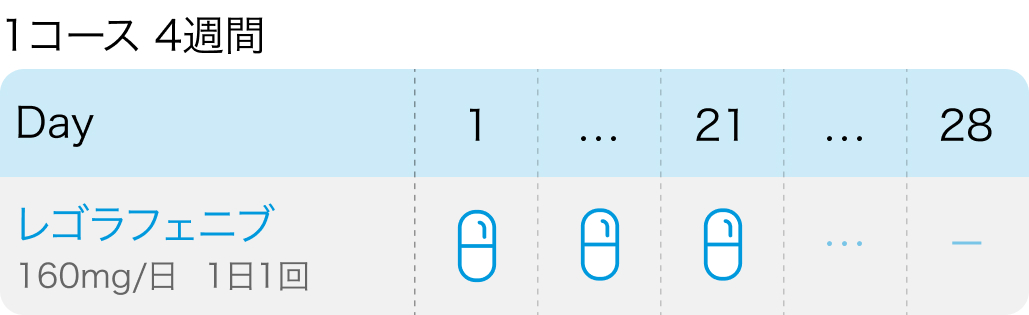
減量基準
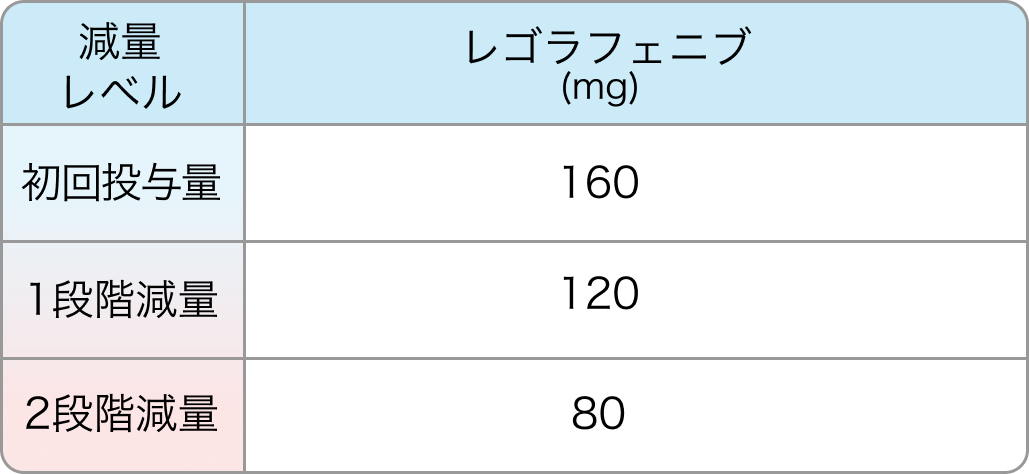
初回基準量と減量レベル
手足症候群の用量調節基準
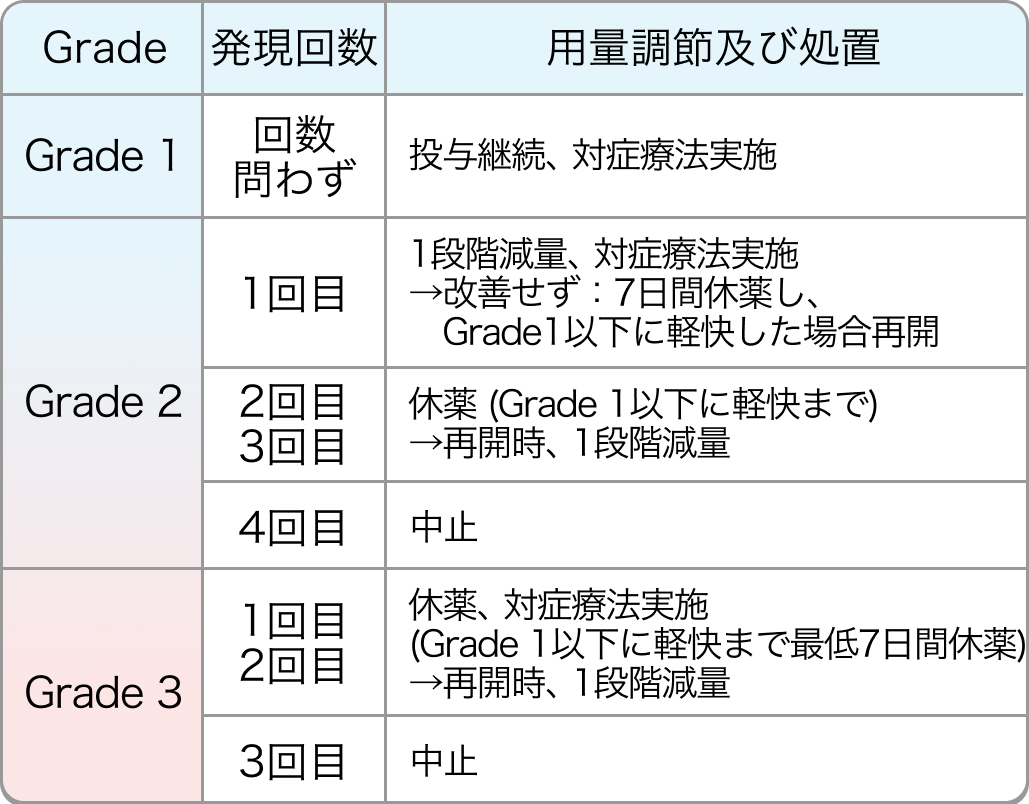
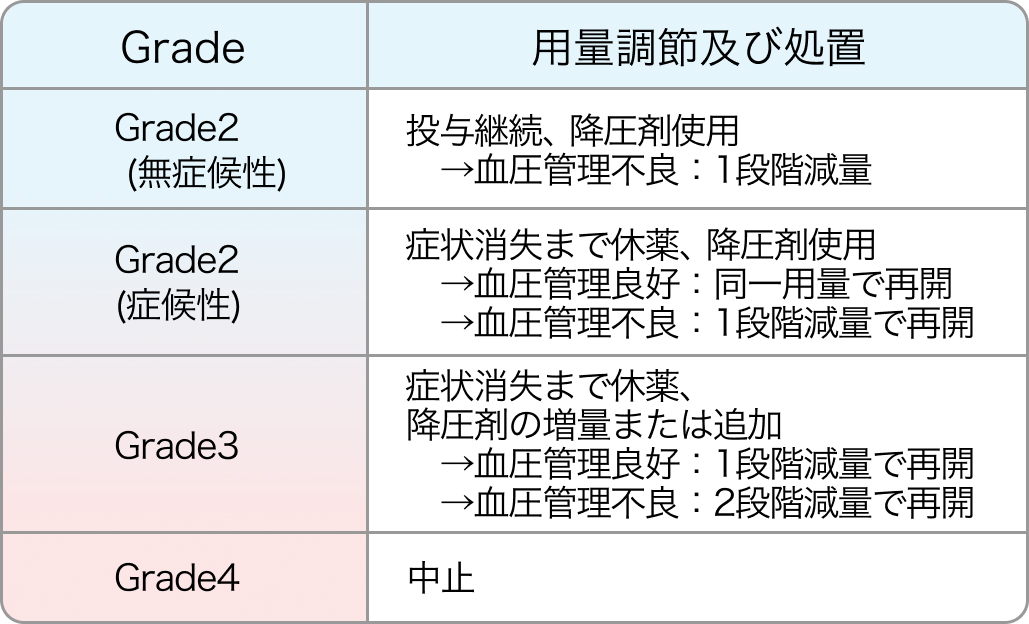
高血圧の用量調節基準
肝機能検査値異常の用量調節基準

スチバーガはUGT1A1によるグルクロン酸抱合を阻害する。 そのため、 ジルベール症候群の患者においては間接型ビリルビンが上昇することがあり、 AST又はALTの上昇を認めた場合はビリルビン値の基準によらず、 上図で規定するAST又はALTの基準に従う。
主な有害事象
CORRECT試験
国際的に実施した試験の有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 疲労 47% (10%)
- 下痢 34% (7%)
- 食欲不振 30% (3%)
- 高血圧 28% (7%)
- 発疹/落屑 26% (6%)
注意すべき有害事象
- 手足症候群 47% (17%)
関連する臨床試験
CORRECT試験¹⁾
日本を含む国際共同第Ⅲ相臨床試験で、 標準化学療法後に病勢進行が認められた切除不能な結腸・直腸癌患者を対象とした。 OSにおいてスチバーガ群のプラセボ群に対する優越性が検証された。
Lancet. 2013 Jan 26;381(9863):303-12.
ReDOS試験²⁾
標準用量群と低用量で開始後1週間毎に漸増する群との忍容性を比較する多施設共同第II相無作為化非盲検化試験で、 癌研究ネットワークACCRU (Academic and Community Cancer Research United) によって行われた。 18歳以上、 ECOG PS 0/1、 余命3ヵ月以上、 組織学的/細胞学的に結腸/直腸の腺癌と認められ、 標準化学療法 (フッ化ピリミジン系薬剤、 Oxaliplatin、 Irinotecan、 抗VEGF抗体薬、 抗EGFR抗体薬が適格の患者においては抗EGFR抗体薬) 不応となった症例が対象となった。
参考文献
- Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013 Jan 26;381(9863):303-12.PMID: 23177514
- Regorafenib dose optimization study (ReDOS): Randomized phase II trial to evaluate dosing strategies for regorafenib in refractory metastatic colorectal cancer (mCRC)—An ACCRU Network study. ASCO-GI2018
2023年3月以降、 順次追加予定です。 もうしばらくお待ち下さい。
最終更新日:2023年3月15日
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
REGOの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
REGO
レゴラフェニブ
2023年03月16日更新
REGO:レゴラフェニブ(スチバーガ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 160mg/日 経口分1朝食後 | 1~ | day1~21 |
前投薬
その他
| 1コース28日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
用法用量 (1コース4週間)

減量基準
初回基準量と減量レベル

手足症候群の用量調節基準

高血圧の用量調節基準

肝機能検査値異常の用量調節基準

スチバーガはUGT1A1によるグルクロン酸抱合を阻害する。 そのため、 ジルベール症候群の患者においては間接型ビリルビンが上昇することがあり、 AST又はALTの上昇を認めた場合はビリルビン値の基準によらず、 上図で規定するAST又はALTの基準に従う。
主な有害事象
CORRECT試験
国際的に実施した試験の有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 疲労 47% (10%)
- 下痢 34% (7%)
- 食欲不振 30% (3%)
- 高血圧 28% (7%)
- 発疹/落屑 26% (6%)
注意すべき有害事象
- 手足症候群 47% (17%)
関連する臨床試験
CORRECT試験¹⁾
日本を含む国際共同第Ⅲ相臨床試験で、 標準化学療法後に病勢進行が認められた切除不能な結腸・直腸癌患者を対象とした。 OSにおいてスチバーガ群のプラセボ群に対する優越性が検証された。
Lancet. 2013 Jan 26;381(9863):303-12.
ReDOS試験²⁾
標準用量群と低用量で開始後1週間毎に漸増する群との忍容性を比較する多施設共同第II相無作為化非盲検化試験で、 癌研究ネットワークACCRU (Academic and Community Cancer Research United) によって行われた。 18歳以上、 ECOG PS 0/1、 余命3ヵ月以上、 組織学的/細胞学的に結腸/直腸の腺癌と認められ、 標準化学療法 (フッ化ピリミジン系薬剤、 Oxaliplatin、 Irinotecan、 抗VEGF抗体薬、 抗EGFR抗体薬が適格の患者においては抗EGFR抗体薬) 不応となった症例が対象となった。
参考文献
- Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013 Jan 26;381(9863):303-12.PMID: 23177514
- Regorafenib dose optimization study (ReDOS): Randomized phase II trial to evaluate dosing strategies for regorafenib in refractory metastatic colorectal cancer (mCRC)—An ACCRU Network study. ASCO-GI2018
2023年3月以降、 順次追加予定です。 もうしばらくお待ち下さい。
最終更新日:2023年3月15日
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
REGOの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。