Pembrolizumab+T-mab+CAPOX
ペムブロリズマブ+トラスツズマブ+カペシタビン+オキサリプラチン
Pembrolizumab:Pembrolizumab(キイトルーダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg 点滴 | 1~35 | Day 1 |
T-mab:Trastuzumab(ハーセプチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 初回8mg/kg、以降6mg/kg 点滴 | 1~ | Day 1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 130mg/m² 点滴 | 1~6または8 | Day 1 |
Cape:Capecitabine(ゼローダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1000mg/m² 1日2回 内服 | 1~ | Day 1~14 |
前投薬
| トラスツズマブによるinfusion reactionの発現回避を目的とした前投薬の有用性は確認されていない。 |
その他
| 1コース21日間 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
2025年5月21日、 添付文書が改訂され、 PD-L1陽性が確認されたHER2陽性の治癒切除不能な進行・再発の胃癌患者の1次療法として投与可能となった。
薬剤情報
- キイトルーダ® (添付文書¹⁾ / 適正使用情報²⁾*)
*MSD製薬の外部サイトへ遷移します
- ハーセプチン® (添付文書)
- ゼローダ® (添付文書)
- エルプラット® (添付文書)
投与スケジュール
治癒切除不能な進行・再発の胃癌
【1コース】3週間
【催吐性】中等度
【FN発症】未報告

キイトルーダ®適正使用ガイド²⁾を基に編集部作図
KEYNOTE-811試験³⁾の投与スケジュール
ペムブロリズマブ : 200mgを3週ごとに、 各サイクル1日目に30分かけて投与
トラスツズマブ : 初回8mg/kg、 以降は6mg/kgを3週ごとに、 各サイクル1日目に投与
L-OHP : 130mg/m²を3週ごとに、 各サイクル1日目に2時間かけて投与 (最大6~8コースまでとすることも可能)
Cape : 1,000 mg/m²を1日2回、 各サイクル1~14日目に3週ごとで投与
ペムブロリズマブは最大35サイクル (約2年間) まで投与され、 トラスツズマブおよびCapeは、 医師の判断により35サイクル後も最大1年間の延長投与が可能とされた。
Key Data|臨床試験結果
📊 KEYNOTE-811試験³⁾
未治療・HER2陽性の局所進行切除不能または転移性胃腺癌/食道胃接合部腺癌698例を対象に実施された、 国際共同無作為化第III相二重盲検プラセボ対照試験である。 ペムブロリズマブ+トラスツズマブ+化学療法群 (ペムブロリズマブ群) と、 プラセボ+トラスツズマブ+化学療法群 (プラセボ群) に1:1の比率で無作為に割り付け、 主要評価項目としてPFSおよびOSが設定された。 化学療法は、 5-FU+シスプラチン (FP療法) またはカペシタビン+オキサリプラチン (CAPOX療法) から選択された。 なお、 日本においてはSOX療法コホートとして全40例が組み入れられた。
【有効性】ペムブロリズマブ群 (vs プラセボ群)
本データは3回目の中間解析時点のものであり、 SOX療法のコホートは解析対象に含まれていない。
- PFS中央値 : 10.0ヵ月 (vs 8.1ヵ月)
- 全集団 : HR 0.72、 95%CI 0.61–0.87
- CPS≧1 : HR 0.71、 95%CI 0.59–0.86
- CPS<1 : HR 1.03、 95%CI 0.65–1.64
- OS中央値 : 20.0ヵ月 (vs 16.8ヵ月)
- 全集団 : HR 0.84、 95%CI 0.70–1.01
- CPS≧1 : HR 0.81、 95%CI 0.67–0.98
独立データモニタリング委員会は、 OSの事前規定された最終解析まで試験を継続するよう勧告
- 客観的奏効率 : 72.6% (vs 59.8%)
- 奏効期間中央値: 11.3ヵ月 (vs 9.5%)
【安全性】主な有害事象 : 全Grade (≧Grade3)
複数の化学療法レジメン (FP、 CAPOX、 SOX) を含む集計
- 下痢 47% (9%)
- 悪心 44% (4%)
- 貧血 31% (6%)
- 好中球数減少 26% (8%)
- 食欲減退 26% (3%)
- 血小板数減少 25% (6%)
- 嘔吐 25% (4%)
- 末梢性感覚ニューロパチー 24% (4%)
- 手掌・足底発赤知覚不全症候群 22% (1%)
- 疲労 20% (3%)
- AST増加 19% (2%)
- 末梢性ニューロパチー 17% (2%)
- 好中球減少症 17% (6%)
- 白血球数減少 15% (1%)
- ALT増加 15% (1%)
- 体重減少 12% (1%)
- Infusion reaction 16% (3%)
- 血小板減少症 11% (3%)
- 無力症 11% (2%)
- 血中ビリルビン増加 11% (1%)
- 口内炎 10% (1%)
主な免疫関連有害事象
- 甲状腺機能低下症 11% (<1%)
- 肺臓炎 6% (2%)
- 大腸炎 5% (3%)
- 甲状腺機能亢進症 4% (0%)
各プロトコル
適格基準
KEYNOTE-811試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球数 ≧1,500/μL
- 血小板数 ≧100,000/μL
- ヘモグロビン値 ≧9.0g/dL
- クレアチニン ≦1.5 × ULN または CrCl ≧60 mL/min (クレアチニン >1.5 × ULN の場合)
- 総ビリルビン ≦1.5 × ULN (総ビリルビン >1.5 × ULN の場合は直接ビリルビン ≦ULN)
- AST/ALT ≦2.5 × ULN (肝転移例は ≦5 × ULN)
- LVEF ≧55%
用量レベル
ペムブロリズマブおよびトラスツズマブの減量は行わない。
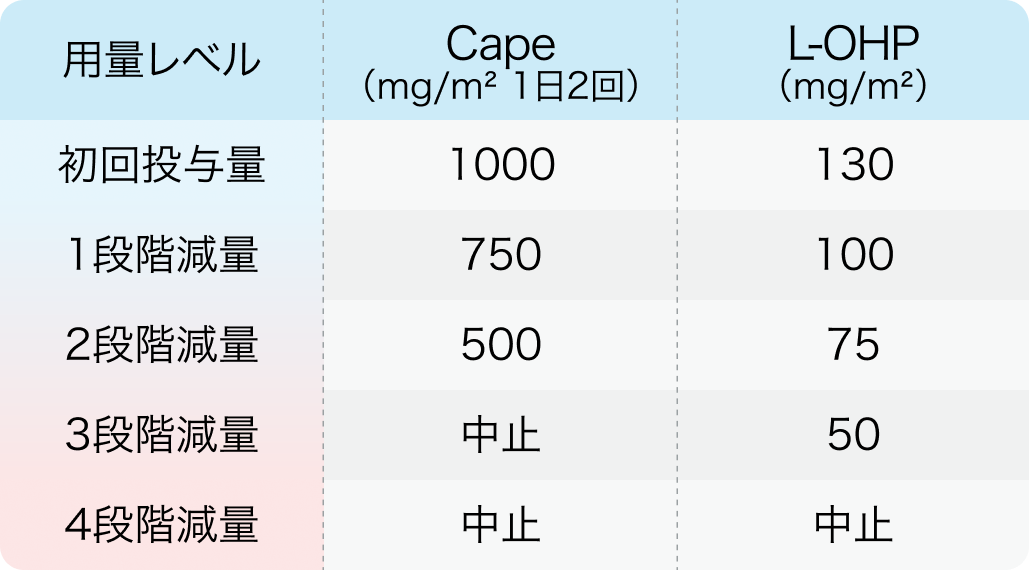
KEYNOTE-811試験³⁾のプロトコルを基に編集部作成
腎障害患者に対する用量調整
▼カペシタビン⁴⁾
- CrCl 30–50mL/min : 75%用量に減量
- CrCl<30mL/min : 禁忌
▼オキサリプラチン⁴⁾
- CrCl<30mL/min : 初期投与量が85mg/m²の場合は、 65mg/m²への減量で投与する。 なお、 CrCl≧20mL/minの場合は減量が不要とする報告もある。
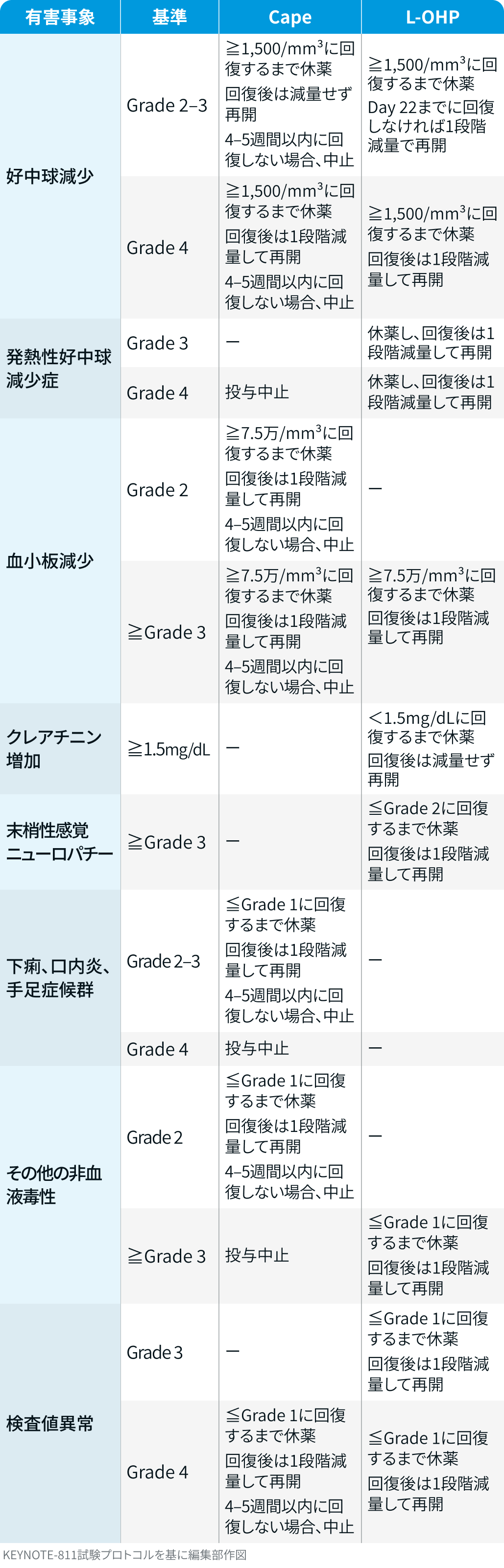
有害事象発現時の対応方法
▼ペムブロリズマブの休薬・中止基準

キイトルーダ®電子添文¹⁾を基に編集部作図
▼トラスツズマブの休薬基準³⁾
- 症候性心不全 : 休薬後、 適切な治療により症状が回復し、 心機能がベースラインまで改善した場合は、 再開を検討できる
- LVEFの低下が16%以上、 または正常下限未満かつベースラインから10%以上の低下 : 休薬し、 休薬基準を満たさなくなった場合は再開可能
▼CAPOXの減量・休薬・中止基準³⁾
レジメンの特徴と注意点
本レジメンは、 HER2陽性の治癒切除不能な進行・再発の胃癌または食道胃接合部腺癌患者に対する1次治療として、 ペムブロリズマブをトラスツズマブと化学療法 (FP療法またはCAPOX療法) に上乗せするものである。
PD-L1発現と効果
KEYNOTE-811試験³⁾のサブグループ解析では、 PD-L1 CPS≧1の患者群でペムブロリズマブの上乗せによるPFS改善効果がより顕著であった。
一方、 CPS<1の患者群では明確な上乗せ効果は示されなかった。 この結果を踏まえ、 キイトルーダ®添付文書では、 HER2陽性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、 PD-L1の発現 (CPS) を確認し、 CPSについて臨床試験の成績を熟知した上で適応患者を選択するよう注意喚起されている。
キイトルーダ®の胃癌・最適使用推進ガイドラインでは、 PD-L1陽性 (CPS≧1) が確認されていないHER2陽性胃癌患者への投与は本剤の有効性が確立されておらず、 投与対象とならないとされている。
レジメン適用時の注意事項
- PD-L1検査 (CPS) を実施し、 その結果と臨床試験の成績を十分に理解した上で適応を判断する
- 免疫関連有害事象の発現に注意し、 早期発見と適切な対応を行う
- トラスツズマブには心機能障害のリスクがあるため、 投与開始前および投与中は定期的に心機能検査を行う
KEYNOTE-811試験³⁾では、 ベースライン、 3サイクル目、 5サイクル目、 9サイクル目以降は4サイクルごとに心機能の評価が実施された。
RMP【重要な特定されたリスク】
キイトルーダ® 医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 大腸炎・小腸炎・重度の下痢
- 劇症肝炎・肝不全・肝機能障害・肝炎・硬化性胆管炎
- 腎機能障害 (尿細管間質性腎炎、 糸球体腎炎等)
- 内分泌障害 (下垂体機能障害、 甲状腺機能障害、 副腎機能障害)
- 1型糖尿病
- ぶどう膜炎
- 筋炎・横紋筋融解症
- 膵炎・膵外分泌機能不全
- 神経障害 (ギラン・バレー症候群等)
- 重度の皮膚障害 (中毒性表皮壊死融解症、 皮膚粘膜眼症候群、 多形紅斑、 類天疱瘡等)
- 脳炎、 髄膜炎、 脊髄炎
- 重症筋無力症
- 心筋炎
- 重篤な血液障害 (免疫性血小板減少性紫斑病、 溶血性貧血、 赤芽球癆、 無顆粒球症等)
- 重度の胃炎
- 血球貪食症候群
- Infusion reaction
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者への使用
- 結核
コンパニオン診断薬の情報⁵⁾
本レジメンを適用する場合、 PD-L1の発現 (CPS) を確認する必要がある。 適応判定に利用可能なコンパニオン診断薬は以下のとおり。
PD-L1検査
- PD-L1 IHC 22C3 pharmDx 「ダコ」
出典
- キイトルーダ®点滴静注100mg 電子添文 (2025年5月改訂 第24版) [最終閲覧 : 2025/5/23]
- キイトルーダ®点滴静注100mg 適正使用ガイド (2025年5月作成) [最終閲覧 : 2025/5/23]
- Lancet. 2023;402(10418):2197-2208.
- がん薬物療法時の腎障害診療ガイドライン2022
- 医薬品の適応判定を目的として承認された体外診断用医薬品又は医療機器の情報 (2025年5月14日版) [最終閲覧 : 2025/6/19]
最終更新日 : 2025年5月26日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修 : HOKUTO編集部監修医師
Pembrolizumab+T-mab+CAPOX
Pembrolizumab:Pembrolizumab(キイトルーダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg 点滴 | 1~35 | Day 1 |
T-mab:Trastuzumab(ハーセプチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 初回8mg/kg、以降6mg/kg 点滴 | 1~ | Day 1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 130mg/m² 点滴 | 1~6または8 | Day 1 |
Cape:Capecitabine(ゼローダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1000mg/m² 1日2回 内服 | 1~ | Day 1~14 |
前投薬
| トラスツズマブによるinfusion reactionの発現回避を目的とした前投薬の有用性は確認されていない。 |
その他
| 1コース21日間 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
2025年5月21日、 添付文書が改訂され、 PD-L1陽性が確認されたHER2陽性の治癒切除不能な進行・再発の胃癌患者の1次療法として投与可能となった。
薬剤情報
- キイトルーダ® (添付文書¹⁾ / 適正使用情報²⁾*)
*MSD製薬の外部サイトへ遷移します
- ハーセプチン® (添付文書)
- ゼローダ® (添付文書)
- エルプラット® (添付文書)
投与スケジュール
治癒切除不能な進行・再発の胃癌
【1コース】3週間
【催吐性】中等度
【FN発症】未報告

キイトルーダ®適正使用ガイド²⁾を基に編集部作図
KEYNOTE-811試験³⁾の投与スケジュール
ペムブロリズマブ : 200mgを3週ごとに、 各サイクル1日目に30分かけて投与
トラスツズマブ : 初回8mg/kg、 以降は6mg/kgを3週ごとに、 各サイクル1日目に投与
L-OHP : 130mg/m²を3週ごとに、 各サイクル1日目に2時間かけて投与 (最大6~8コースまでとすることも可能)
Cape : 1,000 mg/m²を1日2回、 各サイクル1~14日目に3週ごとで投与
ペムブロリズマブは最大35サイクル (約2年間) まで投与され、 トラスツズマブおよびCapeは、 医師の判断により35サイクル後も最大1年間の延長投与が可能とされた。
Key Data|臨床試験結果
📊 KEYNOTE-811試験³⁾
未治療・HER2陽性の局所進行切除不能または転移性胃腺癌/食道胃接合部腺癌698例を対象に実施された、 国際共同無作為化第III相二重盲検プラセボ対照試験である。 ペムブロリズマブ+トラスツズマブ+化学療法群 (ペムブロリズマブ群) と、 プラセボ+トラスツズマブ+化学療法群 (プラセボ群) に1:1の比率で無作為に割り付け、 主要評価項目としてPFSおよびOSが設定された。 化学療法は、 5-FU+シスプラチン (FP療法) またはカペシタビン+オキサリプラチン (CAPOX療法) から選択された。 なお、 日本においてはSOX療法コホートとして全40例が組み入れられた。
【有効性】ペムブロリズマブ群 (vs プラセボ群)
本データは3回目の中間解析時点のものであり、 SOX療法のコホートは解析対象に含まれていない。
- PFS中央値 : 10.0ヵ月 (vs 8.1ヵ月)
- 全集団 : HR 0.72、 95%CI 0.61–0.87
- CPS≧1 : HR 0.71、 95%CI 0.59–0.86
- CPS<1 : HR 1.03、 95%CI 0.65–1.64
- OS中央値 : 20.0ヵ月 (vs 16.8ヵ月)
- 全集団 : HR 0.84、 95%CI 0.70–1.01
- CPS≧1 : HR 0.81、 95%CI 0.67–0.98
独立データモニタリング委員会は、 OSの事前規定された最終解析まで試験を継続するよう勧告
- 客観的奏効率 : 72.6% (vs 59.8%)
- 奏効期間中央値: 11.3ヵ月 (vs 9.5%)
【安全性】主な有害事象 : 全Grade (≧Grade3)
複数の化学療法レジメン (FP、 CAPOX、 SOX) を含む集計
- 下痢 47% (9%)
- 悪心 44% (4%)
- 貧血 31% (6%)
- 好中球数減少 26% (8%)
- 食欲減退 26% (3%)
- 血小板数減少 25% (6%)
- 嘔吐 25% (4%)
- 末梢性感覚ニューロパチー 24% (4%)
- 手掌・足底発赤知覚不全症候群 22% (1%)
- 疲労 20% (3%)
- AST増加 19% (2%)
- 末梢性ニューロパチー 17% (2%)
- 好中球減少症 17% (6%)
- 白血球数減少 15% (1%)
- ALT増加 15% (1%)
- 体重減少 12% (1%)
- Infusion reaction 16% (3%)
- 血小板減少症 11% (3%)
- 無力症 11% (2%)
- 血中ビリルビン増加 11% (1%)
- 口内炎 10% (1%)
主な免疫関連有害事象
- 甲状腺機能低下症 11% (<1%)
- 肺臓炎 6% (2%)
- 大腸炎 5% (3%)
- 甲状腺機能亢進症 4% (0%)
各プロトコル
適格基準
KEYNOTE-811試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球数 ≧1,500/μL
- 血小板数 ≧100,000/μL
- ヘモグロビン値 ≧9.0g/dL
- クレアチニン ≦1.5 × ULN または CrCl ≧60 mL/min (クレアチニン >1.5 × ULN の場合)
- 総ビリルビン ≦1.5 × ULN (総ビリルビン >1.5 × ULN の場合は直接ビリルビン ≦ULN)
- AST/ALT ≦2.5 × ULN (肝転移例は ≦5 × ULN)
- LVEF ≧55%
用量レベル
ペムブロリズマブおよびトラスツズマブの減量は行わない。

KEYNOTE-811試験³⁾のプロトコルを基に編集部作成
腎障害患者に対する用量調整
▼カペシタビン⁴⁾
- CrCl 30–50mL/min : 75%用量に減量
- CrCl<30mL/min : 禁忌
▼オキサリプラチン⁴⁾
- CrCl<30mL/min : 初期投与量が85mg/m²の場合は、 65mg/m²への減量で投与する。 なお、 CrCl≧20mL/minの場合は減量が不要とする報告もある。
有害事象発現時の対応方法
▼ペムブロリズマブの休薬・中止基準

キイトルーダ®電子添文¹⁾を基に編集部作図
▼トラスツズマブの休薬基準³⁾
- 症候性心不全 : 休薬後、 適切な治療により症状が回復し、 心機能がベースラインまで改善した場合は、 再開を検討できる
- LVEFの低下が16%以上、 または正常下限未満かつベースラインから10%以上の低下 : 休薬し、 休薬基準を満たさなくなった場合は再開可能
▼CAPOXの減量・休薬・中止基準³⁾

レジメンの特徴と注意点
本レジメンは、 HER2陽性の治癒切除不能な進行・再発の胃癌または食道胃接合部腺癌患者に対する1次治療として、 ペムブロリズマブをトラスツズマブと化学療法 (FP療法またはCAPOX療法) に上乗せするものである。
PD-L1発現と効果
KEYNOTE-811試験³⁾のサブグループ解析では、 PD-L1 CPS≧1の患者群でペムブロリズマブの上乗せによるPFS改善効果がより顕著であった。
一方、 CPS<1の患者群では明確な上乗せ効果は示されなかった。 この結果を踏まえ、 キイトルーダ®添付文書では、 HER2陽性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、 PD-L1の発現 (CPS) を確認し、 CPSについて臨床試験の成績を熟知した上で適応患者を選択するよう注意喚起されている。
キイトルーダ®の胃癌・最適使用推進ガイドラインでは、 PD-L1陽性 (CPS≧1) が確認されていないHER2陽性胃癌患者への投与は本剤の有効性が確立されておらず、 投与対象とならないとされている。
レジメン適用時の注意事項
- PD-L1検査 (CPS) を実施し、 その結果と臨床試験の成績を十分に理解した上で適応を判断する
- 免疫関連有害事象の発現に注意し、 早期発見と適切な対応を行う
- トラスツズマブには心機能障害のリスクがあるため、 投与開始前および投与中は定期的に心機能検査を行う
KEYNOTE-811試験³⁾では、 ベースライン、 3サイクル目、 5サイクル目、 9サイクル目以降は4サイクルごとに心機能の評価が実施された。
RMP【重要な特定されたリスク】
キイトルーダ® 医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 大腸炎・小腸炎・重度の下痢
- 劇症肝炎・肝不全・肝機能障害・肝炎・硬化性胆管炎
- 腎機能障害 (尿細管間質性腎炎、 糸球体腎炎等)
- 内分泌障害 (下垂体機能障害、 甲状腺機能障害、 副腎機能障害)
- 1型糖尿病
- ぶどう膜炎
- 筋炎・横紋筋融解症
- 膵炎・膵外分泌機能不全
- 神経障害 (ギラン・バレー症候群等)
- 重度の皮膚障害 (中毒性表皮壊死融解症、 皮膚粘膜眼症候群、 多形紅斑、 類天疱瘡等)
- 脳炎、 髄膜炎、 脊髄炎
- 重症筋無力症
- 心筋炎
- 重篤な血液障害 (免疫性血小板減少性紫斑病、 溶血性貧血、 赤芽球癆、 無顆粒球症等)
- 重度の胃炎
- 血球貪食症候群
- Infusion reaction
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者への使用
- 結核
コンパニオン診断薬の情報⁵⁾
本レジメンを適用する場合、 PD-L1の発現 (CPS) を確認する必要がある。 適応判定に利用可能なコンパニオン診断薬は以下のとおり。
PD-L1検査
- PD-L1 IHC 22C3 pharmDx 「ダコ」
出典
- キイトルーダ®点滴静注100mg 電子添文 (2025年5月改訂 第24版) [最終閲覧 : 2025/5/23]
- キイトルーダ®点滴静注100mg 適正使用ガイド (2025年5月作成) [最終閲覧 : 2025/5/23]
- Lancet. 2023;402(10418):2197-2208.
- がん薬物療法時の腎障害診療ガイドライン2022
- 医薬品の適応判定を目的として承認された体外診断用医薬品又は医療機器の情報 (2025年5月14日版) [最終閲覧 : 2025/6/19]
最終更新日 : 2025年5月26日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。





