UFT+LV
テガフール・ウラシル (ユーエフティ®) +ホリナートカルシウム (ユーゼル®)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ユーエフティ® (テガフール・ウラシル : UFT)
*大鵬薬品工業株式会社の外部サイトへ遷移します
ユーゼル® (ホリナートカルシウム : LV)
投与スケジュール
【1コース】 35日間
【催吐性】軽度
【FN発症】 低リスク*
*NSABP C-06試験のFN発生率0.6%を基に編集部が分類
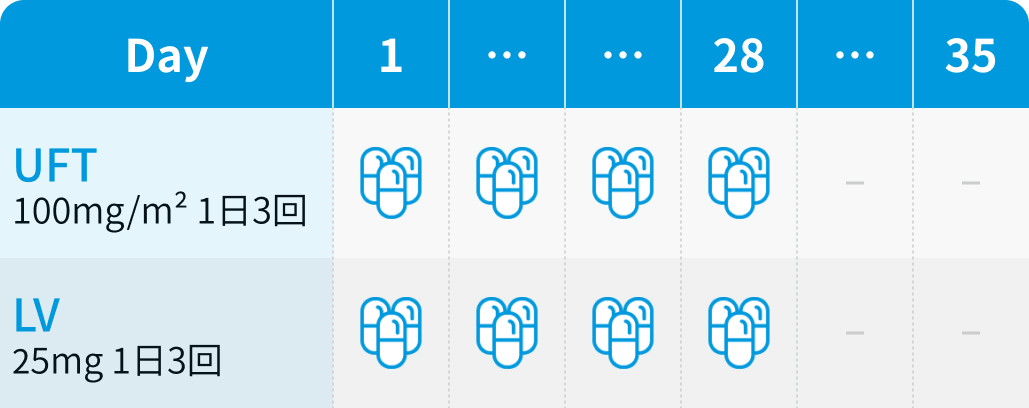
1サイクル5週間として、 4週間投与+1週間休薬を計5サイクル施行する³⁾。
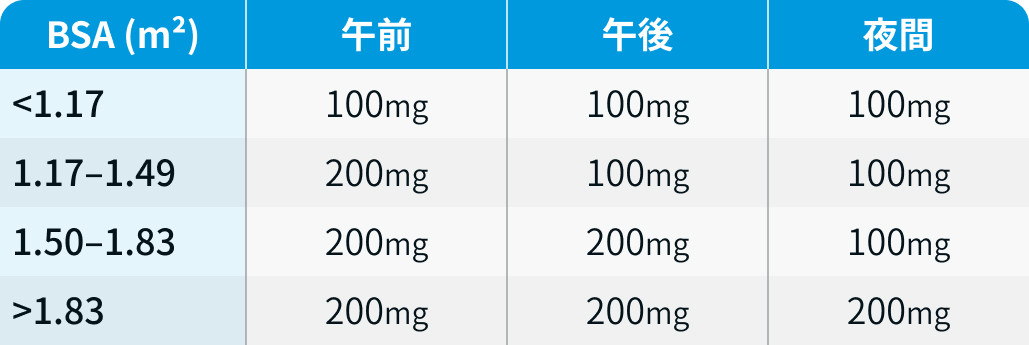
UFT : 下表を参考に、 300mg/m²/日を1日3回 (約8時間ごと)、 食前後1時間を避けて内服
LV : 75mg/日を1日3回、 UFTと同時に内服
Key Data|臨床試験結果
📊 NSABP C-06試験
J Clin Oncol. 2006;24(13):2059-64.
ステージII–III結腸癌1,608例を対象に、 経口UFT+LV群と静脈内FU+LV群を比較した第III相無作為化同等性試験 (OSのHR 1.232未満を同等性マージンと設定)。 主要評価項目はDFSおよびOSとされた。
【有効性】 UFT+LV群 (vs FU+LV群)
- 5年OS率 78.5% (vs 78.7%)
ステージII患者 : 88.4% (vs 87.0%)
ステージIII患者 : 69.6% (vs 71.5%)
- HR 1.01 (95%CI 0.83–1.25)
- 5年DFS率 67.0% (vs 68.2%)
- HR 1.00 (95%CI 0.85–1.19)
【安全性】 主な有害事象 : 全Grade (Grade≧3)
- 下痢 74.8% (29.4%)
- 悪心 54.3% (7.1%)
- 嘔吐 27.6% (4.3%)
- 口内炎 26.4% (1.3%)
- 皮膚障害 21.5% (1.3%)
- 脱毛 15.0% (0.0%)
- 感染症 9.2% (1.6%)
- 発熱 8.8% (0.1%)
- 白血球減少 16.8% (0.0%)
- 顆粒球減少 20.2% (1.3%)
各プロトコル
適格基準
NSABP C-06試験³⁾の主な適格基準
- ECOG PS 0–2
- 白血球≧4000/μL
- 血小板≧10万/μL
- クレアチニン、 ビリルビン、 AST/ALT : 正常
用量レベル
UFTの用量レベルは下記のとおりとし、 LVは減量しない。

「ユーエフティⓇ/ユーゼルⓇ適正使用ミニガイド」²⁾を基に編集部作成
有害事象発現時の減量・休薬・中止基準
有害事象時にUFTを減量または休薬する基準は下記のとおり (処置欄には休薬時の対応を示す)。
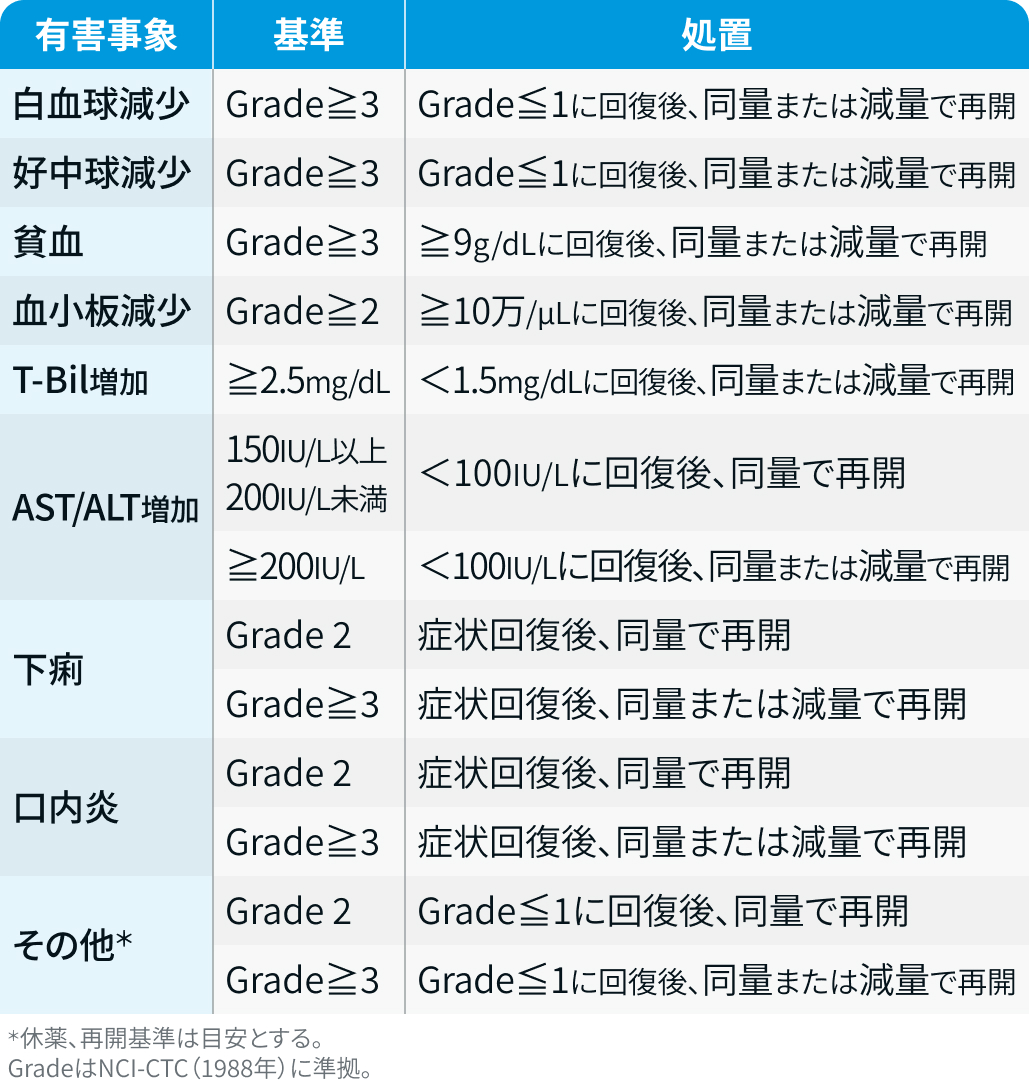
「ユーエフティⓇ/ユーゼルⓇ適正使用ミニガイド」²⁾を基に編集部作成
レジメンの特徴と注意点
本レジメンの位置付け
Stage IIIおよび高リスクStage II大腸癌に対する術後補助化学療法の一つで、 投与期間は原則6ヵ月。 術後8週頃までの開始が望ましい。
作用機序の特徴
UFTの抗腫瘍効果は、 体内でテガフールが徐々に5-FUへ変換されることに基づく。 含有するウラシルは5-FUの分解を抑制し、 腫瘍内で5-FUとその活性代謝物を高濃度に維持することで抗腫瘍効果を増強すると考えられている。
レジメン適用時の注意事項
重篤な下痢・腸炎 : 患者の状態を十分に観察し、 激しい腹痛や下痢が出現した場合は直ちに投与を中止し、 適切に対応する。
劇症肝炎・骨髄抑制 : 定期的 (特に投与開始から2ヵ月間は月1回以上) に肝機能・血液検査を行い、 患者の状態を十分に観察する。
出典
1) 大鵬薬品工業株式会社. ユーエフティ®添付文書 2025年1月作成 第2版
2) 大鵬薬品工業株式会社. ユーエフティⓇ/ユーゼルⓇ適正使用ミニガイド
3) J Clin Oncol. 2006;24(13):2059-64.
最終更新 : 2025年11月25日
執筆 : ウエルシア薬局 上島未友紀
監修医師 : HOKUTO編集部監修医師
UFT+LV
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ユーエフティ® (テガフール・ウラシル : UFT)
*大鵬薬品工業株式会社の外部サイトへ遷移します
ユーゼル® (ホリナートカルシウム : LV)
投与スケジュール
【1コース】 35日間
【催吐性】軽度
【FN発症】 低リスク*
*NSABP C-06試験のFN発生率0.6%を基に編集部が分類

1サイクル5週間として、 4週間投与+1週間休薬を計5サイクル施行する³⁾。
UFT : 下表を参考に、 300mg/m²/日を1日3回 (約8時間ごと)、 食前後1時間を避けて内服

LV : 75mg/日を1日3回、 UFTと同時に内服
Key Data|臨床試験結果
📊 NSABP C-06試験
J Clin Oncol. 2006;24(13):2059-64.
ステージII–III結腸癌1,608例を対象に、 経口UFT+LV群と静脈内FU+LV群を比較した第III相無作為化同等性試験 (OSのHR 1.232未満を同等性マージンと設定)。 主要評価項目はDFSおよびOSとされた。
【有効性】 UFT+LV群 (vs FU+LV群)
- 5年OS率 78.5% (vs 78.7%)
ステージII患者 : 88.4% (vs 87.0%)
ステージIII患者 : 69.6% (vs 71.5%)
- HR 1.01 (95%CI 0.83–1.25)
- 5年DFS率 67.0% (vs 68.2%)
- HR 1.00 (95%CI 0.85–1.19)
【安全性】 主な有害事象 : 全Grade (Grade≧3)
- 下痢 74.8% (29.4%)
- 悪心 54.3% (7.1%)
- 嘔吐 27.6% (4.3%)
- 口内炎 26.4% (1.3%)
- 皮膚障害 21.5% (1.3%)
- 脱毛 15.0% (0.0%)
- 感染症 9.2% (1.6%)
- 発熱 8.8% (0.1%)
- 白血球減少 16.8% (0.0%)
- 顆粒球減少 20.2% (1.3%)
各プロトコル
適格基準
NSABP C-06試験³⁾の主な適格基準
- ECOG PS 0–2
- 白血球≧4000/μL
- 血小板≧10万/μL
- クレアチニン、 ビリルビン、 AST/ALT : 正常
用量レベル
UFTの用量レベルは下記のとおりとし、 LVは減量しない。

「ユーエフティⓇ/ユーゼルⓇ適正使用ミニガイド」²⁾を基に編集部作成
有害事象発現時の減量・休薬・中止基準
有害事象時にUFTを減量または休薬する基準は下記のとおり (処置欄には休薬時の対応を示す)。

「ユーエフティⓇ/ユーゼルⓇ適正使用ミニガイド」²⁾を基に編集部作成
レジメンの特徴と注意点
本レジメンの位置付け
Stage IIIおよび高リスクStage II大腸癌に対する術後補助化学療法の一つで、 投与期間は原則6ヵ月。 術後8週頃までの開始が望ましい。
作用機序の特徴
UFTの抗腫瘍効果は、 体内でテガフールが徐々に5-FUへ変換されることに基づく。 含有するウラシルは5-FUの分解を抑制し、 腫瘍内で5-FUとその活性代謝物を高濃度に維持することで抗腫瘍効果を増強すると考えられている。
レジメン適用時の注意事項
重篤な下痢・腸炎 : 患者の状態を十分に観察し、 激しい腹痛や下痢が出現した場合は直ちに投与を中止し、 適切に対応する。
劇症肝炎・骨髄抑制 : 定期的 (特に投与開始から2ヵ月間は月1回以上) に肝機能・血液検査を行い、 患者の状態を十分に観察する。
出典
1) 大鵬薬品工業株式会社. ユーエフティ®添付文書 2025年1月作成 第2版
2) 大鵬薬品工業株式会社. ユーエフティⓇ/ユーゼルⓇ適正使用ミニガイド
3) J Clin Oncol. 2006;24(13):2059-64.
最終更新 : 2025年11月25日
執筆 : ウエルシア薬局 上島未友紀
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




