adj. Nivo
Nivo (オプジーボ®)
治療スケジュール
概要
監修医師
Nivo:Nivolumab(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 240mg/body 点滴 (2週間間隔) | 1~ | Day1 |
| 480mg/body 点滴 (4週間間隔) | 1~ | Day1 |
前投薬
| infusion reactionが生じた場合、 ステロイドや抗ヒスタミンなどを考慮する。 |
その他
adj. Nivoの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
2週間間隔
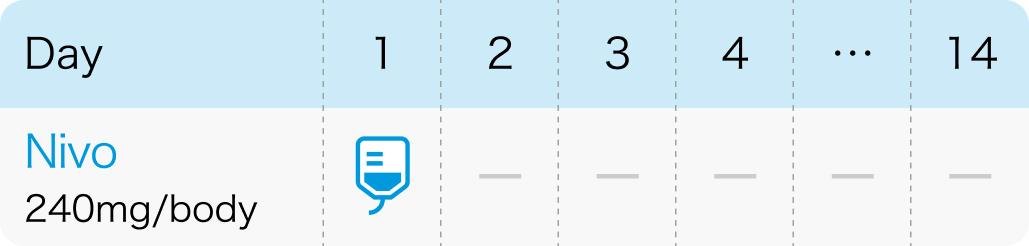
オプジーボ®電子添文 (2024年2月改訂第20版)¹⁾より作図
4週間間隔
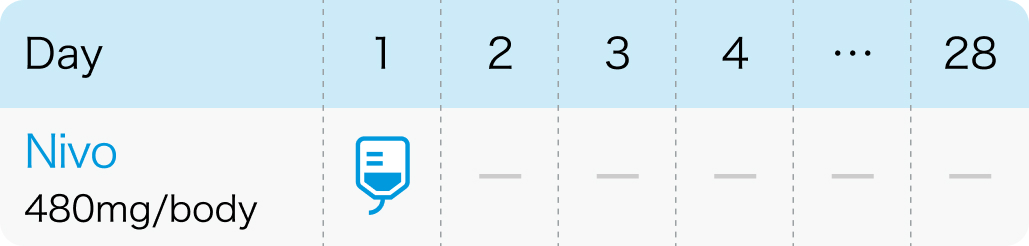
オプジーボ®電子添文 (2024年2月改訂第20版)¹⁾より作図
投与期間は最大12ヵ月
前投薬
infusion reactionが生じた場合、 ステロイドや抗ヒスタミンなどを考慮する。
執筆:神奈川県立がんセンター消化器内科 古田 光寛先生
投与開始基準
CheckMate 577試験³⁾のプロトコル
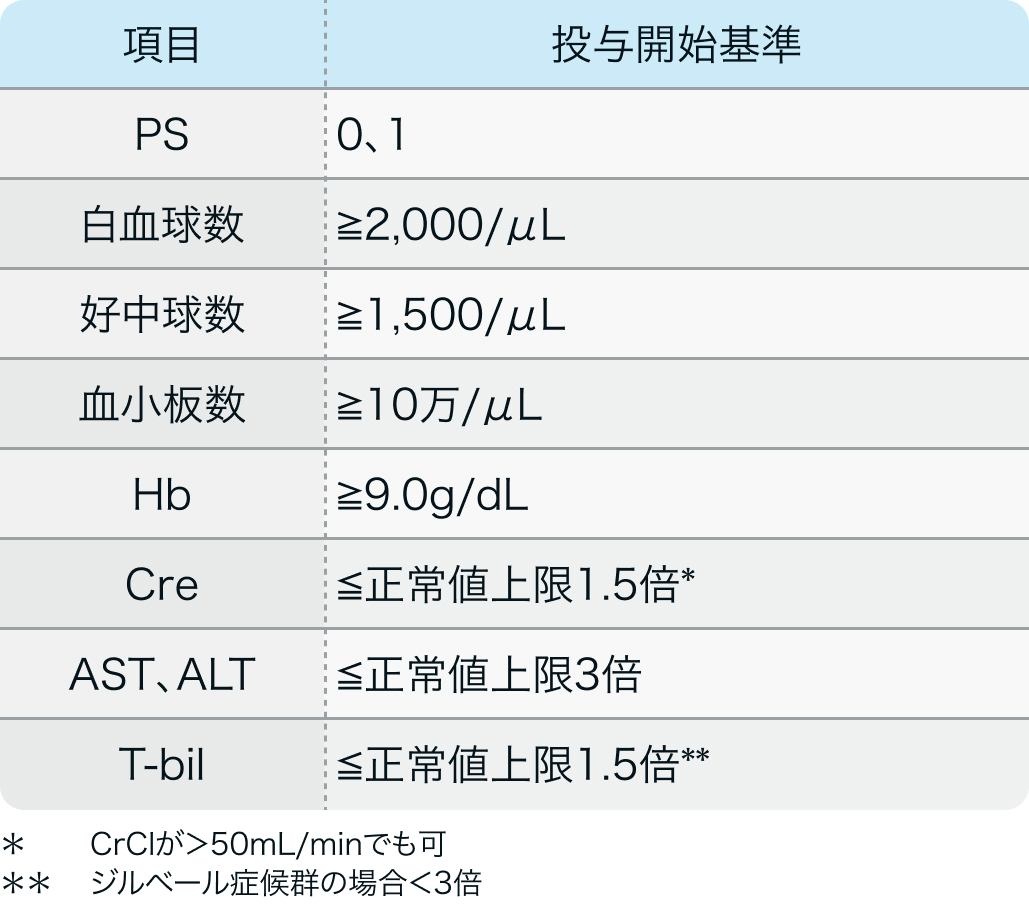
N Engl J Med. 2021 Apr 1;384(13):1191-1203³⁾より引用
主な有害事象
CheckMate 577試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 16.9% (1.1%)
- 下痢 16.5% (0.4%)
- 甲状腺機能低下症 9.4% (0%)
- 悪心 8.8% (0%)
- 甲状腺機能亢進症 6.6% (0%)
- AST増加 5.5% (0.4%)
- 食欲減退 4.9% (0%)
N Engl J Med. 2021 Apr 1;384(13):1191-1203³⁾より引用
上手に使うためのワンポイント
- 本レジメンの根拠となったCheckMate 577試験³⁾では、 術前CRT後、 病理学的CRとならなかった症例が対象となった。 厳密には術前化学療法後のAdj. Nivoに関しては明確なエビデンスはなく症例に合わせて行われているのが実情である。
- 術前化学療法後のAdj. Nivo、 AdjS-1、 無治療との3群を比較したJCOG2206試験が行われており同試験の結果が待たれる。
- 自己免疫性疾患を有し10mgを超えるプレドニゾロンを内服している症例や免疫調整剤を服用している症例は自己免疫性疾患増悪のリスクがあるため避けるべきである。
執筆:神奈川県立がんセンター消化器内科 古田 光寛先生
特徴と注意点
- irAEに注意が必要であり、 定期的な甲状腺機能や血糖などの内分泌機能、 肝障害、 腎障害のチェック、 SPO₂の測定が必要である。 irAEを来した場合、 甲状腺機能低下症や副腎皮質機能低下症などのホルモン補充で対処可能な内分泌障害は治療継続可能であるが、 それ以外では治療を中断しプレドニゾロンによる治療を要する。 irAE後のNivoの再開についてはリスク、 ベネフィットを考慮し慎重に検討する。
- ホルモン補充で対処可能な内分泌障害以外の≧Grade3のirAEに関しては再投与を控える。 肺臓炎に関しては≧Grade2で再投与を控える。
- 食道癌では喫煙歴のある症例が多いためしばしば肺に間質影を伴う症例を経験する。 CT画像で肺底部に間質影が存在しないか注意深く観察する必要がある。
執筆:神奈川県立がんセンター消化器内科 古田 光寛先生
関連する臨床試験|CheckMate 577試験³⁾
術前化学放射線療法および完全切除後に病理学的残存病変を認めたStageII~IIIの食道/食道胃接合部癌患者において、 術後療法における抗PD-1抗体ニボルマブの効果を、 プラセボを対照に検証した第Ⅲ相二重盲検ランダム化比較試験CheckMate 577の結果より、 無病生存期間 (DFS) に対する有効性が示された。
追跡期間中央値
24.4ヵ月
DFS中央値
- ニボルマブ群 : 22.4ヵ月
(95%CI 16.6-34.0ヵ月)
- プラセボ群 : 11.0ヵ月
(95%CI 8.3-14.3ヵ月)
HR 0.69 (96.4%CI 0.56-0.86)、 p<0.001
DFSのサブグループ解析
腫瘍のPD-L1発現量に関わらず、 HRはニボルマブ群が有利であった。
DMFS中央値
- ニボルマブ群 : 28.3ヵ月
(95%CI 21.3ヵ月-NE)
- プラセボ群 : 17.6ヵ月
(95%CI 12.5-25.4ヵ月)
HR 0.74 (95%CI 0.60-0.92)
患者報告アウトカム
- FACT-E総スコア、 EQ-5D-3L視覚アナログスケール、 およびEQ-5D-3Lの健康ユーティリティスコアにおいて、 最小二乗平均スコアの差を比較
- 53週目までのほぼ全ての時点において、 ニボルマブ群およびプラセボ群の両群でベースラインから同様の改善が示された。
出典
- 小野薬品工業株式会社. オプジーボ®電子添文 (2024年2月改訂第20版) [最終閲覧 : 2024/03/07]
- 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/03/07]
- Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. N Engl J Med. 2021 Apr 1;384(13):1191-1203. PMID: 33789008
最終更新日 : 2024年8月21日
執筆医:神奈川県立がんセンター消化器内科 古田 光寛先生
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
adj. Nivoの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
adj. Nivo
Nivo (オプジーボ®)
2024年08月26日更新
Nivo:Nivolumab(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 240mg/body 点滴 (2週間間隔) | 1~ | Day1 |
| 480mg/body 点滴 (4週間間隔) | 1~ | Day1 |
前投薬
| infusion reactionが生じた場合、 ステロイドや抗ヒスタミンなどを考慮する。 |
その他
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
2週間間隔

オプジーボ®電子添文 (2024年2月改訂第20版)¹⁾より作図
4週間間隔

オプジーボ®電子添文 (2024年2月改訂第20版)¹⁾より作図
投与期間は最大12ヵ月
前投薬
infusion reactionが生じた場合、 ステロイドや抗ヒスタミンなどを考慮する。
執筆:神奈川県立がんセンター消化器内科 古田 光寛先生
投与開始基準
CheckMate 577試験³⁾のプロトコル

N Engl J Med. 2021 Apr 1;384(13):1191-1203³⁾より引用
主な有害事象
CheckMate 577試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 16.9% (1.1%)
- 下痢 16.5% (0.4%)
- 甲状腺機能低下症 9.4% (0%)
- 悪心 8.8% (0%)
- 甲状腺機能亢進症 6.6% (0%)
- AST増加 5.5% (0.4%)
- 食欲減退 4.9% (0%)
N Engl J Med. 2021 Apr 1;384(13):1191-1203³⁾より引用
上手に使うためのワンポイント
- 本レジメンの根拠となったCheckMate 577試験³⁾では、 術前CRT後、 病理学的CRとならなかった症例が対象となった。 厳密には術前化学療法後のAdj. Nivoに関しては明確なエビデンスはなく症例に合わせて行われているのが実情である。
- 術前化学療法後のAdj. Nivo、 AdjS-1、 無治療との3群を比較したJCOG2206試験が行われており同試験の結果が待たれる。
- 自己免疫性疾患を有し10mgを超えるプレドニゾロンを内服している症例や免疫調整剤を服用している症例は自己免疫性疾患増悪のリスクがあるため避けるべきである。
執筆:神奈川県立がんセンター消化器内科 古田 光寛先生
特徴と注意点
- irAEに注意が必要であり、 定期的な甲状腺機能や血糖などの内分泌機能、 肝障害、 腎障害のチェック、 SPO₂の測定が必要である。 irAEを来した場合、 甲状腺機能低下症や副腎皮質機能低下症などのホルモン補充で対処可能な内分泌障害は治療継続可能であるが、 それ以外では治療を中断しプレドニゾロンによる治療を要する。 irAE後のNivoの再開についてはリスク、 ベネフィットを考慮し慎重に検討する。
- ホルモン補充で対処可能な内分泌障害以外の≧Grade3のirAEに関しては再投与を控える。 肺臓炎に関しては≧Grade2で再投与を控える。
- 食道癌では喫煙歴のある症例が多いためしばしば肺に間質影を伴う症例を経験する。 CT画像で肺底部に間質影が存在しないか注意深く観察する必要がある。
執筆:神奈川県立がんセンター消化器内科 古田 光寛先生
関連する臨床試験|CheckMate 577試験³⁾
術前化学放射線療法および完全切除後に病理学的残存病変を認めたStageII~IIIの食道/食道胃接合部癌患者において、 術後療法における抗PD-1抗体ニボルマブの効果を、 プラセボを対照に検証した第Ⅲ相二重盲検ランダム化比較試験CheckMate 577の結果より、 無病生存期間 (DFS) に対する有効性が示された。
追跡期間中央値
24.4ヵ月
DFS中央値
- ニボルマブ群 : 22.4ヵ月
(95%CI 16.6-34.0ヵ月)
- プラセボ群 : 11.0ヵ月
(95%CI 8.3-14.3ヵ月)
HR 0.69 (96.4%CI 0.56-0.86)、 p<0.001
DFSのサブグループ解析
腫瘍のPD-L1発現量に関わらず、 HRはニボルマブ群が有利であった。
DMFS中央値
- ニボルマブ群 : 28.3ヵ月
(95%CI 21.3ヵ月-NE)
- プラセボ群 : 17.6ヵ月
(95%CI 12.5-25.4ヵ月)
HR 0.74 (95%CI 0.60-0.92)
患者報告アウトカム
- FACT-E総スコア、 EQ-5D-3L視覚アナログスケール、 およびEQ-5D-3Lの健康ユーティリティスコアにおいて、 最小二乗平均スコアの差を比較
- 53週目までのほぼ全ての時点において、 ニボルマブ群およびプラセボ群の両群でベースラインから同様の改善が示された。
出典
- 小野薬品工業株式会社. オプジーボ®電子添文 (2024年2月改訂第20版) [最終閲覧 : 2024/03/07]
- 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/03/07]
- Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. N Engl J Med. 2021 Apr 1;384(13):1191-1203. PMID: 33789008
最終更新日 : 2024年8月21日
執筆医:神奈川県立がんセンター消化器内科 古田 光寛先生
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
adj. Nivoの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。






