FP+Tislelizumab
フルオロウラシル+シスプラチン+チスレリズマブ (テビムブラ®)
「根治切除不能な進行・再発の食道癌」 を対象として、 2025年3月27日に正式承認、 2025年5月21日 薬価収載 (100mg 1瓶 21万4,498円 / 1日 2万428円) となった
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テビムブラ® (チスレリズマブ)
ヒト化抗ヒトPD-1モノクローナル抗体 チスレリズマブ
*ビーワン・メディシンズ合同会社の外部サイトへ遷移します
投与スケジュール
化学療法未治療の根治切除不能な進行・再発の食道癌
【1コース】21日間
【催吐性】 高度催吐性リスク
【FN発症】低リスク*
*RATIONALE-306でFN 1.9%と報告あり²⁾、 低リスクと分類

KeyData|臨床試験結果
RATIONALE-306試験³⁾
Lancet Oncol. 2023;24(5):483-495.
未治療の切除不能・局所進行・再発または転移性の食道扁平上皮癌患者649例 (アジア人486例を含む) を対象とした国際共同の無作為化第III相比較試験。 Tislelizumab+化学療法群とプラセボ+化学療法群に1:1の比率で無作為に割り付け、 主要評価項目として全生存期間 (OS) が設定された。
化学療法には、 プラチナ系薬剤 (シスプラチンまたはオキサリプラチン) とフッ化ピリミジン系薬剤 (フルオロウラシルまたはカペシタビン)、 あるいはパクリタキセルの併用が認められた。
【有効性】Tislelizumab+化学療法群
- OS中央値 : 17.2ヵ月
TAP*スコア別のサブグループ解析 :
PD-L1≧10% : 16.6ヵ月、 <10% : 15.8ヵ月
*TAP (tumor area positivity): VENTANA PD-L1 (SP263) assayを用いて、 細胞膜に染色が認められる腫瘍細胞及び腫瘍関連免疫細胞が占める腫瘍領域 (腫瘍及び線維形成性間質) の割合から算出 (食道癌に対して国内適応外)
- PFS中央値 : 7.3ヵ月
- 奏効率 : 63.5%
- 奏効期間中央値 : 7.1ヵ月
【安全性】主な有害事象 : 全Grade (Grade3~4)
- 貧血 53.4% (14.5%)
- 白血球数減少 44.1% (10.8%)
- 食欲減退 35.8% (2.8%)
- 悪心 34.6% (2.5%)
- 末梢性感覚ニューロパチー 22.5% (3.1%)
- 下痢 19.4% (2.8%)
- 好中球数減少 47.2% (30.6%)
- 嘔吐 17.6% (1.2%)
- 血小板減少 18.5% (2.8%)
- 口内炎 17.9% (4.0%)
- 体重減少 14.2% (0.3%)
- クレアチニン上昇 13.3% (0.3%)
- 便秘 13.0% (0%)
- AST上昇 13.0% (1.5%)
- ALT上昇 12.7% (1.5%)
- 倦怠感 14.8% (4.0%)
- 全身倦怠感 12.7% (1.9%)
- 掻痒 10.5% (0%)
- 無力症 11.4% (1.2%)
- 感覚鈍麻 10.5% (0.3%)
- 甲状腺機能低下症 10.5% (0%)
- 低カリウム血症 12.3% (5.6%)
- 低ナトリウム血症 12.7% (6.8%)
テビムブラ®適正使用ガイド²⁾を基に編集部作成
各プロトコル
適格基準
RATIONALE-306試験³⁾の主な適格基準
- ECOG PS 0–1
- 好中球数 ≧1,500/μL
- 血小板数 ≧10×10⁴/μL
- ヘモグロビン ≧9.0g/dL
- クレアチニン ≦1.5mg/dL
減量・休薬・中止基準
次回投与日までにGrade 0~1まで回復しない副作用が認められた場合は、 以下のとおりFPの減量を行う。 ただし、 5-FUおよびCDDPに個別に設定された休薬基準もあわせて参照すること。
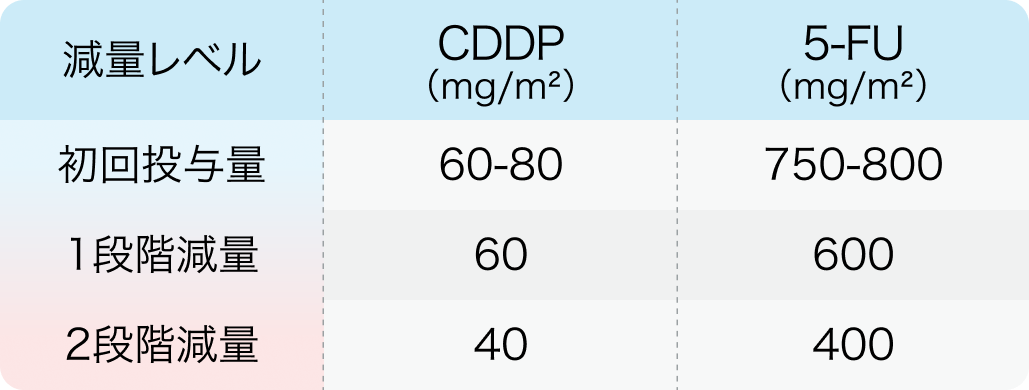
テビムブラ®適正使用ガイド²⁾を基に編集部作成
5ーFU
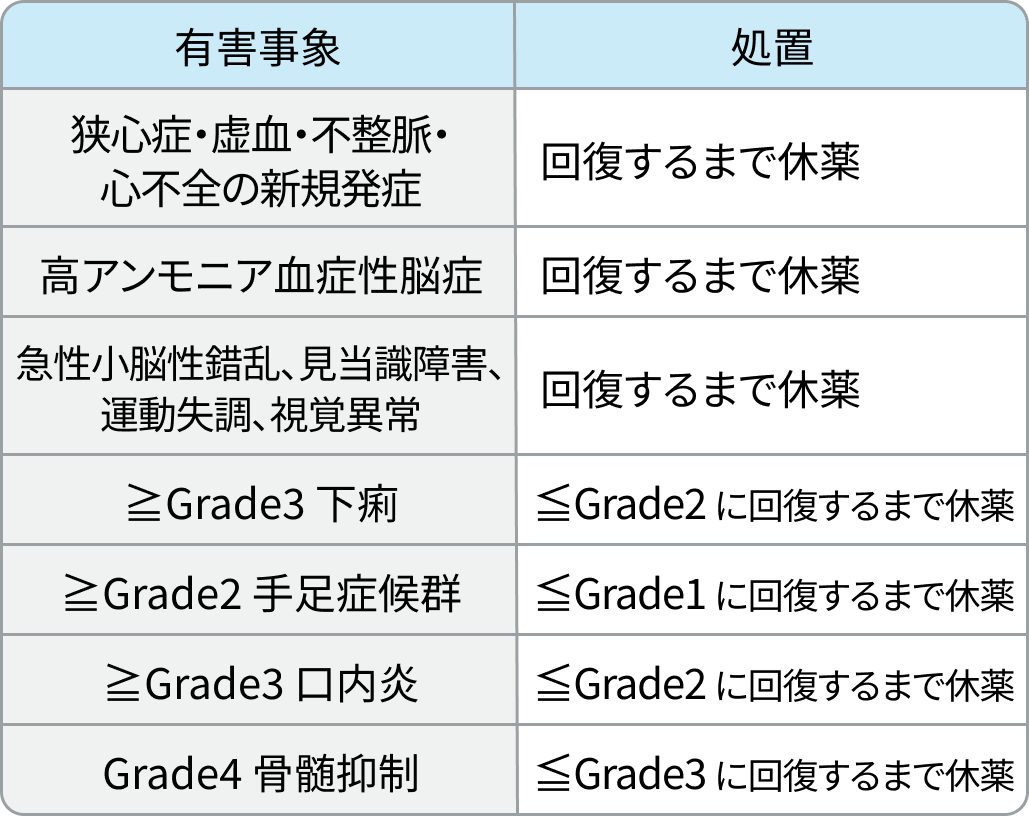
RATIONALE-306試験³⁾のプロトコルに基づき編集部作成
CDDP
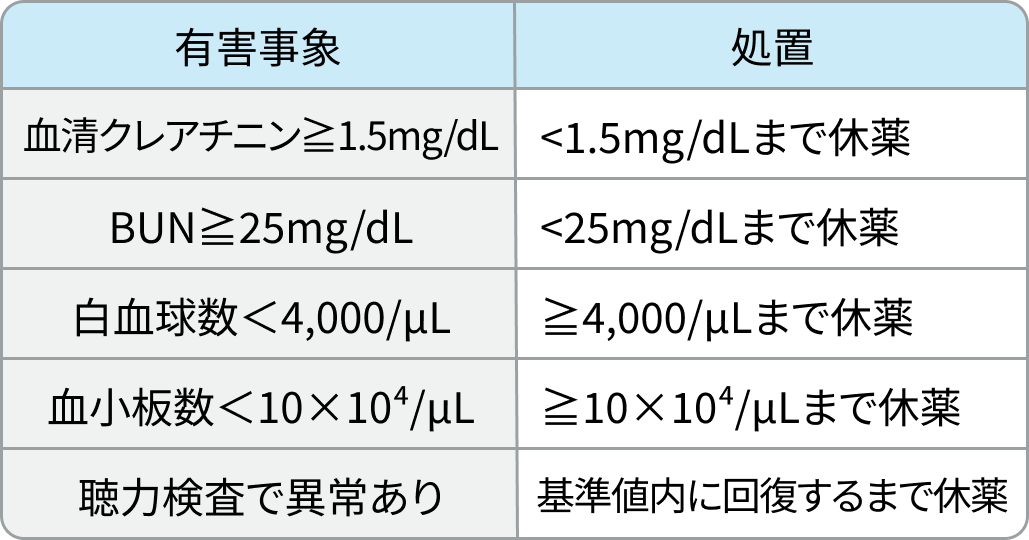
RATIONALE-306試験³⁾のプロトコルに基づき編集部作成
チスレリズマブ
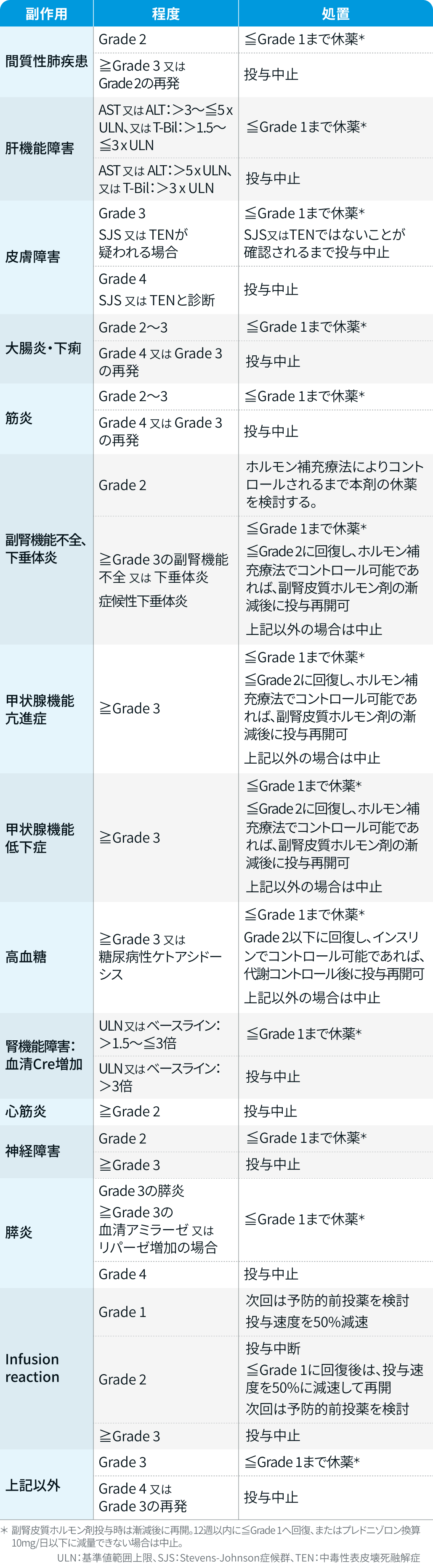
テビムブラ®適正使用ガイド²⁾を基に編集部作成
レジメンの特徴と注意点
作用機序の特徴
チスレリズマブは、 PD-1阻害に加え、 Fc領域改変によりFcγ受容体との結合を最小化し、 T細胞の抗体依存性細胞貪食を抑制することで、 治療抵抗性の一因となるT細胞クリアランスを回避するよう設計されている。
併用化学療法はFPのみ
チスレリズマブは、 シスプラチン+フルオロウラシルとの併用による3週毎投与レジメンとして承認されている。 RATIONALE-306試験で用いられた他の化学療法レジメンとの併用は、 承認対象外である点に注意する。
他ICIとの比較
チスレリズマブに先行して臨床応用されているICI併用化学療法との比較は以下の通りである。
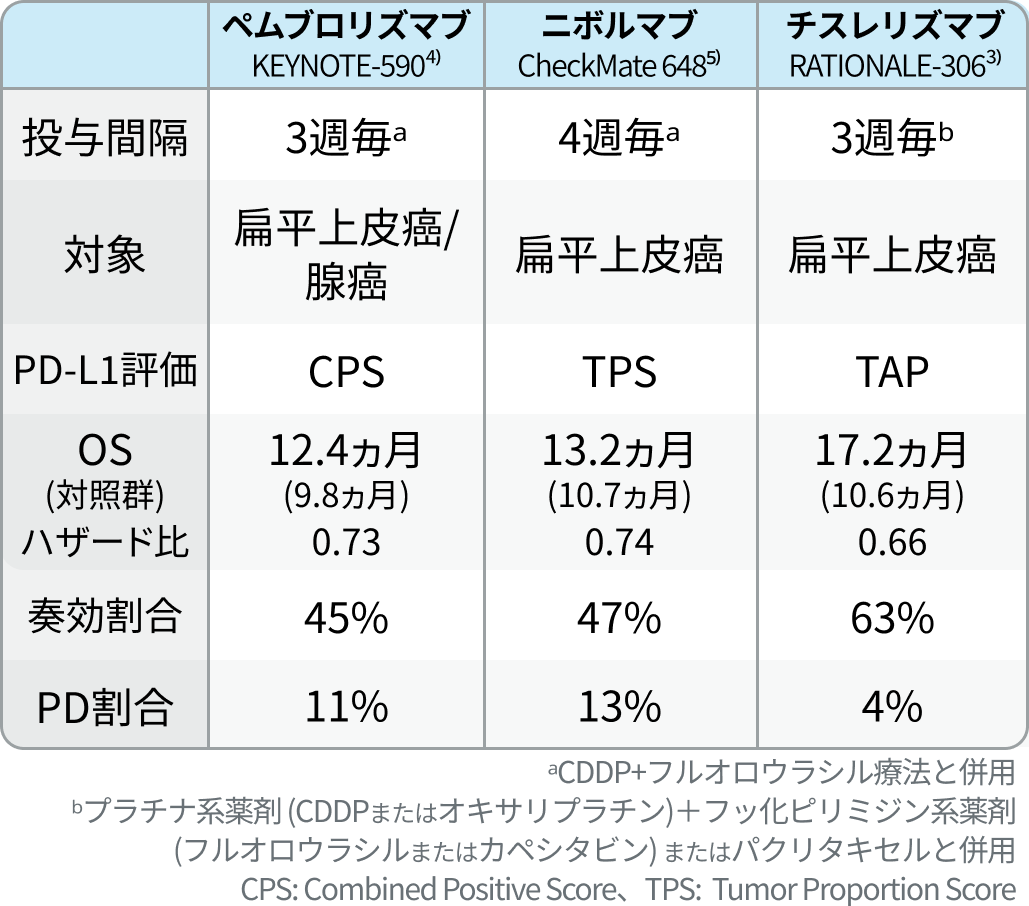
日本食道学会ガイドラインの位置付け
2025年4月14日に発出された、 日本食道学会ガイドライン委員会による速報は以下のとおり。

レジメン適用時の注意事項
- 2025年4月時点で、 SP263抗体によるPD-L1検査 (TAP) は食道癌で保険適応外
- チスレリズマブは初回60分、 忍容性良好なら以降30分で点滴静注
- CDDPによる腎障害予防のための十分な水分負荷と利尿管理を行う
- 水分負荷に対する心機能の耐容性を事前に確認する
- 末梢静脈での5-FU持続投与時は、 血管外漏出に注意する
出典
- ビーワン・メディシンズ合同会社. テビムブラ点滴静注100mg 電子添文 2025年7月作成 (第2版)
- ビーワン・メディシンズ合同会社. テビムブラ点滴静注100mg 適正使用ガイド 2025年6月作成
- Lancet Oncol. 2023;24(5):483-495.
- Lancet. 2021;398(10302):759-771.
- N Engl J Med. 2022;386(5):449-462.
最終更新日 : 2025年7月17日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
FP+Tislelizumab
「根治切除不能な進行・再発の食道癌」 を対象として、 2025年3月27日に正式承認、 2025年5月21日 薬価収載 (100mg 1瓶 21万4,498円 / 1日 2万428円) となった
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テビムブラ® (チスレリズマブ)
ヒト化抗ヒトPD-1モノクローナル抗体 チスレリズマブ
*ビーワン・メディシンズ合同会社の外部サイトへ遷移します
投与スケジュール
化学療法未治療の根治切除不能な進行・再発の食道癌
【1コース】21日間
【催吐性】 高度催吐性リスク
【FN発症】低リスク*
*RATIONALE-306でFN 1.9%と報告あり²⁾、 低リスクと分類

KeyData|臨床試験結果
RATIONALE-306試験³⁾
Lancet Oncol. 2023;24(5):483-495.
未治療の切除不能・局所進行・再発または転移性の食道扁平上皮癌患者649例 (アジア人486例を含む) を対象とした国際共同の無作為化第III相比較試験。 Tislelizumab+化学療法群とプラセボ+化学療法群に1:1の比率で無作為に割り付け、 主要評価項目として全生存期間 (OS) が設定された。
化学療法には、 プラチナ系薬剤 (シスプラチンまたはオキサリプラチン) とフッ化ピリミジン系薬剤 (フルオロウラシルまたはカペシタビン)、 あるいはパクリタキセルの併用が認められた。
【有効性】Tislelizumab+化学療法群
- OS中央値 : 17.2ヵ月
TAP*スコア別のサブグループ解析 :
PD-L1≧10% : 16.6ヵ月、 <10% : 15.8ヵ月
*TAP (tumor area positivity): VENTANA PD-L1 (SP263) assayを用いて、 細胞膜に染色が認められる腫瘍細胞及び腫瘍関連免疫細胞が占める腫瘍領域 (腫瘍及び線維形成性間質) の割合から算出 (食道癌に対して国内適応外)
- PFS中央値 : 7.3ヵ月
- 奏効率 : 63.5%
- 奏効期間中央値 : 7.1ヵ月
【安全性】主な有害事象 : 全Grade (Grade3~4)
- 貧血 53.4% (14.5%)
- 白血球数減少 44.1% (10.8%)
- 食欲減退 35.8% (2.8%)
- 悪心 34.6% (2.5%)
- 末梢性感覚ニューロパチー 22.5% (3.1%)
- 下痢 19.4% (2.8%)
- 好中球数減少 47.2% (30.6%)
- 嘔吐 17.6% (1.2%)
- 血小板減少 18.5% (2.8%)
- 口内炎 17.9% (4.0%)
- 体重減少 14.2% (0.3%)
- クレアチニン上昇 13.3% (0.3%)
- 便秘 13.0% (0%)
- AST上昇 13.0% (1.5%)
- ALT上昇 12.7% (1.5%)
- 倦怠感 14.8% (4.0%)
- 全身倦怠感 12.7% (1.9%)
- 掻痒 10.5% (0%)
- 無力症 11.4% (1.2%)
- 感覚鈍麻 10.5% (0.3%)
- 甲状腺機能低下症 10.5% (0%)
- 低カリウム血症 12.3% (5.6%)
- 低ナトリウム血症 12.7% (6.8%)
テビムブラ®適正使用ガイド²⁾を基に編集部作成
各プロトコル
適格基準
RATIONALE-306試験³⁾の主な適格基準
- ECOG PS 0–1
- 好中球数 ≧1,500/μL
- 血小板数 ≧10×10⁴/μL
- ヘモグロビン ≧9.0g/dL
- クレアチニン ≦1.5mg/dL
減量・休薬・中止基準
次回投与日までにGrade 0~1まで回復しない副作用が認められた場合は、 以下のとおりFPの減量を行う。 ただし、 5-FUおよびCDDPに個別に設定された休薬基準もあわせて参照すること。

テビムブラ®適正使用ガイド²⁾を基に編集部作成
5ーFU

RATIONALE-306試験³⁾のプロトコルに基づき編集部作成
CDDP

RATIONALE-306試験³⁾のプロトコルに基づき編集部作成
チスレリズマブ

テビムブラ®適正使用ガイド²⁾を基に編集部作成
レジメンの特徴と注意点
作用機序の特徴
チスレリズマブは、 PD-1阻害に加え、 Fc領域改変によりFcγ受容体との結合を最小化し、 T細胞の抗体依存性細胞貪食を抑制することで、 治療抵抗性の一因となるT細胞クリアランスを回避するよう設計されている。
併用化学療法はFPのみ
チスレリズマブは、 シスプラチン+フルオロウラシルとの併用による3週毎投与レジメンとして承認されている。 RATIONALE-306試験で用いられた他の化学療法レジメンとの併用は、 承認対象外である点に注意する。
他ICIとの比較
チスレリズマブに先行して臨床応用されているICI併用化学療法との比較は以下の通りである。

日本食道学会ガイドラインの位置付け
2025年4月14日に発出された、 日本食道学会ガイドライン委員会による速報は以下のとおり。

レジメン適用時の注意事項
- 2025年4月時点で、 SP263抗体によるPD-L1検査 (TAP) は食道癌で保険適応外
- チスレリズマブは初回60分、 忍容性良好なら以降30分で点滴静注
- CDDPによる腎障害予防のための十分な水分負荷と利尿管理を行う
- 水分負荷に対する心機能の耐容性を事前に確認する
- 末梢静脈での5-FU持続投与時は、 血管外漏出に注意する
出典
- ビーワン・メディシンズ合同会社. テビムブラ点滴静注100mg 電子添文 2025年7月作成 (第2版)
- ビーワン・メディシンズ合同会社. テビムブラ点滴静注100mg 適正使用ガイド 2025年6月作成
- Lancet Oncol. 2023;24(5):483-495.
- Lancet. 2021;398(10302):759-771.
- N Engl J Med. 2022;386(5):449-462.
最終更新日 : 2025年7月17日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




