ENCO+Cmab+FOLFOX
エンコラフェニブ (ビラフトビ®) +セツキシマブ+FOLFOX
ENCO:エンコラフェニブ(ビラフトビ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 300mg 1日1回 | 1~ | Day 1~ |
Cmab:セツキシマブ(アービタックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 500mg/m² 点滴 | 1~ | Day 1、15 |
L-OHP:オキサリプラチン(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day 1、15 |
l-LV:レボホリナート(レボホリナート®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day 1、15 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 点滴 | 1~ | Day 1、15 |
| 2400mg/m² 46~48時間で持続点滴 | 1~ | Day 1、15 |
前投薬
| Cmab投与時に生じ得るインフュージョンリアクションを軽減するため、投与前に抗ヒスタミン薬を前投与し、必要に応じて副腎皮質ステロイドを併用する。 |
その他
ビラフトビ®は、 従来 「がん化学療法後に増悪した BRAF 遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌」 に適応を有していたが、 2025年11月20日に 「BRAF 遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌」 へ一部変更承認
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ビラフトビ® (エンコラフェニブ)
*日本ベーリンガーインゲルハイム株式会社の外部サイトに遷移
アービタックス® (セツキシマブ)
投与スケジュール
【1コース】 28日間
【催吐性】中等度 (FOLFOX)
【FN発症】 未報告*
*BREAKWATER試験³⁾でFNは未報告
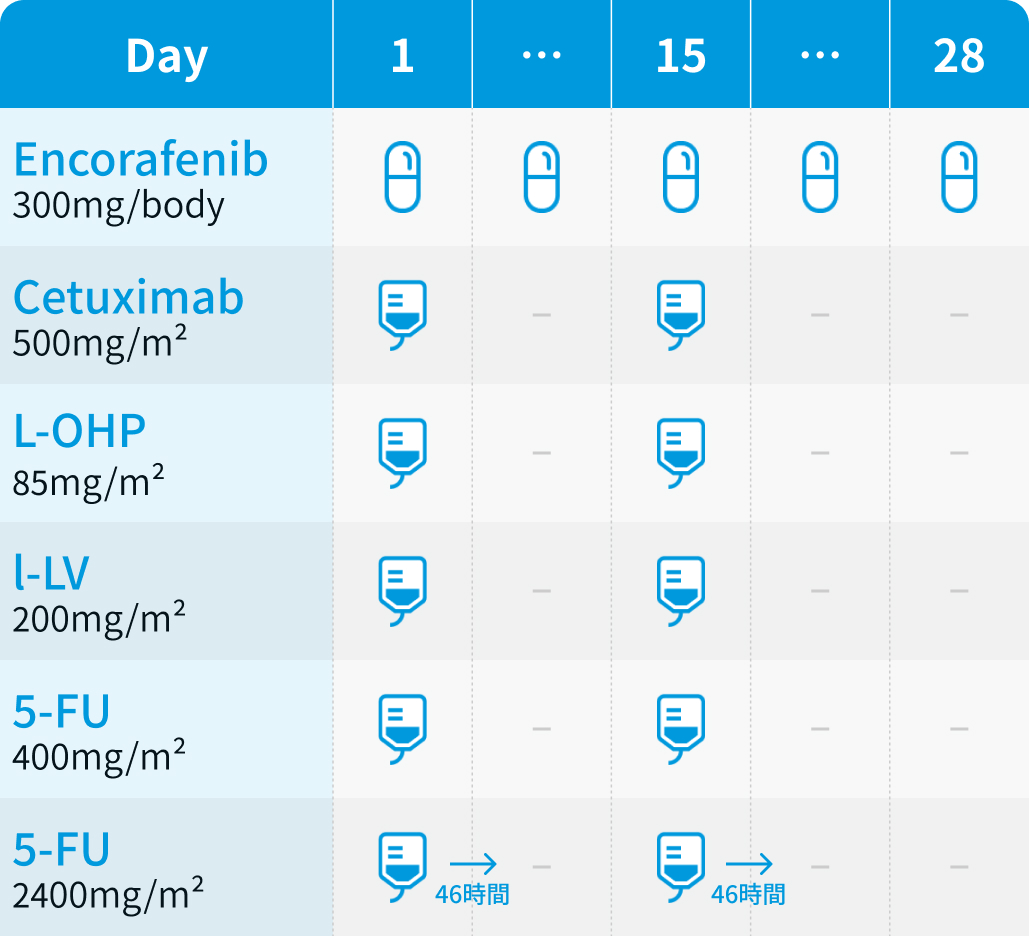
エンコラフェニブ (Enco) : 300mgを1日1回経口投与
セツキシマブ (Cmab) : 500mg/m²を120分かけて点滴静注し、 2週ごと (Day 1、 15) に投与
FOLFOX : オキサリプラチン85mg/m²を120分かけて点滴静注し、 ロイコボリン400mg/m²を同様に120分で投与。 続いて5-FU 400mg/m²を静注後、 2400mg/m²を46–48時間かけて持続点滴静注する。 これを2週ごと (Day 1、 15) に投与。
Key Data|臨床試験結果
📊 BREAKWATER試験
N Engl J Med. 2025;392(24):2425-2437.
未治療のBRAF V600E変異陽性切除不能・転移性大腸癌637例を対象とした第III相無作為化比較試験。 EC (エンコラフェニブ+セツキシマブ) +FOLFOX群236例と標準治療群243例を比較し、 主要評価項目は客観的奏効割合 (ORR) とPFSとされた。
当初はEC群、 EC+FOLFOX群、 標準治療群に割り付けられたが、 中間解析でEC+FOLFOX群がEC群を上回る有効性 (ORR 65.7% vs 45.6%、 OS中央値 30.3ヵ月 vs 19.5ヵ月) を示したため、 プロトコルが修正され、 EC群への新規登録は早期に中止された。
【有効性】 EC+FOLFOX群 (vs 標準治療群)
- ORR 65.7% (vs 37.4%)
- PFS中央値 12.8ヵ月 (vs 7.1ヵ月)
- HR 0.53 (95%CI 0.41–0.68、 p<0.001)
- 奏効期間中央値 13.9ヵ月 (vs 10.8ヵ月)
- OS中央値 30.3ヵ月 (vs 15.1ヵ月)
- HR 0.49 (95%CI 0.38–0.63、 p<0.001)
【安全性】 主な有害事象 全Grade (Grade≧ 3)
- 悪心 53.9% (3.0%)
- 貧血 46.1% (15.1%)
- 下痢 41.8% (1.3%)
- 食欲不振 37.5% (2.2%)
- 嘔吐 36.2% (3.9%)
- 好中球数減少 34.1% (19.0%)
- 関節痛 31.5% (2.6%)
- 皮疹 30.2% (1.3%)
- 無力症 25.9% (5.2%)
- 発熱 28.9% (2.2%)
- 末梢神経障害 27.6% (7.8%)
- 便秘 27.2% (0.4%)
- 末梢性感覚ニューロパチー 26.7% (6.9%)
- 疲労 26.3% (2.6%)
- 好中球減少症 24.1% (15.1%)
- 脱毛症 22.8% (0%)
- 血小板数減少 22.8% (1.3%)
- リパーゼ増加 22.4% (17.2%)
- 腹痛 20.3% (4.7%)
各プロトコル
適格基準
BREAKWATER試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球数≧1,500/μL
- 血小板数≧10万/μL
- ヘモグロビン≧9.0g/dL
- 腎機能 : CrCl≧50mL/min
- 肝機能 : T-Bil≦1.5×ULN、 AST/ALT≦2.5×ULN
用量レベル
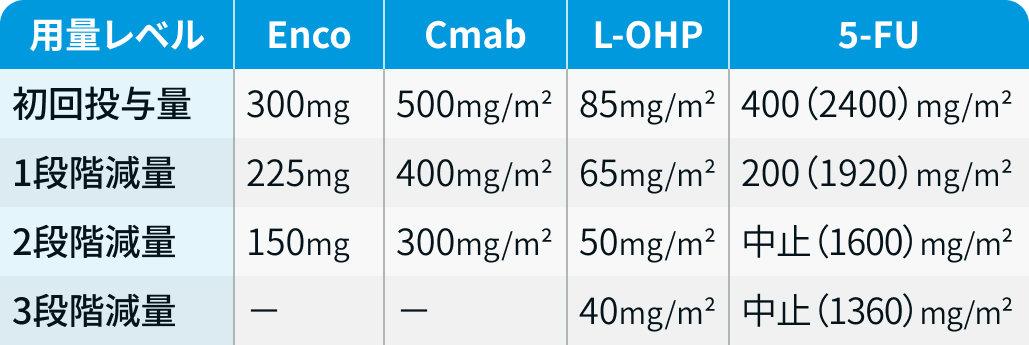
腎障害患者に対する用量調整
Enco : 尿中未変化体排泄率は1.8%と低く、 腎クリアランスの寄与は小さいため、 腎障害時の用量調整は不要と考えられる。
ビラフトビ®電子添文情報¹⁾を基に編集部が評価
Cmab : 抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
L-OHP : CrCL<30mL/minは、 初期投与量85mg/m²を65mg/m²に減量 (CrCL≧20mL/minでは減量不要との報告もある)⁴⁾。
5-FU : 減量不要。 ただし、 末期腎不全患者では代謝物の蓄積により高アンモニア血症を来す可能性が報告されている⁴⁾。
有害事象発現時の減量・休薬・中止基準
サイクル開始基準は以下のとおり。
- 好中球数≧1500/μL
- 血小板数≧10万/μL
- 消化器毒性Grade≦1
BREAKWATER試験³⁾では、 Enco+Cmab+FOLFOXはいずれかの薬剤を中止しても他剤の同時中止は不要であり、 医師の判断で継続できるとされた。
Enco :
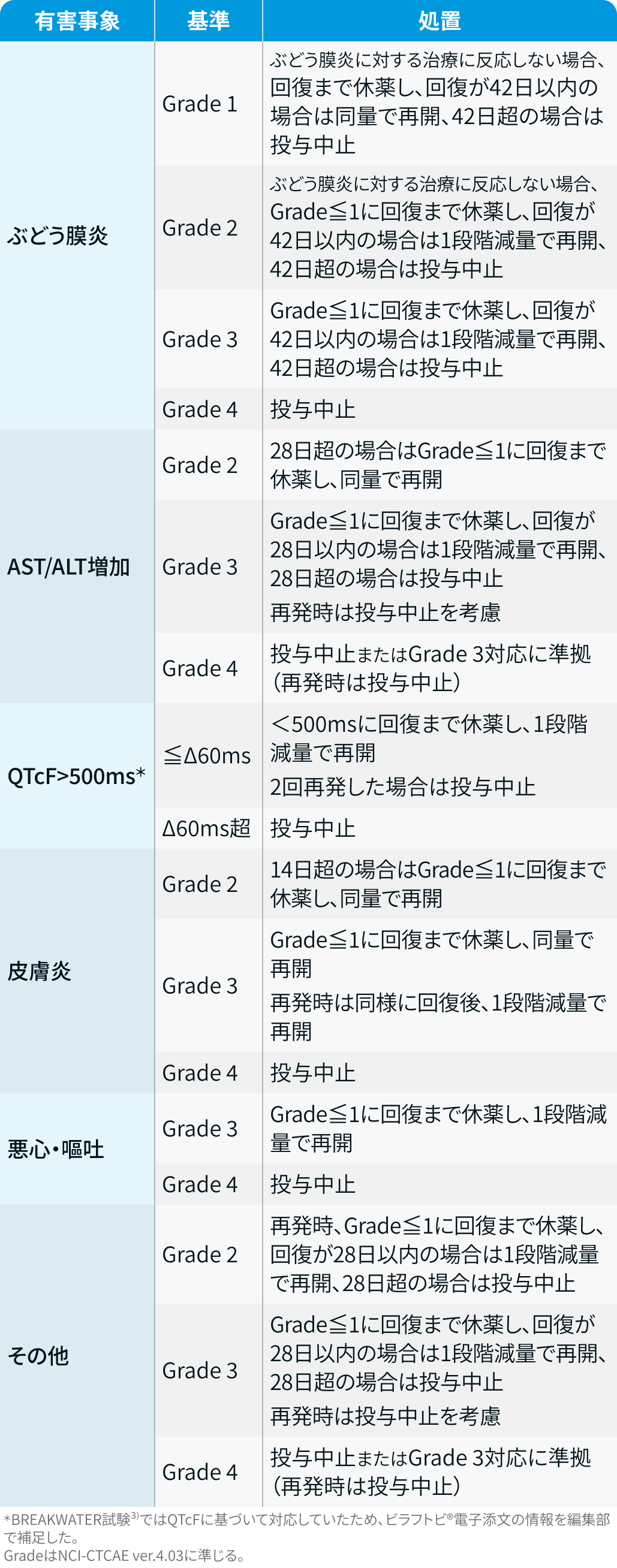
ビラフトビ®電子添文情報¹⁾を基に編集部作成
Cmab :

アービタックス®電子添文情報を基に編集部作成
BREAKWATER試験³⁾では、 間質性肺炎はGrade 2または増悪でCmabを休薬しGrade≦1で再開、 Grade 3では鑑別確定まで休薬し、 間質性肺疾患が確認されれば永久中止とされた。
FOLFOX :
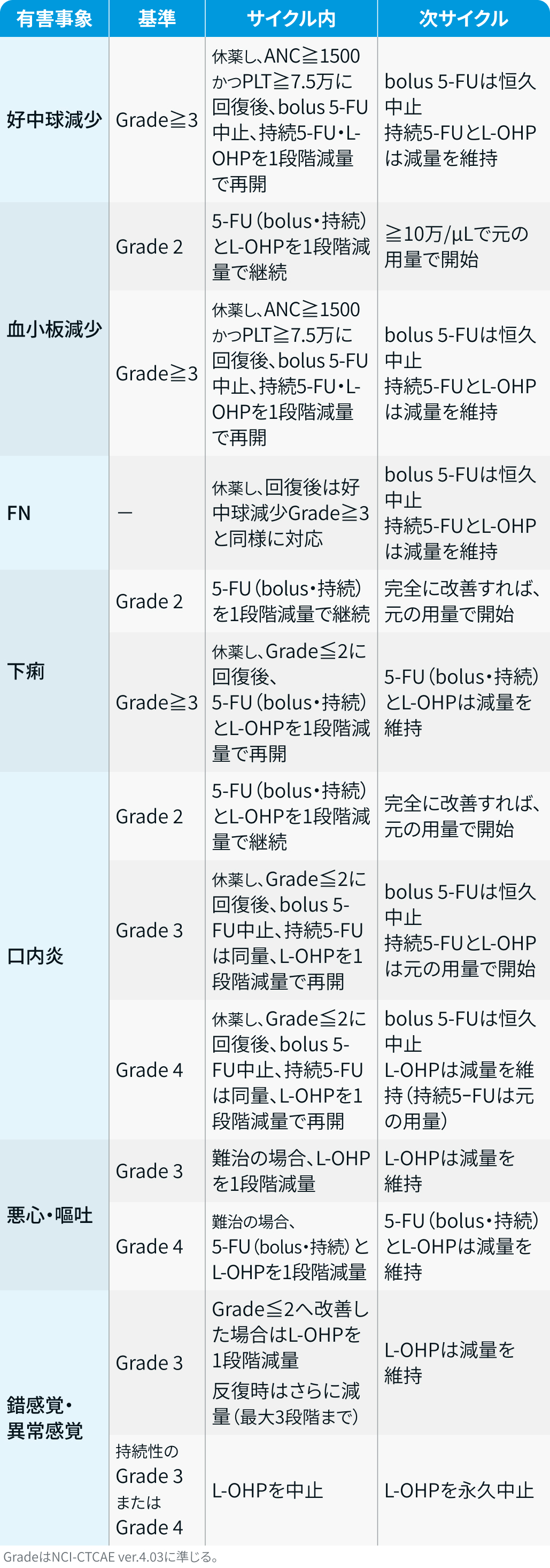
BREAKWATER試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
本レジメンの位置付け
本レジメンは、 BRAF V600E変異陽性進行・再発結腸直腸癌の1次治療として適用される。
🧑⚕️本レジメンの安全性プロファイルは、 各薬剤 (FOLFOXおよびエンコラフェニブ+セツキシマブ) の既報と同様である。 Grade 3–4の有害事象は81.5%に認められたが、 治療中止は26.7%にとどまり、 ほとんどの有害事象はマネージメント可能と考えられる。 特徴的な有害事象であるエンコラフェニブの関節痛、 セツキシマブの皮膚障害などの管理をうまく行いながら、 dose intensityを保ち治療を継続していくことが肝要である。
神奈川県立がんセンター 大隅寛木先生
作用機序の特徴
エンコラフェニブはBRAF V600Eのキナーゼ活性を阻害し、 MAPK経路 (MEK・ERK) シグナルを抑制することで細胞増殖を抑える。 大腸癌ではBRAF阻害に伴いEGFR経路が代償的に再活性化するため、 EGFR阻害薬セツキシマブを併用することでこの再活性化を抑え、 抗腫瘍効果を高める意義がある³⁾。
レジメン適用時の注意事項
Enco :
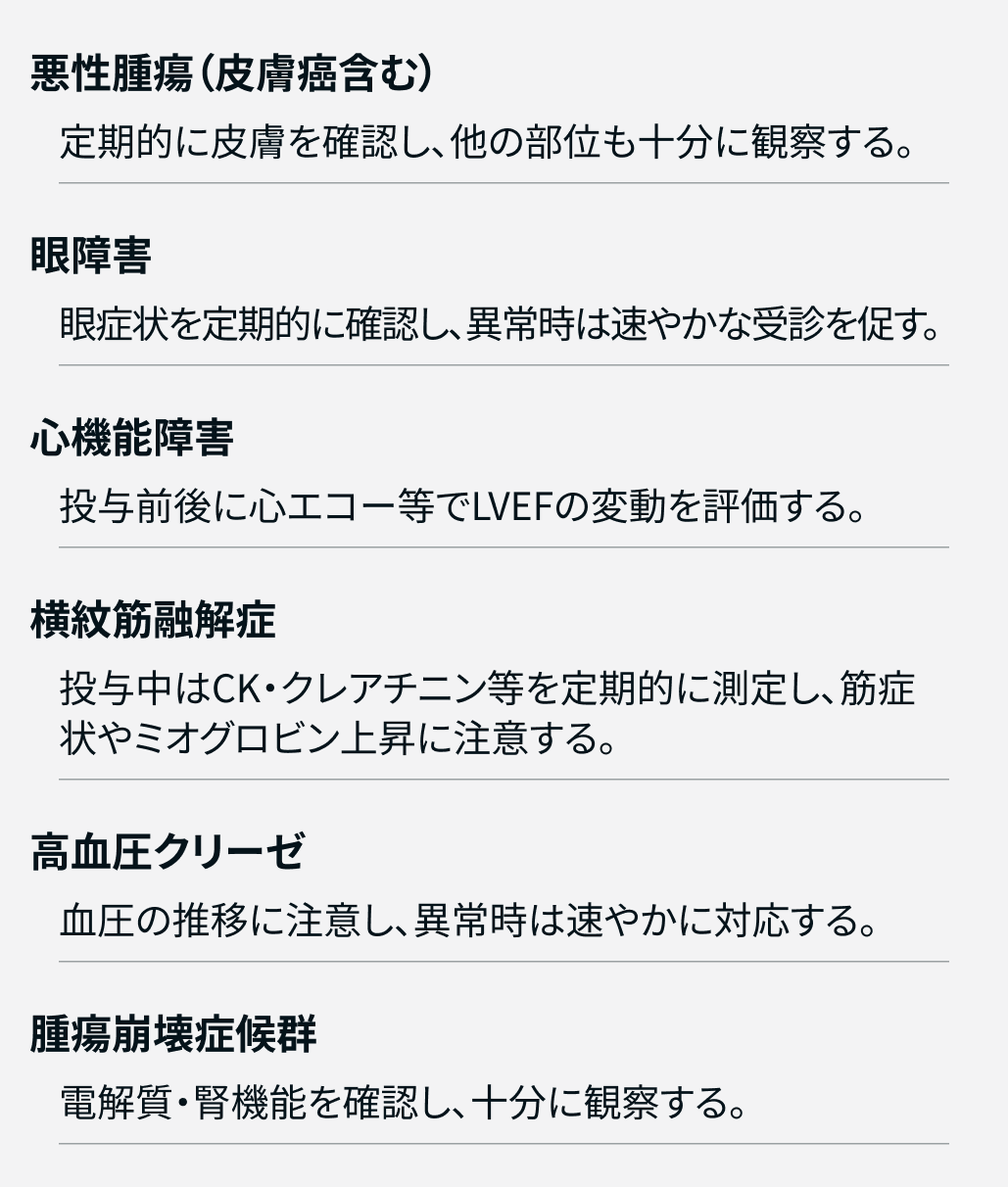
Cmab :

RMP【重要な特定されたリスク】
ビラフトビ®医薬品リスク管理計画書 (RMP)
- 皮膚悪性腫瘍
- 眼障害
- 手掌・足底発赤知覚不全症候群
- 腫瘍崩壊症候群
コンパニオン診断薬の情報
本剤の適応判定に利用可能なコンパニオン診断薬は以下のとおり。
- MEBGEN RASKET-B キット
- therascreen BRAF V600E変異検出キットRGQ 「キアゲン」
- Idylla RAS-BRAF Mutation Test 「ニチレイバイオ」
- Guardant360 CDx がん遺伝子パネル
出典
- 小野薬品工業株式会社. ビラフトビカプセル50mg/75mg 電子添文 2025年11月改訂 (第7版)
- 小野薬品工業株式会社. ビラフトビカプセル50mg/75mg 適正使用ガイド 2025年11月作成
- N Engl J Med. 2025;392(24):2425-2437.
- 日本腎臓学会、 日本癌治療学会、 日本臨床腫瘍学会、 日本腎臓病薬物療法学会編 : がん薬物療法時の腎障害診療ガイドライン2022. ライフサイエンス出版.
最終更新 : 2025年11月27日
執筆 : 京都桂病院薬剤科 塩飽英二
監修医師 : 神奈川県立がんセンター 消化器内科 (消化管) 部長 大隅寛木
ENCO+Cmab+FOLFOX
ENCO:エンコラフェニブ(ビラフトビ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 300mg 1日1回 | 1~ | Day 1~ |
Cmab:セツキシマブ(アービタックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 500mg/m² 点滴 | 1~ | Day 1、15 |
L-OHP:オキサリプラチン(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day 1、15 |
l-LV:レボホリナート(レボホリナート®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day 1、15 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 点滴 | 1~ | Day 1、15 |
| 2400mg/m² 46~48時間で持続点滴 | 1~ | Day 1、15 |
前投薬
| Cmab投与時に生じ得るインフュージョンリアクションを軽減するため、投与前に抗ヒスタミン薬を前投与し、必要に応じて副腎皮質ステロイドを併用する。 |
その他
概要
ビラフトビ®は、 従来 「がん化学療法後に増悪した BRAF 遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌」 に適応を有していたが、 2025年11月20日に 「BRAF 遺伝子変異を有する治癒切除不能な進行・再発の結腸・直腸癌」 へ一部変更承認
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ビラフトビ® (エンコラフェニブ)
*日本ベーリンガーインゲルハイム株式会社の外部サイトに遷移
アービタックス® (セツキシマブ)
投与スケジュール
【1コース】 28日間
【催吐性】中等度 (FOLFOX)
【FN発症】 未報告*
*BREAKWATER試験³⁾でFNは未報告

エンコラフェニブ (Enco) : 300mgを1日1回経口投与
セツキシマブ (Cmab) : 500mg/m²を120分かけて点滴静注し、 2週ごと (Day 1、 15) に投与
FOLFOX : オキサリプラチン85mg/m²を120分かけて点滴静注し、 ロイコボリン400mg/m²を同様に120分で投与。 続いて5-FU 400mg/m²を静注後、 2400mg/m²を46–48時間かけて持続点滴静注する。 これを2週ごと (Day 1、 15) に投与。
Key Data|臨床試験結果
📊 BREAKWATER試験
N Engl J Med. 2025;392(24):2425-2437.
未治療のBRAF V600E変異陽性切除不能・転移性大腸癌637例を対象とした第III相無作為化比較試験。 EC (エンコラフェニブ+セツキシマブ) +FOLFOX群236例と標準治療群243例を比較し、 主要評価項目は客観的奏効割合 (ORR) とPFSとされた。
当初はEC群、 EC+FOLFOX群、 標準治療群に割り付けられたが、 中間解析でEC+FOLFOX群がEC群を上回る有効性 (ORR 65.7% vs 45.6%、 OS中央値 30.3ヵ月 vs 19.5ヵ月) を示したため、 プロトコルが修正され、 EC群への新規登録は早期に中止された。
【有効性】 EC+FOLFOX群 (vs 標準治療群)
- ORR 65.7% (vs 37.4%)
- PFS中央値 12.8ヵ月 (vs 7.1ヵ月)
- HR 0.53 (95%CI 0.41–0.68、 p<0.001)
- 奏効期間中央値 13.9ヵ月 (vs 10.8ヵ月)
- OS中央値 30.3ヵ月 (vs 15.1ヵ月)
- HR 0.49 (95%CI 0.38–0.63、 p<0.001)
【安全性】 主な有害事象 全Grade (Grade≧ 3)
- 悪心 53.9% (3.0%)
- 貧血 46.1% (15.1%)
- 下痢 41.8% (1.3%)
- 食欲不振 37.5% (2.2%)
- 嘔吐 36.2% (3.9%)
- 好中球数減少 34.1% (19.0%)
- 関節痛 31.5% (2.6%)
- 皮疹 30.2% (1.3%)
- 無力症 25.9% (5.2%)
- 発熱 28.9% (2.2%)
- 末梢神経障害 27.6% (7.8%)
- 便秘 27.2% (0.4%)
- 末梢性感覚ニューロパチー 26.7% (6.9%)
- 疲労 26.3% (2.6%)
- 好中球減少症 24.1% (15.1%)
- 脱毛症 22.8% (0%)
- 血小板数減少 22.8% (1.3%)
- リパーゼ増加 22.4% (17.2%)
- 腹痛 20.3% (4.7%)
各プロトコル
適格基準
BREAKWATER試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球数≧1,500/μL
- 血小板数≧10万/μL
- ヘモグロビン≧9.0g/dL
- 腎機能 : CrCl≧50mL/min
- 肝機能 : T-Bil≦1.5×ULN、 AST/ALT≦2.5×ULN
用量レベル

腎障害患者に対する用量調整
Enco : 尿中未変化体排泄率は1.8%と低く、 腎クリアランスの寄与は小さいため、 腎障害時の用量調整は不要と考えられる。
ビラフトビ®電子添文情報¹⁾を基に編集部が評価
Cmab : 抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
L-OHP : CrCL<30mL/minは、 初期投与量85mg/m²を65mg/m²に減量 (CrCL≧20mL/minでは減量不要との報告もある)⁴⁾。
5-FU : 減量不要。 ただし、 末期腎不全患者では代謝物の蓄積により高アンモニア血症を来す可能性が報告されている⁴⁾。
有害事象発現時の減量・休薬・中止基準
サイクル開始基準は以下のとおり。
- 好中球数≧1500/μL
- 血小板数≧10万/μL
- 消化器毒性Grade≦1
BREAKWATER試験³⁾では、 Enco+Cmab+FOLFOXはいずれかの薬剤を中止しても他剤の同時中止は不要であり、 医師の判断で継続できるとされた。
Enco :

ビラフトビ®電子添文情報¹⁾を基に編集部作成
Cmab :

アービタックス®電子添文情報を基に編集部作成
BREAKWATER試験³⁾では、 間質性肺炎はGrade 2または増悪でCmabを休薬しGrade≦1で再開、 Grade 3では鑑別確定まで休薬し、 間質性肺疾患が確認されれば永久中止とされた。
FOLFOX :

BREAKWATER試験³⁾のプロトコルを基に編集部作成
レジメンの特徴と注意点
本レジメンの位置付け
本レジメンは、 BRAF V600E変異陽性進行・再発結腸直腸癌の1次治療として適用される。
🧑⚕️本レジメンの安全性プロファイルは、 各薬剤 (FOLFOXおよびエンコラフェニブ+セツキシマブ) の既報と同様である。 Grade 3–4の有害事象は81.5%に認められたが、 治療中止は26.7%にとどまり、 ほとんどの有害事象はマネージメント可能と考えられる。 特徴的な有害事象であるエンコラフェニブの関節痛、 セツキシマブの皮膚障害などの管理をうまく行いながら、 dose intensityを保ち治療を継続していくことが肝要である。
神奈川県立がんセンター 大隅寛木先生
作用機序の特徴
エンコラフェニブはBRAF V600Eのキナーゼ活性を阻害し、 MAPK経路 (MEK・ERK) シグナルを抑制することで細胞増殖を抑える。 大腸癌ではBRAF阻害に伴いEGFR経路が代償的に再活性化するため、 EGFR阻害薬セツキシマブを併用することでこの再活性化を抑え、 抗腫瘍効果を高める意義がある³⁾。
レジメン適用時の注意事項
Enco :

Cmab :

RMP【重要な特定されたリスク】
ビラフトビ®医薬品リスク管理計画書 (RMP)
- 皮膚悪性腫瘍
- 眼障害
- 手掌・足底発赤知覚不全症候群
- 腫瘍崩壊症候群
コンパニオン診断薬の情報
本剤の適応判定に利用可能なコンパニオン診断薬は以下のとおり。
- MEBGEN RASKET-B キット
- therascreen BRAF V600E変異検出キットRGQ 「キアゲン」
- Idylla RAS-BRAF Mutation Test 「ニチレイバイオ」
- Guardant360 CDx がん遺伝子パネル
出典
- 小野薬品工業株式会社. ビラフトビカプセル50mg/75mg 電子添文 2025年11月改訂 (第7版)
- 小野薬品工業株式会社. ビラフトビカプセル50mg/75mg 適正使用ガイド 2025年11月作成
- N Engl J Med. 2025;392(24):2425-2437.
- 日本腎臓学会、 日本癌治療学会、 日本臨床腫瘍学会、 日本腎臓病薬物療法学会編 : がん薬物療法時の腎障害診療ガイドライン2022. ライフサイエンス出版.
最終更新 : 2025年11月27日
執筆 : 京都桂病院薬剤科 塩飽英二
監修医師 : 神奈川県立がんセンター 消化器内科 (消化管) 部長 大隅寛木
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。





