Zongertinib
ゾンゲルチニブ (ヘルネクシオス®)
「がん化学療法後に増悪したHER2 (ERBB2) 遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌」 を対象として、 2025年9月19日に正式承認、 11月12日に薬価収載・発売となった (60mg 1錠 : 1万3,881.90円、 1日薬価 : 2万7,763.80円)。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヘルネクシオス®錠60mg (ゾンゲルチニブ)
*日本ベーリンガーインゲルハイム株式会社の外部サイトに遷移
投与スケジュール
【1コース】連日服用
【催吐性】未分類
【FN発症】頻度不明*
*Beamion LUNG-1試験²⁾で未報告
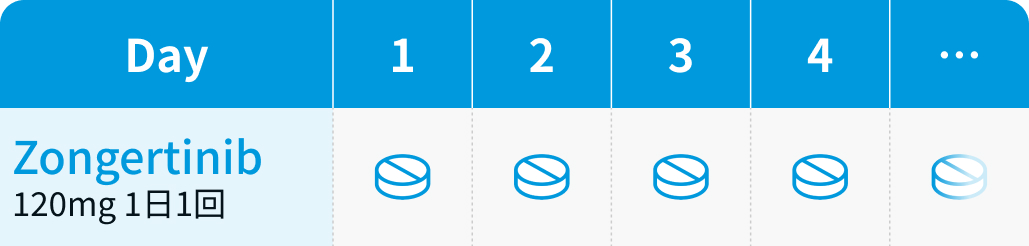
成人はゾンゲルチニブ120mgを1日1回経口投与
ヘルネクシオス®電子添文情報¹⁾を基に編集部作成
Key Data|臨床試験結果
📊 Beamion LUNG-1試験
N Engl J Med. 2025;392(23):2321-2333.
HER2変異陽性の進行・転移性NSCLCを対象とした多コホート第Ia–Ib相試験において、 ゾンゲルチニブの有効性が評価された。 コホート1では、 前治療歴のある*HER2 TKD変異を有する患者を対象に、 ゾンゲルチニブ120mgまたは240mgを1日1回投与する群に1:1で無作為に割り付けた。 中間解析の結果を受け、 以降の登録患者には120mg投与が選択された。 主要評価項目は客観的奏効率 (ORR)、 副次評価項目は奏効期間 (DoR) およびPFSであった。
*白金製剤併用化学療法を含む治療歴がある患者
【有効性】第Ib相のコホート1、 120mg群 75例 (vs 240mg群 55例)
- ORR 71% (vs 84%) / CR 7% (vs 未記載)
- DoR中央値 14.1ヵ月 (vs 9.7ヵ月)
- PFS中央値 12.4ヵ月 (vs 10.9ヵ月)
【安全性】主な有害事象 : 全Grade (Grade≧3)
120mg群75例のデータに基づく
- 下痢 56% (1.3%)
- 皮疹 33% (0%)
- AST増加 24% (5.3%)
- ALT増加 21% (8%)
- 悪心 15% (0%)
- 皮膚乾燥 15% (0%)
- 掻痒 13% (0%)
- 白血球減少 13% (0%)
- 貧血 12% (0%)
- 好中球減少 12% (1.3%)
- 爪障害 11% (0%)
各プロトコル
適格基準
Beamion LUNG-1試験³⁾の主な適格基準 :
- 18歳以上
- ECOG PS≦1
- 好中球数≧1,500/mm³
- ヘモグロビン≧9.0g/dL
- 血小板数≧10万/mm³
- 肝機能 : AST/ALT≦3xULN、 T-Bil≦1.5xULN
- 腎機能 : Cre≦1.5xULN又はCrCl≧50mL/min
コントロール不良な高血圧、 NYHA Ⅲ/Ⅳの心不全、 不安定狭心症、 コントロール不良な不整脈など臨床的に問題となる心疾患又は既往、 LVEF<50%又は基準値下限未満は除外
用量レベル
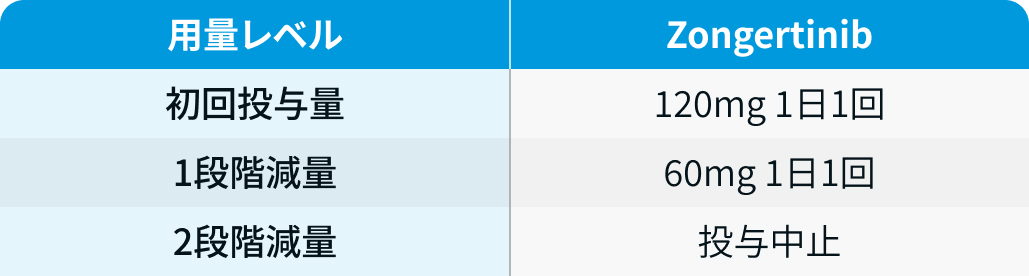
初回投与量 120mg1日1回、 1段階減量60mg 1日1回、 2段階減量投与中止 ヘルネクシオス®電子添文情報¹⁾を基に編集部作成
腎障害患者に対する用量調整
尿中未変化体排泄率は0.2%と低く、 腎クリアランスの寄与は小さいため、 腎障害時の用量調整は不要と考えられる 。
ヘルネクシオス®電子添文情報¹⁾を基に編集部が評価
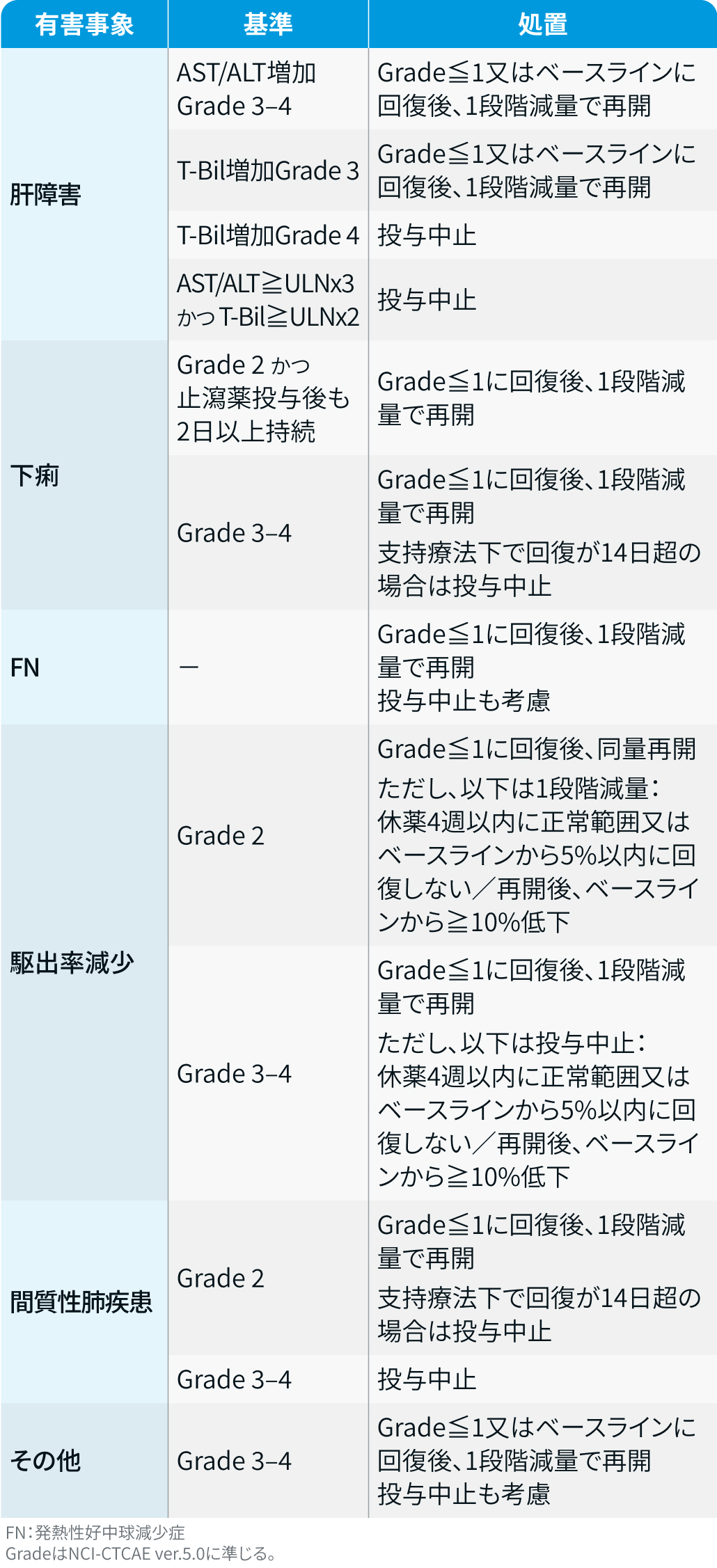
有害事象発現時の減量・休薬・中止基準
レジメンの特徴と注意点
👨⚕️有害事象はGradeが低いものが多く、 忍容性は高い。 トラスツズマブ デルクステカンと本剤の最適な治療順序は明らかでない。
和歌山県立医科大学附属病院 赤松弘朗先生
作用機序の特徴
ゾンゲルチニブは、 エクソン20挿入変異などを有するHER2のチロシンキナーゼ活性を阻害し、 下流のシグナル伝達を抑制することで腫瘍増殖抑制作用を示すと考えられている。
肺癌診療ガイドライン2025の推奨⁴⁾
2025年の適応追加をもって、 肺癌診療ガイドライン2025においてもHER2遺伝子変異陽性NSCLCに対し、 二次治療以降でゾンゲルチニブ単剤療法を行うよう強く推奨されている [推奨の強さ:1、 エビデンスの強さ:C]⁷⁾。
レジメン適用時の注意事項
肝機能障害 : 投与前・投与中に定期的に肝機能検査を行い、 状態を十分に観察。
血球減少 : 投与前・投与中に定期的に血液検査を行い、 状態を十分に観察。
間質性肺疾患 : 呼吸困難・咳嗽・発熱などの初期症状確認や胸部画像検査を実施し観察、 初期症状の発現時は速やかに受診するよう説明。
LVEF低下 : 投与前・投与中に心機能検査 (エコー等) を行い、 状態を十分に観察。
Beamion LUNG-1試験³⁾では、 心機能検査は治療開始28日以内のスクリーニング、 サイクル2およびサイクル4の1日目、 以降は偶数サイクルの1日目に評価された。
RMP【重要な特定されたリスク】
ヘルネクシオス® 医薬品リスク管理計画書 (RMP)
- 肝機能障害
- 重度の下痢
- 血球減少
コンパニオン診断薬の情報
本剤の適応判定に利用可能なコンパニオン診断薬は以下のとおり。
- オンコマイン Dx Target Test マルチ CDxシステム
HOKUTOレジメンツールに遷移します
出典
- 日本ベーリンガーインゲルハイム株式会社. ヘルネクシオス錠60mg 電子添文 2025年9月作成 第1版.
- 日本ベーリンガーインゲルハイム株式会社. ヘルネクシオス錠60mg 適正使用ガイド 2025年9月作成.
- N Engl J Med 2025;392:2321-33.
- 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新 : 2025年11月13日
執筆 : 京都桂病院薬剤科 塩飽英二
監修医師 : HOKUTO編集部 医師
Zongertinib
「がん化学療法後に増悪したHER2 (ERBB2) 遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌」 を対象として、 2025年9月19日に正式承認、 11月12日に薬価収載・発売となった (60mg 1錠 : 1万3,881.90円、 1日薬価 : 2万7,763.80円)。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヘルネクシオス®錠60mg (ゾンゲルチニブ)
*日本ベーリンガーインゲルハイム株式会社の外部サイトに遷移
投与スケジュール
【1コース】連日服用
【催吐性】未分類
【FN発症】頻度不明*
*Beamion LUNG-1試験²⁾で未報告

成人はゾンゲルチニブ120mgを1日1回経口投与
ヘルネクシオス®電子添文情報¹⁾を基に編集部作成
Key Data|臨床試験結果
📊 Beamion LUNG-1試験
N Engl J Med. 2025;392(23):2321-2333.
HER2変異陽性の進行・転移性NSCLCを対象とした多コホート第Ia–Ib相試験において、 ゾンゲルチニブの有効性が評価された。 コホート1では、 前治療歴のある*HER2 TKD変異を有する患者を対象に、 ゾンゲルチニブ120mgまたは240mgを1日1回投与する群に1:1で無作為に割り付けた。 中間解析の結果を受け、 以降の登録患者には120mg投与が選択された。 主要評価項目は客観的奏効率 (ORR)、 副次評価項目は奏効期間 (DoR) およびPFSであった。
*白金製剤併用化学療法を含む治療歴がある患者
【有効性】第Ib相のコホート1、 120mg群 75例 (vs 240mg群 55例)
- ORR 71% (vs 84%) / CR 7% (vs 未記載)
- DoR中央値 14.1ヵ月 (vs 9.7ヵ月)
- PFS中央値 12.4ヵ月 (vs 10.9ヵ月)
【安全性】主な有害事象 : 全Grade (Grade≧3)
120mg群75例のデータに基づく
- 下痢 56% (1.3%)
- 皮疹 33% (0%)
- AST増加 24% (5.3%)
- ALT増加 21% (8%)
- 悪心 15% (0%)
- 皮膚乾燥 15% (0%)
- 掻痒 13% (0%)
- 白血球減少 13% (0%)
- 貧血 12% (0%)
- 好中球減少 12% (1.3%)
- 爪障害 11% (0%)
各プロトコル
適格基準
Beamion LUNG-1試験³⁾の主な適格基準 :
- 18歳以上
- ECOG PS≦1
- 好中球数≧1,500/mm³
- ヘモグロビン≧9.0g/dL
- 血小板数≧10万/mm³
- 肝機能 : AST/ALT≦3xULN、 T-Bil≦1.5xULN
- 腎機能 : Cre≦1.5xULN又はCrCl≧50mL/min
コントロール不良な高血圧、 NYHA Ⅲ/Ⅳの心不全、 不安定狭心症、 コントロール不良な不整脈など臨床的に問題となる心疾患又は既往、 LVEF<50%又は基準値下限未満は除外
用量レベル

初回投与量 120mg1日1回、 1段階減量60mg 1日1回、 2段階減量投与中止 ヘルネクシオス®電子添文情報¹⁾を基に編集部作成
腎障害患者に対する用量調整
尿中未変化体排泄率は0.2%と低く、 腎クリアランスの寄与は小さいため、 腎障害時の用量調整は不要と考えられる 。
ヘルネクシオス®電子添文情報¹⁾を基に編集部が評価
有害事象発現時の減量・休薬・中止基準

レジメンの特徴と注意点
👨⚕️有害事象はGradeが低いものが多く、 忍容性は高い。 トラスツズマブ デルクステカンと本剤の最適な治療順序は明らかでない。
和歌山県立医科大学附属病院 赤松弘朗先生
作用機序の特徴
ゾンゲルチニブは、 エクソン20挿入変異などを有するHER2のチロシンキナーゼ活性を阻害し、 下流のシグナル伝達を抑制することで腫瘍増殖抑制作用を示すと考えられている。
肺癌診療ガイドライン2025の推奨⁴⁾
2025年の適応追加をもって、 肺癌診療ガイドライン2025においてもHER2遺伝子変異陽性NSCLCに対し、 二次治療以降でゾンゲルチニブ単剤療法を行うよう強く推奨されている [推奨の強さ:1、 エビデンスの強さ:C]⁷⁾。

レジメン適用時の注意事項
肝機能障害 : 投与前・投与中に定期的に肝機能検査を行い、 状態を十分に観察。
血球減少 : 投与前・投与中に定期的に血液検査を行い、 状態を十分に観察。
間質性肺疾患 : 呼吸困難・咳嗽・発熱などの初期症状確認や胸部画像検査を実施し観察、 初期症状の発現時は速やかに受診するよう説明。
LVEF低下 : 投与前・投与中に心機能検査 (エコー等) を行い、 状態を十分に観察。
Beamion LUNG-1試験³⁾では、 心機能検査は治療開始28日以内のスクリーニング、 サイクル2およびサイクル4の1日目、 以降は偶数サイクルの1日目に評価された。
RMP【重要な特定されたリスク】
ヘルネクシオス® 医薬品リスク管理計画書 (RMP)
- 肝機能障害
- 重度の下痢
- 血球減少
コンパニオン診断薬の情報
本剤の適応判定に利用可能なコンパニオン診断薬は以下のとおり。
- オンコマイン Dx Target Test マルチ CDxシステム
HOKUTOレジメンツールに遷移します
出典
- 日本ベーリンガーインゲルハイム株式会社. ヘルネクシオス錠60mg 電子添文 2025年9月作成 第1版.
- 日本ベーリンガーインゲルハイム株式会社. ヘルネクシオス錠60mg 適正使用ガイド 2025年9月作成.
- N Engl J Med 2025;392:2321-33.
- 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新 : 2025年11月13日
執筆 : 京都桂病院薬剤科 塩飽英二
監修医師 : HOKUTO編集部 医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




