Selpercatinib
セルペルカチニブ (レットヴィモ®)
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
レットヴィモ®カプセル (セルペルカチニブ)
*日本イーライリリー株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与
【催吐性】 最小度催吐性
【FN発症】低リスク

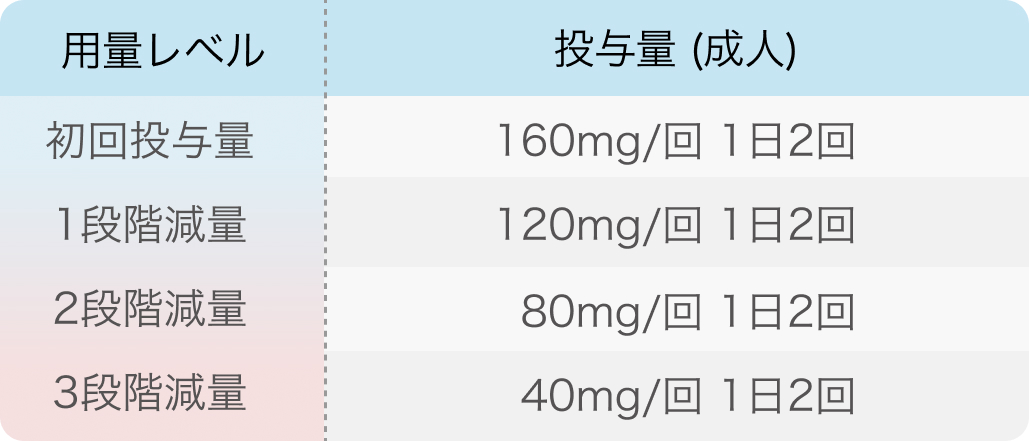
通常、 成人には1回160mgを1日2回経口投与する。 なお、 患者の状態により適宜減量する。
レットヴィモ®カプセル適正使用ガイド²⁾より引用
小児用量の記載
通常、 12歳以上の小児には体表面積に合わせて次の投与量 (セルペルカチニブとして1回約92mg/m²) を1日2回経口投与する。 なお、 患者の状態により適宜減量する。
- 体表面積 1.2m²未満 : 80mg/回
- 体表面積 1.2m²以上1.6m²未満 : 120mg/回
- 体表面積 1.6m²以上 : 160mg/回
レットヴィモ®適正使用ガイド (2024年6月作成)²⁾より引用
KeyData|臨床試験結果
📊LIBRETTO-001試験
J Clin Oncol. 2023 Jan 10;41(2):385-394.
RET融合遺伝子陽性の非小細胞肺癌を対象としたセルペルカチニブ単剤療法の第Ⅰ/Ⅱ相試験
【有効性】既治療例コホート (105例)
- ORR : 64% [主要評価項目]
- mPFS : 16.5ヵ月
【有効性】初回治療例コホート (39例)
- ORR : 85% [主要評価項目]
- mPFS : 未到達
※主な有害事象は、 下痢、 口内乾燥、 高血圧、 肝機能障害、 倦怠感
各プロトコル
投与開始基準例
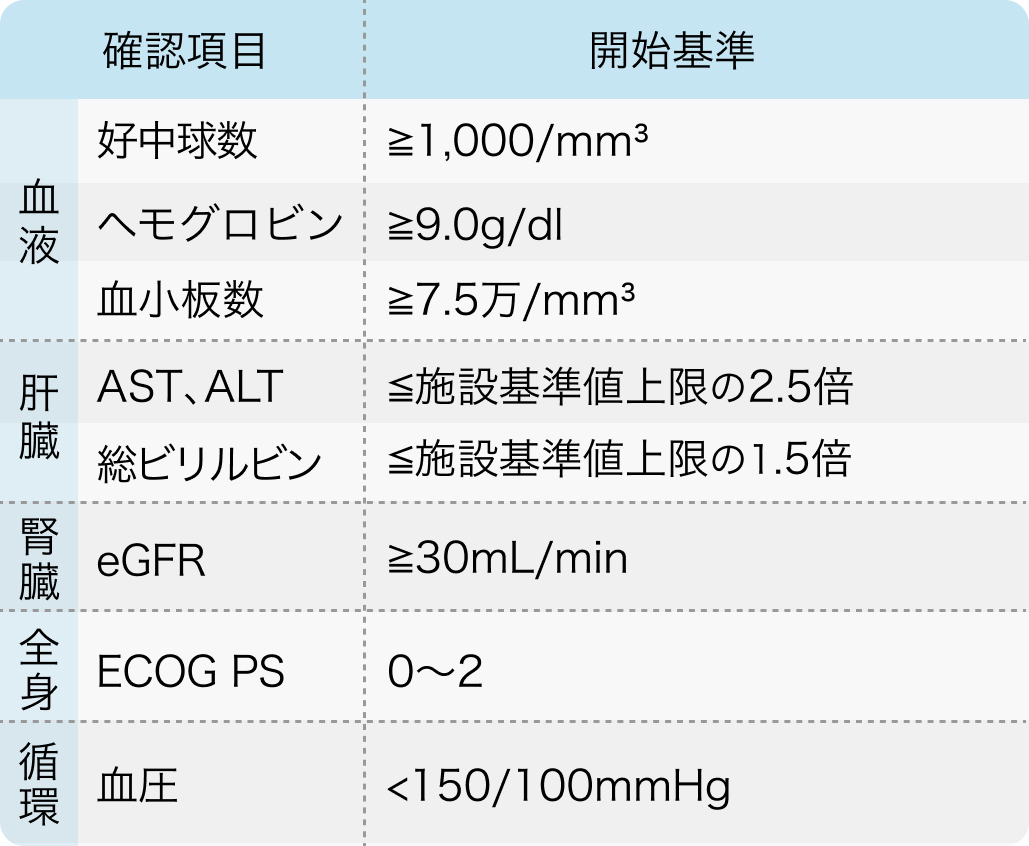
レットヴィモ®カプセル適正使用ガイド²⁾を基に編集部作表
減量・休薬・中止基準

レットヴィモ®カプセル適正使用ガイド²⁾を基に編集部作表
※CTCAEの確認は以下のリンクから
小児の減量目安は添付文書または適正使用ガイド参照
レットヴィモ®カプセル適正使用ガイド²⁾を基に編集部作表
レジメンの特徴と注意点
遺伝子パネル検査・コンパニオン診断
日本肺癌学会の各種手引きやHOKUTO編集部のまとめコンテンツを参照ください。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
肺癌診療ガイドライン2025の推奨⁴⁾
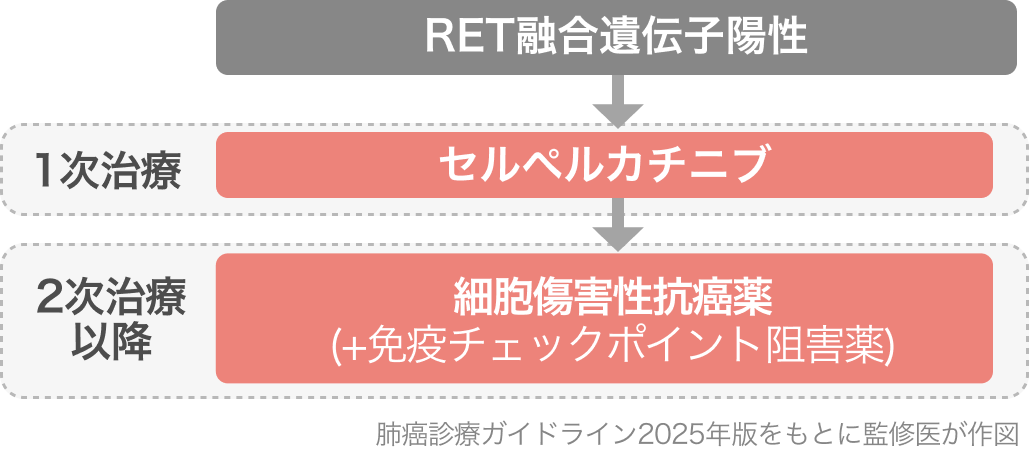
RET融合遺伝子陽性NSCLCの一次治療として、 セルペルカチニブ単剤療法が強く推奨されている [1B]。 前々版の2023年版では1Cの推奨であったが、 LIBRETTO-431 (NEJM 2023) の結果をもって2024年版より1Bとなった。
出典
1) 日本イーライリリー株式会社. レットヴィモ®添付文書 (2025年9月改訂 第8版) [最終閲覧 : 2025/11/13]
2) 日本イーライリリー株式会社. レットヴィモ®適正使用ガイド (2025年9月作成) [最終閲覧 : 2025/11/13]
*日本イーライリリー株式会社の外部サイトへ遷移します
4) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2025年11月13日
HOKUTO編集部医師監修
Selpercatinib
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
レットヴィモ®カプセル (セルペルカチニブ)
*日本イーライリリー株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与
【催吐性】 最小度催吐性
【FN発症】低リスク

通常、 成人には1回160mgを1日2回経口投与する。 なお、 患者の状態により適宜減量する。
レットヴィモ®カプセル適正使用ガイド²⁾より引用
小児用量の記載
通常、 12歳以上の小児には体表面積に合わせて次の投与量 (セルペルカチニブとして1回約92mg/m²) を1日2回経口投与する。 なお、 患者の状態により適宜減量する。
- 体表面積 1.2m²未満 : 80mg/回
- 体表面積 1.2m²以上1.6m²未満 : 120mg/回
- 体表面積 1.6m²以上 : 160mg/回
レットヴィモ®適正使用ガイド (2024年6月作成)²⁾より引用
KeyData|臨床試験結果
📊LIBRETTO-001試験
J Clin Oncol. 2023 Jan 10;41(2):385-394.
RET融合遺伝子陽性の非小細胞肺癌を対象としたセルペルカチニブ単剤療法の第Ⅰ/Ⅱ相試験
【有効性】既治療例コホート (105例)
- ORR : 64% [主要評価項目]
- mPFS : 16.5ヵ月
【有効性】初回治療例コホート (39例)
- ORR : 85% [主要評価項目]
- mPFS : 未到達
※主な有害事象は、 下痢、 口内乾燥、 高血圧、 肝機能障害、 倦怠感
各プロトコル
投与開始基準例

レットヴィモ®カプセル適正使用ガイド²⁾を基に編集部作表
減量・休薬・中止基準

レットヴィモ®カプセル適正使用ガイド²⁾を基に編集部作表
※CTCAEの確認は以下のリンクから

小児の減量目安は添付文書または適正使用ガイド参照
レットヴィモ®カプセル適正使用ガイド²⁾を基に編集部作表
レジメンの特徴と注意点
遺伝子パネル検査・コンパニオン診断
日本肺癌学会の各種手引きやHOKUTO編集部のまとめコンテンツを参照ください。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
肺癌診療ガイドライン2025の推奨⁴⁾

RET融合遺伝子陽性NSCLCの一次治療として、 セルペルカチニブ単剤療法が強く推奨されている [1B]。 前々版の2023年版では1Cの推奨であったが、 LIBRETTO-431 (NEJM 2023) の結果をもって2024年版より1Bとなった。
出典
1) 日本イーライリリー株式会社. レットヴィモ®添付文書 (2025年9月改訂 第8版) [最終閲覧 : 2025/11/13]
2) 日本イーライリリー株式会社. レットヴィモ®適正使用ガイド (2025年9月作成) [最終閲覧 : 2025/11/13]
*日本イーライリリー株式会社の外部サイトへ遷移します
4) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2025年11月13日
HOKUTO編集部医師監修
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




