Sotorasib
ソトラシブ (ルマケラス®︎)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ルマケラス®錠 (ソトラシブ)
*アムジェン株式会社の外部サイトへ移動します
投与スケジュール
【1コース】連日内服投与
【催吐性】 最小度催吐性
【FN発症】低リスク

通常、 成人にはソトラシブとして960mgを1日1回経口投与。 なお、 患者状態により適宜減量。
ルマケラス錠 添付文書¹⁾を基に編集部作表
KeyData|臨床試験結果
📊CodeBreak 200試験³⁾
Lancet. 2023;S0140-6736(23) 00221-0.
22か国148施設のランダム化非盲検第3相試験KRAS G12C変異を有す18歳以上のNSCLCで、 プラチナ製剤併用療法およびPD-1、 PD-L1阻害剤の前治療後に進行した患者を345名が無作為に1:1で割り付けられた
・ソトラシブ経口投与 (960mg1日1回) 171例
・ドセタキセル静注 (75mg/m²を3週毎)174例
【有効性】ソトラシブ経口投与群
- ORR : 28.1%
- mPFS : 5.6ヵ月
【安全性】ソトラシブ経口投与群

22か国148施設のランダム化非盲検第3相試験 : 掲載データ³⁾を元にHOKUTO編集部で作図
各プロトコル
休薬・減量基準

ルマケラス錠 添付文書¹⁾を基に編集部作表
減量レベル
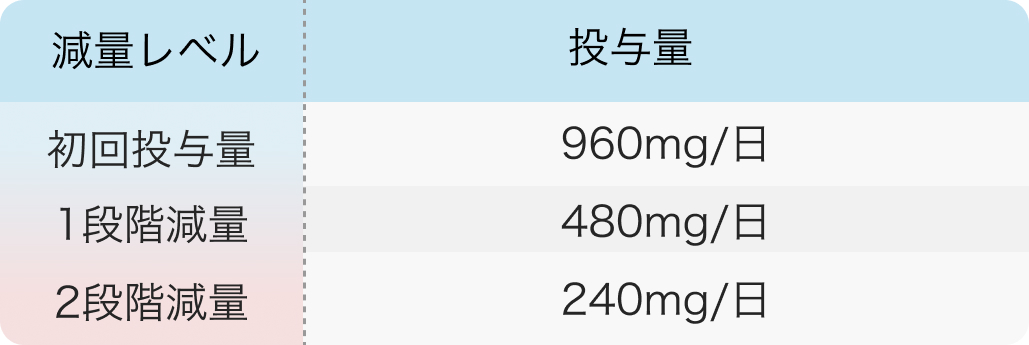
初回投与量 960mg/日、 1段階減量 480mg/日、 2段階減量 240mg/日 ルマケラス錠 添付文書¹⁾を基に編集部作表
レジメンの特徴と注意点
使用におけるワンポイント
有害事象は主に消化器毒性と肝障害であり、 比較的使用しやすいレジメンである。 ただし、 2次治療以降での使用となるため、 前治療に免疫チェックポイント阻害薬が含まれている場合には、 初回投与までの期間によって肝障害の発現率が異なる可能性があるため、 投与後は肝機能の状態を十分に観察する。
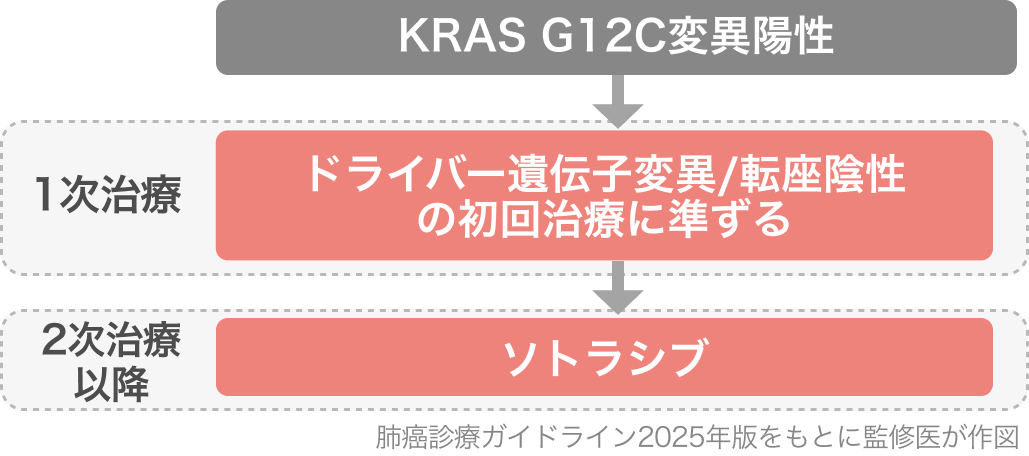
KRAS G12C変異陽性 / 2次治療以降
適応はがん化学療法後に増悪したKRAS G12C変異陽性の切除不能 進行・再発NSCLCであり、 「肺癌診療ガイドライン 2025年版⁴⁾」では2次治療以降でソトラシブ単剤療法を行うよう強く推奨されている (推奨・エビデンス 1B)
KRAS活性化変異はNSCLCの25~39%に、 KRAS G12C変異は肺腺癌の13~16%に発生する
遺伝子変異とコンパニオン診断
KRASは、 RASがん遺伝子 (KRAS、HRAS、NRAS) のうちの1つである。 RASがん遺伝子は、約19%と全がん腫で最も高頻度にみられるがん遺伝子である。 欧米の肺腺がんの約30%、 日本の肺腺がんの約10%で見つかるとされる⁵⁾。
コンパニオン診断の最新情報について、 こちらのコンテンツを参照ください。
肺癌コンパニオン診断薬一覧ページへ遷移
出典
1) アムジェン株式会社. ルマケラス錠120mg 添付文書 (2025年09月改訂第6版)
2) アムジェン株式会社. ルマケラス®︎錠 120mg 適正使用ガイド (2025年9月作成) [最終確認 : 2025/11/13]
*アムジェン株式会社の外部サイトへ移動します
4) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
5) 統合版_日本肺癌学会バイオマーカー委員会編_肺癌患者におけるバイオマーカー検査の手引きv2.1.5(2025年10月作成)
最終更新 : 2025年11月13日
和歌山県立医科大学附属病院 赤松弘朗先生
Sotorasib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ルマケラス®錠 (ソトラシブ)
*アムジェン株式会社の外部サイトへ移動します
投与スケジュール
【1コース】連日内服投与
【催吐性】 最小度催吐性
【FN発症】低リスク

通常、 成人にはソトラシブとして960mgを1日1回経口投与。 なお、 患者状態により適宜減量。
ルマケラス錠 添付文書¹⁾を基に編集部作表
KeyData|臨床試験結果
📊CodeBreak 200試験³⁾
Lancet. 2023;S0140-6736(23) 00221-0.
22か国148施設のランダム化非盲検第3相試験KRAS G12C変異を有す18歳以上のNSCLCで、 プラチナ製剤併用療法およびPD-1、 PD-L1阻害剤の前治療後に進行した患者を345名が無作為に1:1で割り付けられた
・ソトラシブ経口投与 (960mg1日1回) 171例
・ドセタキセル静注 (75mg/m²を3週毎)174例
【有効性】ソトラシブ経口投与群
- ORR : 28.1%
- mPFS : 5.6ヵ月
【安全性】ソトラシブ経口投与群

22か国148施設のランダム化非盲検第3相試験 : 掲載データ³⁾を元にHOKUTO編集部で作図
各プロトコル
休薬・減量基準

ルマケラス錠 添付文書¹⁾を基に編集部作表
減量レベル

初回投与量 960mg/日、 1段階減量 480mg/日、 2段階減量 240mg/日 ルマケラス錠 添付文書¹⁾を基に編集部作表
レジメンの特徴と注意点
使用におけるワンポイント
有害事象は主に消化器毒性と肝障害であり、 比較的使用しやすいレジメンである。 ただし、 2次治療以降での使用となるため、 前治療に免疫チェックポイント阻害薬が含まれている場合には、 初回投与までの期間によって肝障害の発現率が異なる可能性があるため、 投与後は肝機能の状態を十分に観察する。
KRAS G12C変異陽性 / 2次治療以降
適応はがん化学療法後に増悪したKRAS G12C変異陽性の切除不能 進行・再発NSCLCであり、 「肺癌診療ガイドライン 2025年版⁴⁾」では2次治療以降でソトラシブ単剤療法を行うよう強く推奨されている (推奨・エビデンス 1B)
KRAS活性化変異はNSCLCの25~39%に、 KRAS G12C変異は肺腺癌の13~16%に発生する

遺伝子変異とコンパニオン診断
KRASは、 RASがん遺伝子 (KRAS、HRAS、NRAS) のうちの1つである。 RASがん遺伝子は、約19%と全がん腫で最も高頻度にみられるがん遺伝子である。 欧米の肺腺がんの約30%、 日本の肺腺がんの約10%で見つかるとされる⁵⁾。
コンパニオン診断の最新情報について、 こちらのコンテンツを参照ください。
肺癌コンパニオン診断薬一覧ページへ遷移
出典
1) アムジェン株式会社. ルマケラス錠120mg 添付文書 (2025年09月改訂第6版)
2) アムジェン株式会社. ルマケラス®︎錠 120mg 適正使用ガイド (2025年9月作成) [最終確認 : 2025/11/13]
*アムジェン株式会社の外部サイトへ移動します
4) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
5) 統合版_日本肺癌学会バイオマーカー委員会編_肺癌患者におけるバイオマーカー検査の手引きv2.1.5(2025年10月作成)
最終更新 : 2025年11月13日
和歌山県立医科大学附属病院 赤松弘朗先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




