Atezolizumab
アテゾリズマブ (テセントリク®)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テセントリク®点滴静注 (アテゾリズマブ)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】21日
【催吐性】 軽度催吐性
【FN発症】低リスク

1回1200mgを60分かけて3週間ごとに点滴静注し、 初回投与の忍容性が良好であれば2回目以降は投与時間を30分まで短縮できる。
2025年9月19日、 1回1680mgを4週間ごとに点滴静注する用法・用量が追加承認された。
👨⚕️q4wの追加承認により、 単剤療法の利便性が向上した。 一方で、 併用療法においてはq4w投与が未承認である点に留意が必要である。
和歌山県立医科大学附属病院 赤松弘朗先生
各プロトコル
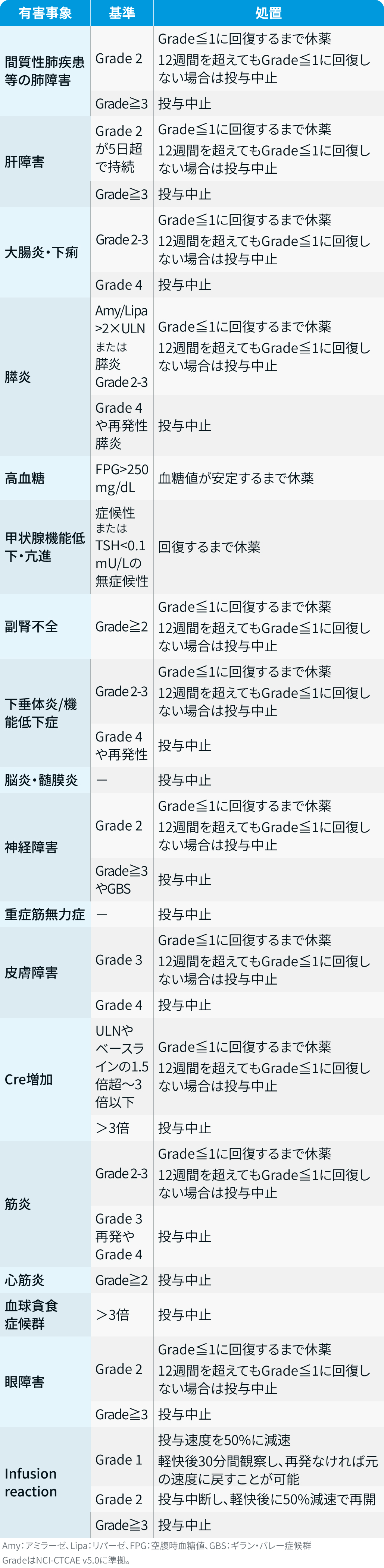
休薬・中止基準
KeyData|臨床試験結果
📊IMpower110試験³⁾ [1次治療]
SP142を用いたPD-L1免疫染色でTC1もしくはIC1以上 (PD-L1発現あり相当)、 PS 0-1の切除不能な進行・再発NSCLC患者を対象として、 アテゾリズマブ単剤療法とプラチナ製剤併用療法を比較した国際共同第Ⅲ相臨床試験。 PD-L1別によるヒエラルキー解析が用いられ、TC≧1% (PD-L1高発現相当) の患者205人を対象とした解析において有効性が証明された。
【有効性】同サブグループ
- mOS : 20.2ヵ月 [主要評価項目]
- mPFS : 8.1ヵ月
- ORR : 38.3%
【安全性】主な副作用 (5%以上)
- 173例 (60.5%) に副作用が認められた
- 疲労22例 (7.7%)
- 無力症21例 (7.3%)
- 悪心20例 (7.0%)
- 食欲減退20例 (7.0%)
- 甲状腺機能低下症19例 (6.6%)
- 発疹19例 (6.6%)
- ALT増加18例 (6.3%)
- 下痢17例 (5.9%)
📊OAK試験⁴⁾ [2次治療以降]
プラチナ併用療法の治療歴を有するPS0~1の切除不能な進行・再発NSCLC患者を対象として、 アテゾリズマブ単剤療法とドセタキセル単剤療法を比較した国際共同第Ⅲ相臨床試験 [本剤群613例、 ドセタキセル群612例]
【有効性】
- mOS : 13.8ヵ月 [主要評価項目]
- mPFS : 2.8ヵ月
- ORR : 14.0%
ITT集団、 TC1/2/3またはIC1/2/3集団のいずれにおいてもアテゾリズマブ単剤療法群で統計学的に有意に延長した。 PD-L1発現がない (TC0かつIC0) 集団でも、 アテゾリズマブ単剤療法群でOSを有意に延長した。
【安全性】主な副作用 (5%以上)
- 390例 (64.0%) に副作用が認められた
- 疲労87例 (14.3%)
- 悪心53例 (8.7%)
- 食欲減退52例 (8.5%)
- 無力症51例 (8.4%)
- 発熱49例 (8.0%)
- 下痢47例 (7.7%)
- 発疹42例 (6.9%)
- そう痒症38例 (6.2%)
レジメンの特徴と注意点
投与開始前の注意点
PD-L1の発現頻度により効果に差がある
- 1次治療 : SP142で評価 (TC3ないしはIC3なことを確認する)
- 2次治療~ : PD-L1検査は必須ではない
- アジュバント : SP263で評価 (TC≧1%であることを確認する)
コンパニオン診断薬については「肺癌患者におけるPD-L1検査の手引き⁴⁾」を参照する。
副作用と対策
本剤のT細胞活性化作用により、 過度の免疫反応に起因すると考えられる様々な疾患や病態 (irAE) が現れることがあり、以下が推奨される。
- 内分泌機能検査 (TSH、 FT4、 ACTHなど) を定期的に実施し、モニタリングする。
- その他尿検査や画像評価などの定期的なモニタリングも必要である。
- 有害事象が疑われた場合には、 各専門医へのコンサルトも検討する。
出典
1) 中外製薬株式会社. テセントリク®点滴静注電子添文情報 2025年9月改訂 第10版.
2) 中外製薬株式会社. テセントリク®︎適正使用ガイド 2025年9月改訂.
最終更新日 : 2025年10月20日
監修・作図 : HOKUTO編集部専門医
Atezolizumab
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テセントリク®点滴静注 (アテゾリズマブ)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】21日
【催吐性】 軽度催吐性
【FN発症】低リスク

1回1200mgを60分かけて3週間ごとに点滴静注し、 初回投与の忍容性が良好であれば2回目以降は投与時間を30分まで短縮できる。
2025年9月19日、 1回1680mgを4週間ごとに点滴静注する用法・用量が追加承認された。
👨⚕️q4wの追加承認により、 単剤療法の利便性が向上した。 一方で、 併用療法においてはq4w投与が未承認である点に留意が必要である。
和歌山県立医科大学附属病院 赤松弘朗先生
各プロトコル
休薬・中止基準

KeyData|臨床試験結果
📊IMpower110試験³⁾ [1次治療]
SP142を用いたPD-L1免疫染色でTC1もしくはIC1以上 (PD-L1発現あり相当)、 PS 0-1の切除不能な進行・再発NSCLC患者を対象として、 アテゾリズマブ単剤療法とプラチナ製剤併用療法を比較した国際共同第Ⅲ相臨床試験。 PD-L1別によるヒエラルキー解析が用いられ、TC≧1% (PD-L1高発現相当) の患者205人を対象とした解析において有効性が証明された。
【有効性】同サブグループ
- mOS : 20.2ヵ月 [主要評価項目]
- mPFS : 8.1ヵ月
- ORR : 38.3%
【安全性】主な副作用 (5%以上)
- 173例 (60.5%) に副作用が認められた
- 疲労22例 (7.7%)
- 無力症21例 (7.3%)
- 悪心20例 (7.0%)
- 食欲減退20例 (7.0%)
- 甲状腺機能低下症19例 (6.6%)
- 発疹19例 (6.6%)
- ALT増加18例 (6.3%)
- 下痢17例 (5.9%)
📊OAK試験⁴⁾ [2次治療以降]
プラチナ併用療法の治療歴を有するPS0~1の切除不能な進行・再発NSCLC患者を対象として、 アテゾリズマブ単剤療法とドセタキセル単剤療法を比較した国際共同第Ⅲ相臨床試験 [本剤群613例、 ドセタキセル群612例]
【有効性】
- mOS : 13.8ヵ月 [主要評価項目]
- mPFS : 2.8ヵ月
- ORR : 14.0%
ITT集団、 TC1/2/3またはIC1/2/3集団のいずれにおいてもアテゾリズマブ単剤療法群で統計学的に有意に延長した。 PD-L1発現がない (TC0かつIC0) 集団でも、 アテゾリズマブ単剤療法群でOSを有意に延長した。
【安全性】主な副作用 (5%以上)
- 390例 (64.0%) に副作用が認められた
- 疲労87例 (14.3%)
- 悪心53例 (8.7%)
- 食欲減退52例 (8.5%)
- 無力症51例 (8.4%)
- 発熱49例 (8.0%)
- 下痢47例 (7.7%)
- 発疹42例 (6.9%)
- そう痒症38例 (6.2%)
レジメンの特徴と注意点
投与開始前の注意点
PD-L1の発現頻度により効果に差がある
- 1次治療 : SP142で評価 (TC3ないしはIC3なことを確認する)
- 2次治療~ : PD-L1検査は必須ではない
- アジュバント : SP263で評価 (TC≧1%であることを確認する)
コンパニオン診断薬については「肺癌患者におけるPD-L1検査の手引き⁴⁾」を参照する。
副作用と対策
本剤のT細胞活性化作用により、 過度の免疫反応に起因すると考えられる様々な疾患や病態 (irAE) が現れることがあり、以下が推奨される。
- 内分泌機能検査 (TSH、 FT4、 ACTHなど) を定期的に実施し、モニタリングする。
- その他尿検査や画像評価などの定期的なモニタリングも必要である。
- 有害事象が疑われた場合には、 各専門医へのコンサルトも検討する。
出典
1) 中外製薬株式会社. テセントリク®点滴静注電子添文情報 2025年9月改訂 第10版.
2) 中外製薬株式会社. テセントリク®︎適正使用ガイド 2025年9月改訂.
最終更新日 : 2025年10月20日
監修・作図 : HOKUTO編集部専門医
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




