Atezolizumab+CBDCA+nab-PTX
アテゾリズマブ+カルボプラチン+nab-パクリタキセル
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テセントリク®点滴静注 (アテゾリズマブ)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】3週間 (維持療法は3又は4週間)
【催吐性】 中等度催吐性*
【FN発症】低リスク**
*CBDCA併用レジメンは、 CBDCA AUC≧4の場合、 5-HT3受容体拮抗薬、 デキサメタゾン、 NK1受容体拮抗薬を併用
**IMpower130試験のFN発生率0.4%³⁾を基に編集部が分類
化学療法併用 (1~4又は6コース) :
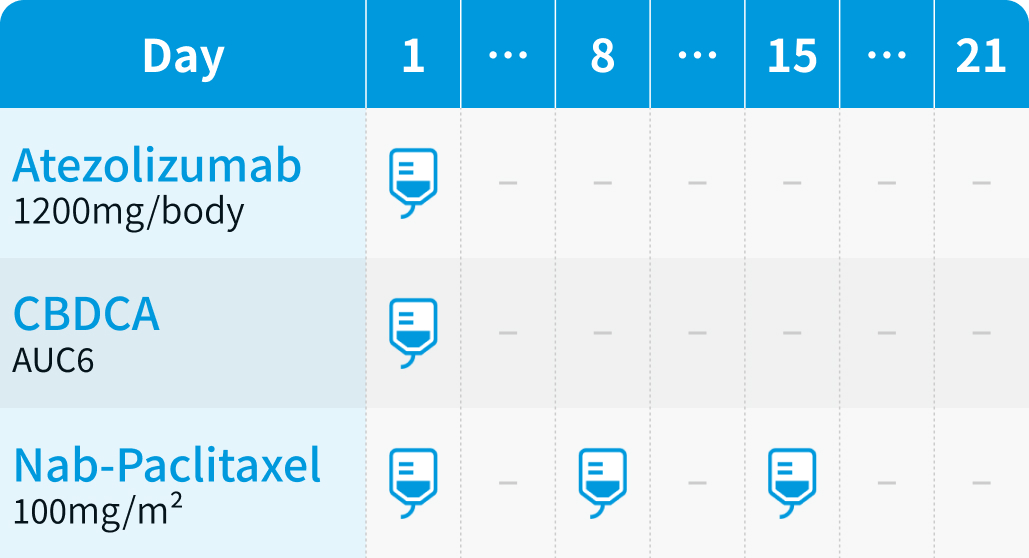
維持療法 :

アテゾリズマブは初回60分で点滴静注し、 忍容性良好なら2回目以降は30分まで短縮可能。
2025年9月19日、 1回1680mgを4週間ごとに点滴静注する用法・用量が追加承認された。
👨⚕️q4wの追加承認により、 単剤療法の利便性が向上した。 一方で、 併用療法においてはq4w投与が未承認である点に留意が必要である。
和歌山県立医科大学附属病院 赤松弘朗先生
Key Data|臨床試験結果
IMpower130試験¹⁾
主な有害事象(カッコ内はGrade3~4)
Lancet Oncol. 2019 Jul;20(7):924-937.より引用
- 貧血 52.4% (29.2%)
- 好中球減少症 46.1% (32.1%)
- 血小板減少症 26.8% (9.5%)
- 血小板数減少 22.2% (7.8%)
- 好中球数減少 19.7% (12.1%)
- 悪心 43.8% (2.7%)
- 倦怠感 39.1% (6.1%)
- 下痢 31.7% (4.9%)
- 脱毛症 30.7% (0%)
- 食欲減退 22.6% (1.5%)
- 嘔吐 20.9% (1.9%)
- 便秘 15.4% (0.2%)
- 白血球数減少 10.8% (6.6%)
各プロトコル
投与開始基準
IMpower130試験¹⁾
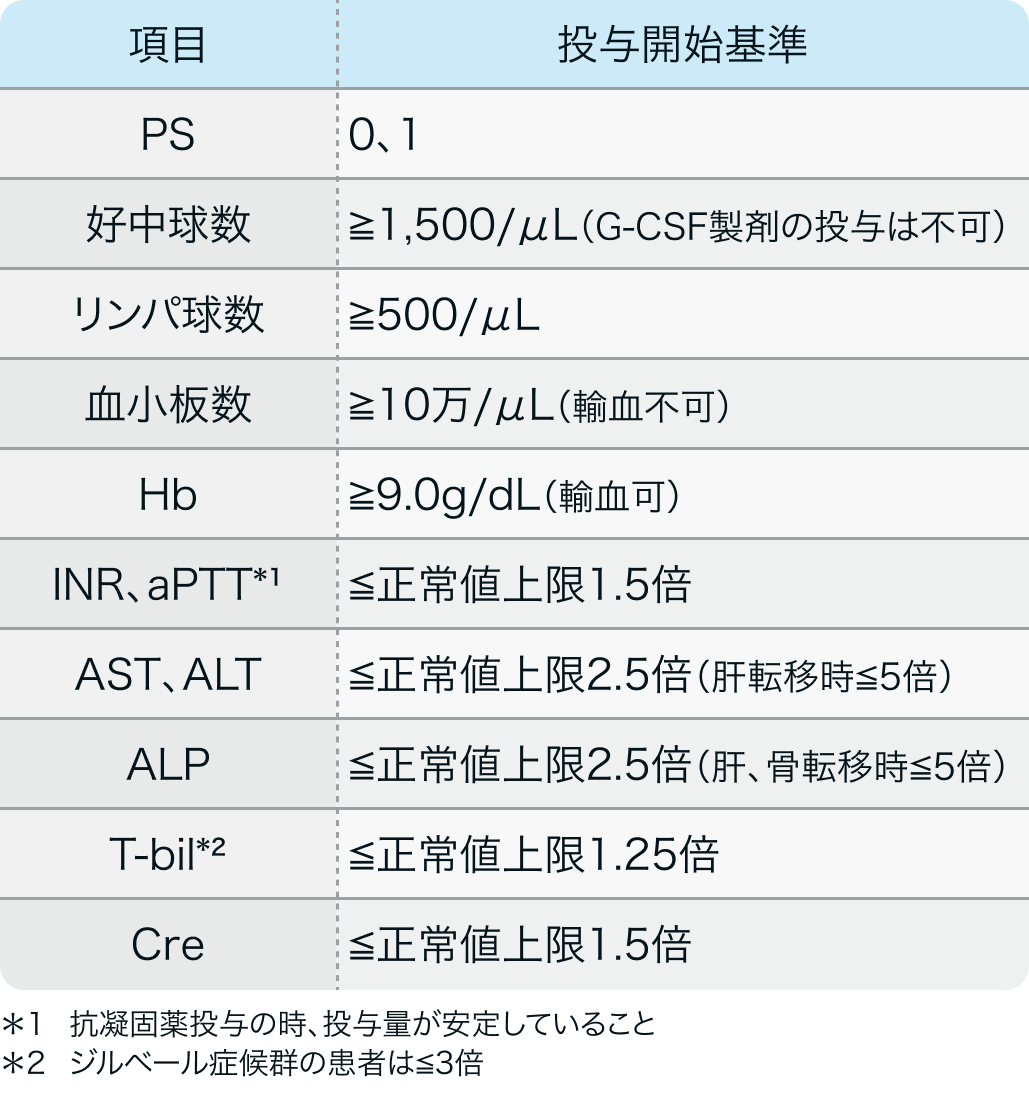
Lancet Oncol. 2019 Jul;20(7):924-937.より作図
減量・休薬・中止基準
アテゾリズマブ²⁾³⁾
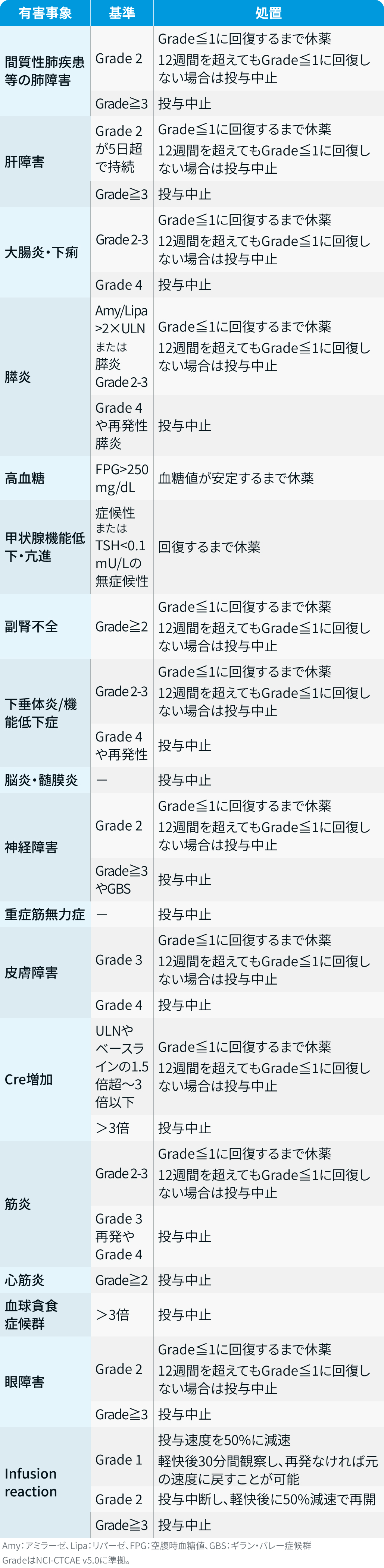
テセントリク®電子添文より作図
nab-パクリタキセル⁵⁾⁶⁾
好中球数及び血小板数の変動に留意する
- 好中球数が<1,500/μL又は血小板数が<10万/μLであれば、 骨髄機能が回復するまで投与を延期すること。
- 同一コース内の投与にあたっては、 投与前の臨床検査で好中球数が<500/μLまたは血小板数が<5万/μLであれば、 骨髄機能が回復するまで投与を延期すること。
- 投与後、 好中球数が7日間以上にわたって<500/μLとなった場合、 血小板数が<5万/μLとなった場合、 または発熱性好中球減少症が発現した場合、 更に次コース投与開始が7日間以上延期となる好中球減少が発現した場合も次コースの投与量を減量すること。
- Grade3の末梢神経障害が発現した場合には、 軽快又は回復 (≦Grade1) するまで投与を延期し、 次回の投与量を減量すること。
初回基準量と減量レベル
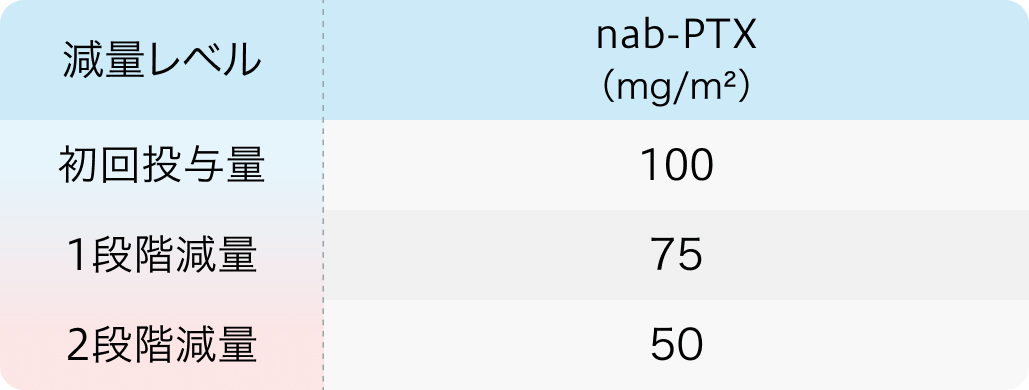
アブラキサン®電子添文より作図
減量・休薬・中止基準を参考に用量を調整する
出典
2) 中外製薬株式会社. テセントリク®点滴静注電子添文情報 2025年9月改訂 第10版 [最終閲覧:2025/10/20]
3) 中外製薬株式会社. テセントリク®︎適正使用ガイド 2025年9月改訂 [最終閲覧:2025/10/20]
最終更新日 : 2025年10月20日
監修医師 : HOKUTO編集部監修医師
Atezolizumab+CBDCA+nab-PTX
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テセントリク®点滴静注 (アテゾリズマブ)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】3週間 (維持療法は3又は4週間)
【催吐性】 中等度催吐性*
【FN発症】低リスク**
*CBDCA併用レジメンは、 CBDCA AUC≧4の場合、 5-HT3受容体拮抗薬、 デキサメタゾン、 NK1受容体拮抗薬を併用
**IMpower130試験のFN発生率0.4%³⁾を基に編集部が分類
化学療法併用 (1~4又は6コース) :

維持療法 :

アテゾリズマブは初回60分で点滴静注し、 忍容性良好なら2回目以降は30分まで短縮可能。
2025年9月19日、 1回1680mgを4週間ごとに点滴静注する用法・用量が追加承認された。
👨⚕️q4wの追加承認により、 単剤療法の利便性が向上した。 一方で、 併用療法においてはq4w投与が未承認である点に留意が必要である。
和歌山県立医科大学附属病院 赤松弘朗先生
Key Data|臨床試験結果
IMpower130試験¹⁾
主な有害事象(カッコ内はGrade3~4)
Lancet Oncol. 2019 Jul;20(7):924-937.より引用
- 貧血 52.4% (29.2%)
- 好中球減少症 46.1% (32.1%)
- 血小板減少症 26.8% (9.5%)
- 血小板数減少 22.2% (7.8%)
- 好中球数減少 19.7% (12.1%)
- 悪心 43.8% (2.7%)
- 倦怠感 39.1% (6.1%)
- 下痢 31.7% (4.9%)
- 脱毛症 30.7% (0%)
- 食欲減退 22.6% (1.5%)
- 嘔吐 20.9% (1.9%)
- 便秘 15.4% (0.2%)
- 白血球数減少 10.8% (6.6%)
各プロトコル
投与開始基準
IMpower130試験¹⁾

Lancet Oncol. 2019 Jul;20(7):924-937.より作図
減量・休薬・中止基準
アテゾリズマブ²⁾³⁾

テセントリク®電子添文より作図
nab-パクリタキセル⁵⁾⁶⁾
好中球数及び血小板数の変動に留意する
- 好中球数が<1,500/μL又は血小板数が<10万/μLであれば、 骨髄機能が回復するまで投与を延期すること。
- 同一コース内の投与にあたっては、 投与前の臨床検査で好中球数が<500/μLまたは血小板数が<5万/μLであれば、 骨髄機能が回復するまで投与を延期すること。
- 投与後、 好中球数が7日間以上にわたって<500/μLとなった場合、 血小板数が<5万/μLとなった場合、 または発熱性好中球減少症が発現した場合、 更に次コース投与開始が7日間以上延期となる好中球減少が発現した場合も次コースの投与量を減量すること。
- Grade3の末梢神経障害が発現した場合には、 軽快又は回復 (≦Grade1) するまで投与を延期し、 次回の投与量を減量すること。
初回基準量と減量レベル

アブラキサン®電子添文より作図
減量・休薬・中止基準を参考に用量を調整する
出典
2) 中外製薬株式会社. テセントリク®点滴静注電子添文情報 2025年9月改訂 第10版 [最終閲覧:2025/10/20]
3) 中外製薬株式会社. テセントリク®︎適正使用ガイド 2025年9月改訂 [最終閲覧:2025/10/20]
最終更新日 : 2025年10月20日
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




