Alectinib
アレクチニブ (アレセンサ®)
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
アレセンサ®カプセル (アレクチニブ)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与
【催吐性】 軽度催吐性
【FN発症】低リスク
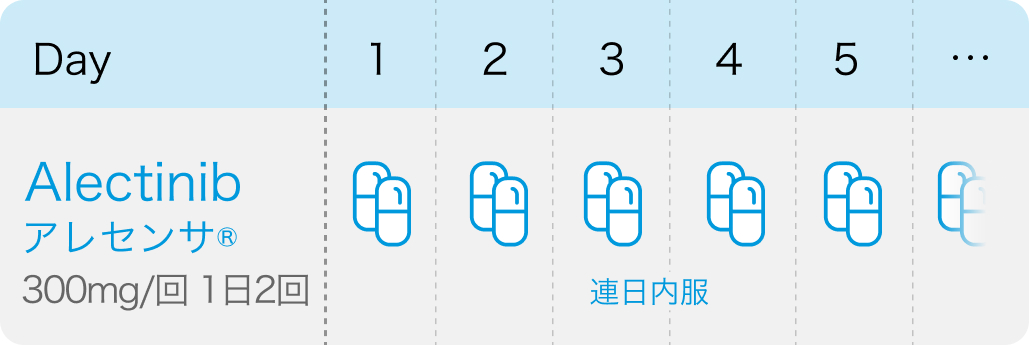
ALK融合遺伝子陽性の切除不能な進行・再発のNSCLC: 成人には1回300mgを1日2回経口投与
アレセンサ®添付文書 (2024年8月改訂第2版)¹⁾より引用
※術後補助療法の場合は用量が倍になるため注意 (期間2年間)
KeyData|臨床試験結果
📊 ALEX試験 [海外]³⁾ (PS 0~1)
NEJM. 2017 Aug 31;377(9):829-38.
ALK阻害薬未治療・化学療法歴は1レジメン以下のALK陽性進行期NSCLC患者を対象に、 アレクチニブ (600mg 1日2回) とクリゾチニブ (250mg 1日2回)を比較した国際共同無作為化非盲検第3相試験 (アレクチニブ群 152例 vs クリゾチニブ群 151例)。 主要評価項目はPFS。J-ALEX試験との相違点は、 投与量が600mg 1日2回と倍量であることと、 層別化因子に脳転移の有無が加えられている点
【有効性】アレクチニブ群
- ORR : 82.9%
- mPFS : 未到達 (17.7ヵ月-未到達)
- CNS転移あり HR=0.40 (95%CI : 0.25-0.64)
- CNS転移なし HR=0.51(95%CI : 0.33-0.80)
📊 J-ALEX試験 [国内]⁴⁾⁵⁾ (PS 0~1)
Lancet. 2017 Jul 1;390(10089):29-39. / Lung Cancer. 2020 Jan;139:195-199.
ALK阻害薬未治療・化学療法歴は1レジメン以下の日本人ALK陽性進行期NSCLC患者を対象に、 アレクチニブ (300mg 1日2回) とクリゾチニブ (250mg 1日2回) を比較した国内無作為化非盲検第3相試験 (アレクチニブ群 103例 vs クリゾチニブ群 104例)。 主要評価項目はPFS。
【有効性】アレクチニブ群
- ORR : 92%
- mPFS : 34.1ヵ月
📊LOGiK1401試験 [国内]⁶⁾⁷⁾ (PS 2~4)
ALK融合遺伝子陽性のPS不良患者を対象として、 アレクチニブ単剤療法の有効性および安全性を評価した第Ⅱ相試験。 対象患者は計18例 (PS2: 12例、 PS3: 5例、 PS4: 1例)。
【有効性】アレクチニブ群
- ORR : 72.2%
- mPFS : 16.2ヵ月
- mOS : 30.3ヵ月
各プロトコル
休薬・中止基準
アレセンサ®適正使用ガイド 肺癌の記載
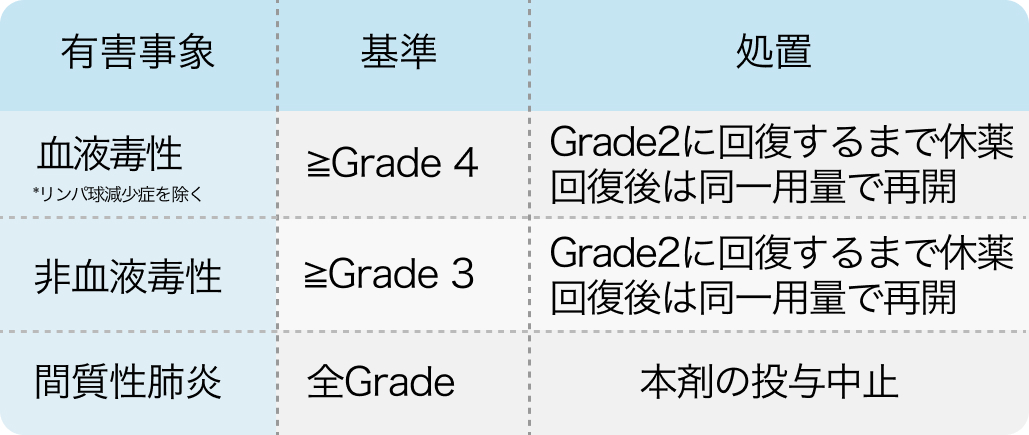
間質性肺疾患が疑われる場合には、 直ちに休薬する。 その後CT検査等による適切な検査を実施し、 間質性肺疾患と診断された場合にはGradeに関わらず投与を中止する¹⁾。
アレセンサ®適正使用ガイド 肺癌 (2024年8月改訂)²⁾より引用
減量・中止する場合の用量
アレセンサ®適正使用ガイド 肺癌の記載
減量設定なし、忍容性が得られない場合は中止¹⁾
アレセンサ®適正使用ガイド 肺癌 (2024年8月改訂)²⁾より引用
特徴と注意点
国内で2番目に承認された第2世代ALK阻害薬。 ALK陽性進行NSCLCは、 NSCLCの3~5%で認められ、 特に若年者や非喫煙者に多い⁴⁾。 2024年8月に新たに 「ALK融合遺伝子陽性のNSCLCにおける術後補助療法」 として承認された。
👨⚕️監修医師コメント : ALK阻害剤の中で忍容性は極めて高い。 術後補助療法の場合は用量が倍になるため注意 (投与期間2年間)
>ALK融合遺伝子陽性のNSCLC術後補助療法レジメンはこちら
>再発又は難治性のALK陽性ALCLのレジメンについてはこちら
遺伝子パネル検査・コンパニオン診断
日本肺癌学会の各種手引き⁸⁾やHOKUTO編集部のまとめコンテンツを参照ください。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
肺癌診療ガイドライン2025の推奨⁹⁾
臨床試験の結果を基に下記推奨となっている。
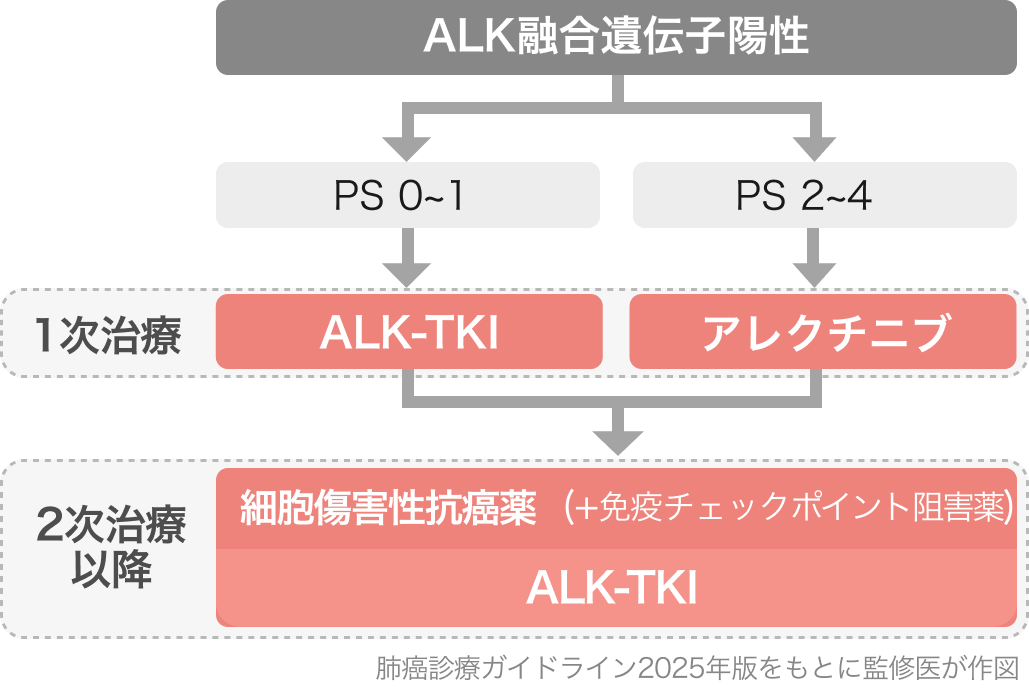
▼1次治療 (PS 0-1)
・ アレクチニブ (Alectinib) [強く推奨 1A]
・ ロルラチニブ (Lorlatinib) [強く推奨 1B]
・ ブリグチニブ (Brigatinib) [弱く推奨 2B]
▼1次治療 (PS 2-4)
・ アレクチニブ (Alectinib) [強く推奨 1C]
▼2次治療 (アレクチニブ耐性または増悪後)
・ ブリグチニブ (Brigatinib) [弱く推奨 2C]
・ ロルラチニブ (Lorlatinib) [弱く推奨 2C]
・ セリチニブ (Ceritinib) [弱く推奨 2C]
出典
1) 中外製薬株式会社 「アレセンサ®カプセル 添付文書」 (2024年8月改訂第2版) [最終確認 2025/10/12]
2) 中外製薬株式会社 「アレセンサ®適正使用ガイド」 (2024年8月改訂) [最終確認 2025/10/12]
8) 日本肺癌学会バイオマーカー委員会. 肺癌患者におけるALK融合遺伝子検査の手引き
9) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2025年11月13日
HOKUTO編集部医師監修
Alectinib
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
アレセンサ®カプセル (アレクチニブ)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与
【催吐性】 軽度催吐性
【FN発症】低リスク

ALK融合遺伝子陽性の切除不能な進行・再発のNSCLC: 成人には1回300mgを1日2回経口投与
アレセンサ®添付文書 (2024年8月改訂第2版)¹⁾より引用
※術後補助療法の場合は用量が倍になるため注意 (期間2年間)
KeyData|臨床試験結果
📊 ALEX試験 [海外]³⁾ (PS 0~1)
NEJM. 2017 Aug 31;377(9):829-38.
ALK阻害薬未治療・化学療法歴は1レジメン以下のALK陽性進行期NSCLC患者を対象に、 アレクチニブ (600mg 1日2回) とクリゾチニブ (250mg 1日2回)を比較した国際共同無作為化非盲検第3相試験 (アレクチニブ群 152例 vs クリゾチニブ群 151例)。 主要評価項目はPFS。J-ALEX試験との相違点は、 投与量が600mg 1日2回と倍量であることと、 層別化因子に脳転移の有無が加えられている点
【有効性】アレクチニブ群
- ORR : 82.9%
- mPFS : 未到達 (17.7ヵ月-未到達)
- CNS転移あり HR=0.40 (95%CI : 0.25-0.64)
- CNS転移なし HR=0.51(95%CI : 0.33-0.80)
📊 J-ALEX試験 [国内]⁴⁾⁵⁾ (PS 0~1)
Lancet. 2017 Jul 1;390(10089):29-39. / Lung Cancer. 2020 Jan;139:195-199.
ALK阻害薬未治療・化学療法歴は1レジメン以下の日本人ALK陽性進行期NSCLC患者を対象に、 アレクチニブ (300mg 1日2回) とクリゾチニブ (250mg 1日2回) を比較した国内無作為化非盲検第3相試験 (アレクチニブ群 103例 vs クリゾチニブ群 104例)。 主要評価項目はPFS。
【有効性】アレクチニブ群
- ORR : 92%
- mPFS : 34.1ヵ月
📊LOGiK1401試験 [国内]⁶⁾⁷⁾ (PS 2~4)
ALK融合遺伝子陽性のPS不良患者を対象として、 アレクチニブ単剤療法の有効性および安全性を評価した第Ⅱ相試験。 対象患者は計18例 (PS2: 12例、 PS3: 5例、 PS4: 1例)。
【有効性】アレクチニブ群
- ORR : 72.2%
- mPFS : 16.2ヵ月
- mOS : 30.3ヵ月
各プロトコル
休薬・中止基準
アレセンサ®適正使用ガイド 肺癌の記載

間質性肺疾患が疑われる場合には、 直ちに休薬する。 その後CT検査等による適切な検査を実施し、 間質性肺疾患と診断された場合にはGradeに関わらず投与を中止する¹⁾。
アレセンサ®適正使用ガイド 肺癌 (2024年8月改訂)²⁾より引用
減量・中止する場合の用量
アレセンサ®適正使用ガイド 肺癌の記載
減量設定なし、忍容性が得られない場合は中止¹⁾
アレセンサ®適正使用ガイド 肺癌 (2024年8月改訂)²⁾より引用
特徴と注意点
国内で2番目に承認された第2世代ALK阻害薬。 ALK陽性進行NSCLCは、 NSCLCの3~5%で認められ、 特に若年者や非喫煙者に多い⁴⁾。 2024年8月に新たに 「ALK融合遺伝子陽性のNSCLCにおける術後補助療法」 として承認された。
👨⚕️監修医師コメント : ALK阻害剤の中で忍容性は極めて高い。 術後補助療法の場合は用量が倍になるため注意 (投与期間2年間)
>ALK融合遺伝子陽性のNSCLC術後補助療法レジメンはこちら
>再発又は難治性のALK陽性ALCLのレジメンについてはこちら
遺伝子パネル検査・コンパニオン診断
日本肺癌学会の各種手引き⁸⁾やHOKUTO編集部のまとめコンテンツを参照ください。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
肺癌診療ガイドライン2025の推奨⁹⁾
臨床試験の結果を基に下記推奨となっている。

▼1次治療 (PS 0-1)
・ アレクチニブ (Alectinib) [強く推奨 1A]
・ ロルラチニブ (Lorlatinib) [強く推奨 1B]
・ ブリグチニブ (Brigatinib) [弱く推奨 2B]
▼1次治療 (PS 2-4)
・ アレクチニブ (Alectinib) [強く推奨 1C]
▼2次治療 (アレクチニブ耐性または増悪後)
・ ブリグチニブ (Brigatinib) [弱く推奨 2C]
・ ロルラチニブ (Lorlatinib) [弱く推奨 2C]
・ セリチニブ (Ceritinib) [弱く推奨 2C]
出典
1) 中外製薬株式会社 「アレセンサ®カプセル 添付文書」 (2024年8月改訂第2版) [最終確認 2025/10/12]
2) 中外製薬株式会社 「アレセンサ®適正使用ガイド」 (2024年8月改訂) [最終確認 2025/10/12]
8) 日本肺癌学会バイオマーカー委員会. 肺癌患者におけるALK融合遺伝子検査の手引き
9) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2025年11月13日
HOKUTO編集部医師監修
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




