Taletrectinib
タレトレクチニブ (イブトロジー®)
2025年3月3日、「ROS1融合遺伝子陽性の切除不能な進行・再発非小細胞肺がん」 を対象に承認申請し、 同年9月19日に正式承認、 11月12日に薬価収載・発売となった (200mg 1カプセル : 9,711.20円、 1日薬価 : 2万9,133.60円)。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
イブトロジー®カプセル (タレトレクチニブ)
*日本化薬株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】21日間
【催吐性】未分類
【FN発症】未報告*
*TRUST試験では未報告
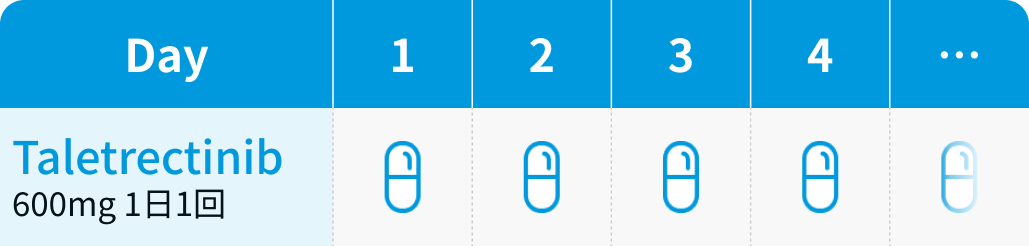
1日1回600mgを空腹時に経口投与する
※食事の前後2時間の服用は避けること
イブトロジー®電子添文情報¹⁾を基に編集部作成
Key Data|臨床試験結果
📊 TRUST試験
J Clin Oncol. 2025;43(16):1920-1929.
ROS1融合遺伝子陽性の進行NSCLC患者を対象とした第II相試験。 TRUST-Iは中国で実施され承認申請データの取得を目的とし、 TRUST-IIはグローバルに実施され国際的な有効性と安全性の検証を目的とした。 両試験の主要コホートを統合解析し、 主要評価項目は奏効率 (ORR) とされた。
【有効性】
ROS1-TKI未治療群 (n=160) :
- ORR 88.8%
- 奏効期間中央値 44.2ヵ月
- PFS中央値 45.6ヵ月
ROS1-TKI既治療群 (n=113) :
クリゾチニブ91.2%、 エヌトレクチニブ8.8%
- ORR 55.8%
- 奏効期間中央値 16.6ヵ月
- PFS中央値 9.7ヵ月
【安全性】主な有害事象 : 全Grade (Grade≧3)
- AST増加 71.9% (7.4%)
- ALT増加 67.6% (9.9%)
- 下痢 63.6% (2.0%)
- 悪心 46.3% (1.4%)
- 嘔吐 43.5% (1.7%)
- 貧血 36.6% (3.4%)
- 浮動性めまい 21.3% (0.3%)
- 便秘 20.7% (0)
- 血中ビリルビン増加 18.5% (1.1%)
- QT間隔延長 18.5% (3.4%)
- 血中クレアチニン増加 17.9% (0)
- 好中球数減少 17.3% (4.8%)
- 食欲減退 16.8% (0.3%)
- 白血球数減少 16.8% (1.7%)
- 血中CPK増加 15.9% (2.0%)
- 味覚異常 15.1% (0)
各プロトコル
適格基準
TRUST-I / TRUST-II試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球数≧1,500/mm³
- 血小板数≧10万/mm³
- ヘモグロビン≧9.0g/dL
- 腎機能: 血清クレアチニン≦1.5×ULN
- 肝機能: T-Bil≦1.5×ULN、 AST/ALT≦3×ULN
- QTcF≦470msec
用量レベル
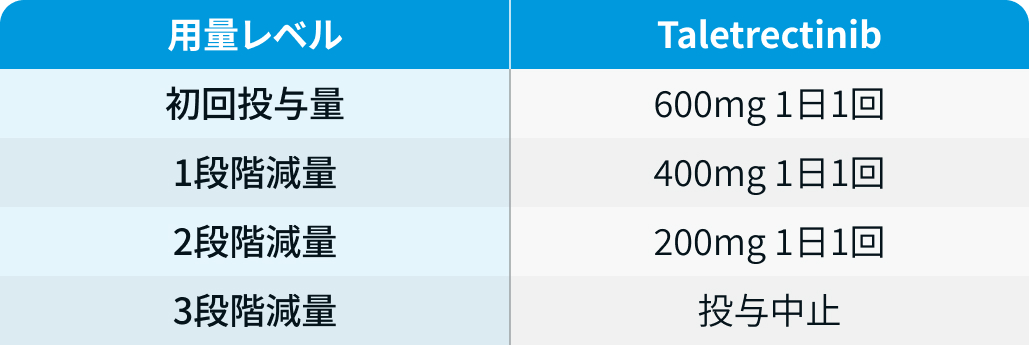
イブトロジー®電子添文情報¹⁾を基に編集部作成
腎障害患者に対する用量調整
尿中未変化体排泄率は2.88%と低く、 腎クリアランスの寄与は小さいため、 腎障害時の用量調整は不要と考えられる。
イブトロジー®電子添文情報¹⁾を基に編集部が評価
有害事象発現時の減量・休薬・中止基準
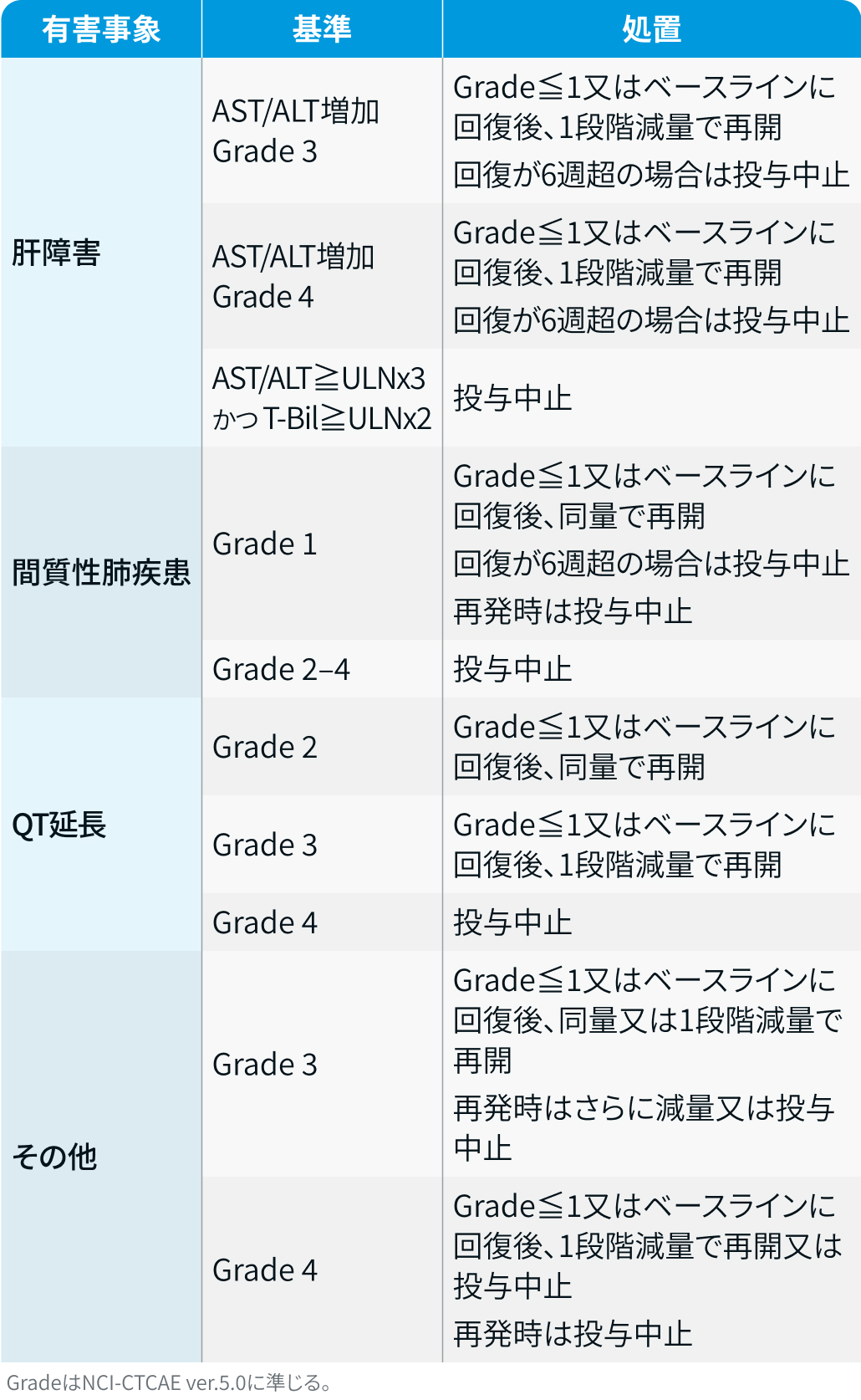
イブトロジー®電子添文情報¹⁾を基に編集部作成
レジメンの特徴と注意点
作用機序の特徴
タレトレクチニブはROS1などを標的とするチロシンキナーゼ阻害薬で、 ROS1融合タンパクのリン酸化を阻害し腫瘍増殖を抑制すると考えられている¹⁾。
また、 CNS活性を有し、 代表的な耐性変異であるG2032Rを含むROS1耐性変異に対しても効果が期待される点が特徴である³⁾。
レジメン適用時の注意事項
肝障害 : 投与開始前及び投与中は定期的に肝機能検査を行い、 状態を十分に確認
間質性肺疾患 : 呼吸困難・咳嗽・発熱などの初期症状確認や胸部画像検査を実施し観察、 初期症状の発現時は速やかに受診するよう説明
QT間隔延長 : 投与開始前及び投与中は定期的に心電図及び電解質検査 (カリウム、 マグネシウム、 カルシウム等) を行い、 状態を十分に確認
RMP【重要な特定されたリスク】
イブトロジー® RMP : 医薬品リスク管理計画書
- 間質性肺疾患
- 肝機能障害
- QT間隔延長
コンパニオン診断薬の情報
本剤の適応判定に利用可能なコンパニオン診断薬は以下のとおり。
- AmoyDx®︎肺癌マルチ遺伝子PCRパネル
HOKUTOレジメンツールに遷移します
肺癌診療ガイドライン2025の推奨⁴⁾

1次治療として、 ROS1-TKI単剤療法 (クリゾチニブ、 エヌトレクチニブ、 レポトレクチニブ、 タレトレクチニブのいずれか) を行うよう強く推奨されている。 いずれも推奨とエビデンスの強さは横並びの1Cである。
- Repotrectinib (オータイロ®)
- Crizotinib (ザーコリ®︎)
- Entrectinib (ロズリートレク®︎)
- Taletrectinib (イブトロジー®)
出典
- 日本化薬株式会社. イブトロジーカプセル 200mg 電子添文 2025年9月作成 第1版.
- 日本化薬株式会社. イブトロジーカプセル 200mg メディカルINFOナビ.
- J Clin Oncol. 2025;43(16):1920-1929.
- 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新 : 2025年11月13日
執筆 : HOKUTO編集部がん専門・指導薬剤師
監修医師 : HOKUTO編集部 医師
Taletrectinib
2025年3月3日、「ROS1融合遺伝子陽性の切除不能な進行・再発非小細胞肺がん」 を対象に承認申請し、 同年9月19日に正式承認、 11月12日に薬価収載・発売となった (200mg 1カプセル : 9,711.20円、 1日薬価 : 2万9,133.60円)。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
イブトロジー®カプセル (タレトレクチニブ)
*日本化薬株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】21日間
【催吐性】未分類
【FN発症】未報告*
*TRUST試験では未報告

1日1回600mgを空腹時に経口投与する
※食事の前後2時間の服用は避けること
イブトロジー®電子添文情報¹⁾を基に編集部作成
Key Data|臨床試験結果
📊 TRUST試験
J Clin Oncol. 2025;43(16):1920-1929.
ROS1融合遺伝子陽性の進行NSCLC患者を対象とした第II相試験。 TRUST-Iは中国で実施され承認申請データの取得を目的とし、 TRUST-IIはグローバルに実施され国際的な有効性と安全性の検証を目的とした。 両試験の主要コホートを統合解析し、 主要評価項目は奏効率 (ORR) とされた。
【有効性】
ROS1-TKI未治療群 (n=160) :
- ORR 88.8%
- 奏効期間中央値 44.2ヵ月
- PFS中央値 45.6ヵ月
ROS1-TKI既治療群 (n=113) :
クリゾチニブ91.2%、 エヌトレクチニブ8.8%
- ORR 55.8%
- 奏効期間中央値 16.6ヵ月
- PFS中央値 9.7ヵ月
【安全性】主な有害事象 : 全Grade (Grade≧3)
- AST増加 71.9% (7.4%)
- ALT増加 67.6% (9.9%)
- 下痢 63.6% (2.0%)
- 悪心 46.3% (1.4%)
- 嘔吐 43.5% (1.7%)
- 貧血 36.6% (3.4%)
- 浮動性めまい 21.3% (0.3%)
- 便秘 20.7% (0)
- 血中ビリルビン増加 18.5% (1.1%)
- QT間隔延長 18.5% (3.4%)
- 血中クレアチニン増加 17.9% (0)
- 好中球数減少 17.3% (4.8%)
- 食欲減退 16.8% (0.3%)
- 白血球数減少 16.8% (1.7%)
- 血中CPK増加 15.9% (2.0%)
- 味覚異常 15.1% (0)
各プロトコル
適格基準
TRUST-I / TRUST-II試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 好中球数≧1,500/mm³
- 血小板数≧10万/mm³
- ヘモグロビン≧9.0g/dL
- 腎機能: 血清クレアチニン≦1.5×ULN
- 肝機能: T-Bil≦1.5×ULN、 AST/ALT≦3×ULN
- QTcF≦470msec
用量レベル

イブトロジー®電子添文情報¹⁾を基に編集部作成
腎障害患者に対する用量調整
尿中未変化体排泄率は2.88%と低く、 腎クリアランスの寄与は小さいため、 腎障害時の用量調整は不要と考えられる。
イブトロジー®電子添文情報¹⁾を基に編集部が評価
有害事象発現時の減量・休薬・中止基準

イブトロジー®電子添文情報¹⁾を基に編集部作成
レジメンの特徴と注意点
作用機序の特徴
タレトレクチニブはROS1などを標的とするチロシンキナーゼ阻害薬で、 ROS1融合タンパクのリン酸化を阻害し腫瘍増殖を抑制すると考えられている¹⁾。
また、 CNS活性を有し、 代表的な耐性変異であるG2032Rを含むROS1耐性変異に対しても効果が期待される点が特徴である³⁾。
レジメン適用時の注意事項
肝障害 : 投与開始前及び投与中は定期的に肝機能検査を行い、 状態を十分に確認
間質性肺疾患 : 呼吸困難・咳嗽・発熱などの初期症状確認や胸部画像検査を実施し観察、 初期症状の発現時は速やかに受診するよう説明
QT間隔延長 : 投与開始前及び投与中は定期的に心電図及び電解質検査 (カリウム、 マグネシウム、 カルシウム等) を行い、 状態を十分に確認
RMP【重要な特定されたリスク】
イブトロジー® RMP : 医薬品リスク管理計画書
- 間質性肺疾患
- 肝機能障害
- QT間隔延長
コンパニオン診断薬の情報
本剤の適応判定に利用可能なコンパニオン診断薬は以下のとおり。
- AmoyDx®︎肺癌マルチ遺伝子PCRパネル
HOKUTOレジメンツールに遷移します
肺癌診療ガイドライン2025の推奨⁴⁾

1次治療として、 ROS1-TKI単剤療法 (クリゾチニブ、 エヌトレクチニブ、 レポトレクチニブ、 タレトレクチニブのいずれか) を行うよう強く推奨されている。 いずれも推奨とエビデンスの強さは横並びの1Cである。
- Repotrectinib (オータイロ®)
- Crizotinib (ザーコリ®︎)
- Entrectinib (ロズリートレク®︎)
- Taletrectinib (イブトロジー®)
出典
- 日本化薬株式会社. イブトロジーカプセル 200mg 電子添文 2025年9月作成 第1版.
- 日本化薬株式会社. イブトロジーカプセル 200mg メディカルINFOナビ.
- J Clin Oncol. 2025;43(16):1920-1929.
- 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新 : 2025年11月13日
執筆 : HOKUTO編集部がん専門・指導薬剤師
監修医師 : HOKUTO編集部 医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




