Degarelix
デガレリクス (ゴナックス®)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ゴナックス® (添付文書¹⁾)
Gn-RHアンタゴニスト デガレリクス
投与スケジュール
❶初回投与 : 240mg (120mgずつ2カ所)
成人には初回は240mgを1カ所あたり120mgずつ腹部2カ所に皮下投与する。 2回目以降は、 初回投与4週間後より、 維持用量を投与する。
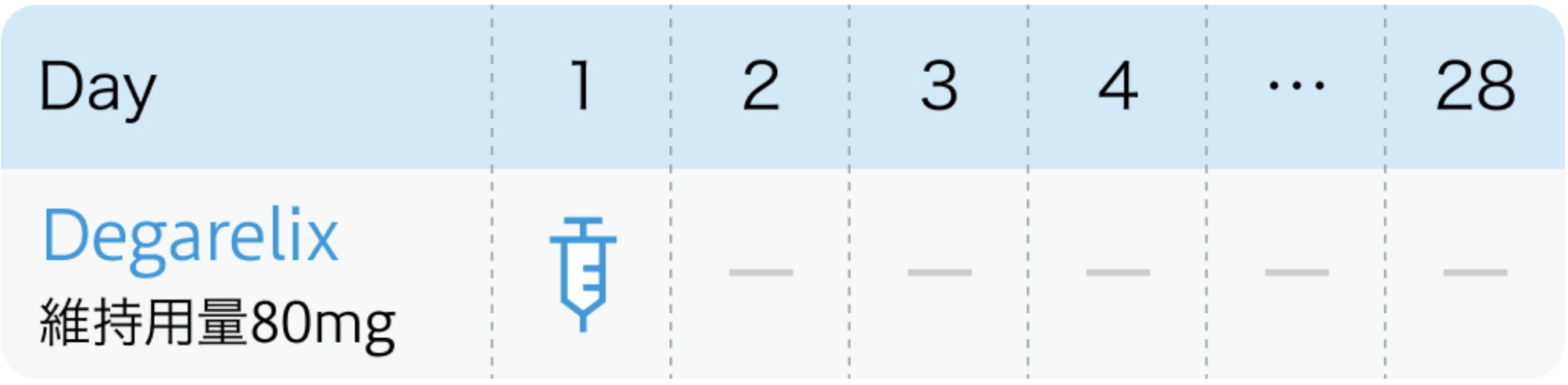
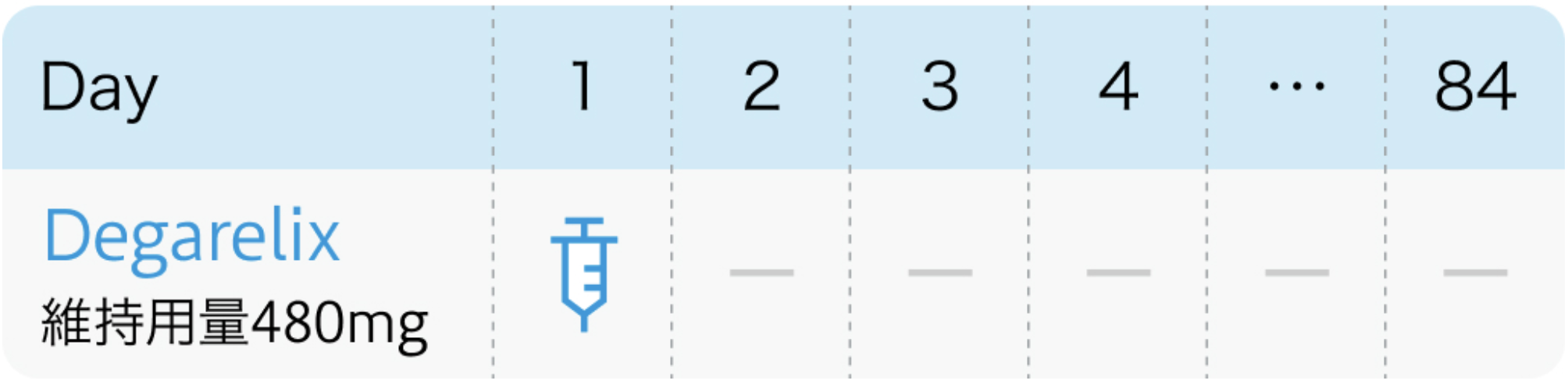
❷維持投与 : 4週毎80mg or 12週毎480mg
4週間間隔で投与を繰り返す場合、 80mgを維持用量とし、 腹部1カ所に皮下投与。 12週間間隔で投与を繰り返す場合、 480mgを維持用量とし、 1カ所あたり240mgずつ腹部2カ所に皮下投与。
ゴナックス®電子添文 (2023年11月改訂 第3版)¹⁾より引用
4週間間隔の場合
12週間間隔の場合
ゴナックス®電子添文 (2023年11月改訂 第3版)¹⁾より作図、 引用
特徴と注意点
日本で初めて前立腺癌を適応症とした性腺刺激ホルモン放出ホルモン(GnRH)アンタゴニスト製剤である。 本薬剤は、 LH-RH刺激を経ずにアンドロゲン受容体遮断が可能である
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
CS21試験²⁾
BJU Int. 2008 Dec;102(11):1531-8.
内分泌療法が適応とされた前立腺癌患者において、 GnRHアンタゴニストであるデガレリクスの効果を、 リュープロレリンを対照に検証した第Ⅲ相無作為化比較試験CS21の結果より、 1年間のテストステロン値の低値維持における非劣性が示された。
テストステロン奏効率
- デガレリクス (240/80mg) 群 : 97.2%
- デガレリクス (240/160mg) 群 : 98.3%
- リュープロレリン群 : 96.4%
3日目のテストステロン中央値
- デガレリクス (240/80mg) 群 : 0.24ng/mL
- デガレリクス (240/160mg) 群 : 0.26ng/mL
- リュープロレリン群 : 6.30ng/mL
28-364日目までのテストステロン中央値
- デガレリクス (240/80mg) 群 : 0.082ng/mL
- デガレリクス (240/160mg) 群 : 0.088ng/mL
- リュープロレリン群 : 0.078ng/mL
252日目のテストステロン値 vs 255日目および/または259日目のテストステロン値
252日目と比較し、 240/80mg群と240/160mg群では平均テストステロン値はわずかに減少したが、 リュープロレリン群では平均0.045ng/mLの有意な増加がみられた (p<0.001)。
ベースラインから14日後までのPSA変化率
- デガレリクス (240/80mg) 群 : 64%
- デガレリクス (240/160mg) 群 : 65%
- リュープロレリン群 : 18%
ベースラインから28日後までのPSA変化率
- デガレリクス (240/80mg) 群 : 85%
- デガレリクス (240/160mg) 群 : 83%
- リュープロレリン群 : 68%
PSA評価による治療失敗までの期間
- デガレリクス (240/80mg) 群 : 8.9%
- デガレリクス (240/160mg) 群 : 14.2%
- リュープロレリン群 : 14.1%
LHとFSHの経時的変化
- デガレリクス投与の2群では、 LHとFSHの中央値は投与後に急速に低下し、 試験終了まで抑制されていた。
- リュープロレリン群では、 投与開始時にLHとFSHの中央値が上昇し、 FSHはデガレリクスの2群と同程度には低下しなかった。
試験終了時のベースラインと比較した平均FSH値の低下率
- デガレリクス (240/80mg) 群 : 88.5%
- デガレリクス (240/160mg) 群 : 89.0%
- リュープロレリン群 : 54.8%
主な有害事象 (カッコ内はGrade3~4)
維持用量80mg
- ALT増加 9.7% (0%)
- AST増加 5.3% (0%)
- 体重増加 8.7% (0%)
- 便秘 5.3% (0%)
- 悪心 4.3% (0%)
- 疲労 3.4% (0%)
注意すべき有害事象(カッコ内はGrade3~4)
- 高血圧 5.8% (0.5%)
- 高コレステロール血症 3.4% (0%)
維持用量160mg
- ALT増加 8.4% (1.0%)
- AST増加 5.0% (0%)
- 体重増加 10.9% (0.5%)
- 疲労 6.4% (0%)
- 悪心 5.4% (0%)
- 便秘 3.0% (0%)
注意すべき有害事象(カッコ内はGrade3~4)
- 高血圧 6.9% (0%)
- 高コレステロール血症 5.9% (0.5%)
BJU Int. 2008 Dec;102(11):1531-8²⁾より引用
出典
- フェリング・ファーマ株式会社. ゴナックス®電子添文 (2023年11月改訂 第3版) [最終閲覧 : 2025/1/3]
- The efficacy and safety of degarelix: a 12-month, comparative, randomized, open-label, parallel-group phase III study in patients with prostate cancer. BJU Int. 2008 Dec;102(11):1531-8. PMID: 19035858
最終更新日 : 2025年1月3日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
Degarelix
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ゴナックス® (添付文書¹⁾)
Gn-RHアンタゴニスト デガレリクス
投与スケジュール
❶初回投与 : 240mg (120mgずつ2カ所)
成人には初回は240mgを1カ所あたり120mgずつ腹部2カ所に皮下投与する。 2回目以降は、 初回投与4週間後より、 維持用量を投与する。
❷維持投与 : 4週毎80mg or 12週毎480mg
4週間間隔で投与を繰り返す場合、 80mgを維持用量とし、 腹部1カ所に皮下投与。 12週間間隔で投与を繰り返す場合、 480mgを維持用量とし、 1カ所あたり240mgずつ腹部2カ所に皮下投与。
ゴナックス®電子添文 (2023年11月改訂 第3版)¹⁾より引用
4週間間隔の場合

12週間間隔の場合

ゴナックス®電子添文 (2023年11月改訂 第3版)¹⁾より作図、 引用
特徴と注意点
日本で初めて前立腺癌を適応症とした性腺刺激ホルモン放出ホルモン(GnRH)アンタゴニスト製剤である。 本薬剤は、 LH-RH刺激を経ずにアンドロゲン受容体遮断が可能である
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
CS21試験²⁾
BJU Int. 2008 Dec;102(11):1531-8.
内分泌療法が適応とされた前立腺癌患者において、 GnRHアンタゴニストであるデガレリクスの効果を、 リュープロレリンを対照に検証した第Ⅲ相無作為化比較試験CS21の結果より、 1年間のテストステロン値の低値維持における非劣性が示された。
テストステロン奏効率
- デガレリクス (240/80mg) 群 : 97.2%
- デガレリクス (240/160mg) 群 : 98.3%
- リュープロレリン群 : 96.4%
3日目のテストステロン中央値
- デガレリクス (240/80mg) 群 : 0.24ng/mL
- デガレリクス (240/160mg) 群 : 0.26ng/mL
- リュープロレリン群 : 6.30ng/mL
28-364日目までのテストステロン中央値
- デガレリクス (240/80mg) 群 : 0.082ng/mL
- デガレリクス (240/160mg) 群 : 0.088ng/mL
- リュープロレリン群 : 0.078ng/mL
252日目のテストステロン値 vs 255日目および/または259日目のテストステロン値
252日目と比較し、 240/80mg群と240/160mg群では平均テストステロン値はわずかに減少したが、 リュープロレリン群では平均0.045ng/mLの有意な増加がみられた (p<0.001)。
ベースラインから14日後までのPSA変化率
- デガレリクス (240/80mg) 群 : 64%
- デガレリクス (240/160mg) 群 : 65%
- リュープロレリン群 : 18%
ベースラインから28日後までのPSA変化率
- デガレリクス (240/80mg) 群 : 85%
- デガレリクス (240/160mg) 群 : 83%
- リュープロレリン群 : 68%
PSA評価による治療失敗までの期間
- デガレリクス (240/80mg) 群 : 8.9%
- デガレリクス (240/160mg) 群 : 14.2%
- リュープロレリン群 : 14.1%
LHとFSHの経時的変化
- デガレリクス投与の2群では、 LHとFSHの中央値は投与後に急速に低下し、 試験終了まで抑制されていた。
- リュープロレリン群では、 投与開始時にLHとFSHの中央値が上昇し、 FSHはデガレリクスの2群と同程度には低下しなかった。
試験終了時のベースラインと比較した平均FSH値の低下率
- デガレリクス (240/80mg) 群 : 88.5%
- デガレリクス (240/160mg) 群 : 89.0%
- リュープロレリン群 : 54.8%
主な有害事象 (カッコ内はGrade3~4)
維持用量80mg
- ALT増加 9.7% (0%)
- AST増加 5.3% (0%)
- 体重増加 8.7% (0%)
- 便秘 5.3% (0%)
- 悪心 4.3% (0%)
- 疲労 3.4% (0%)
注意すべき有害事象(カッコ内はGrade3~4)
- 高血圧 5.8% (0.5%)
- 高コレステロール血症 3.4% (0%)
維持用量160mg
- ALT増加 8.4% (1.0%)
- AST増加 5.0% (0%)
- 体重増加 10.9% (0.5%)
- 疲労 6.4% (0%)
- 悪心 5.4% (0%)
- 便秘 3.0% (0%)
注意すべき有害事象(カッコ内はGrade3~4)
- 高血圧 6.9% (0%)
- 高コレステロール血症 5.9% (0.5%)
BJU Int. 2008 Dec;102(11):1531-8²⁾より引用
出典
- フェリング・ファーマ株式会社. ゴナックス®電子添文 (2023年11月改訂 第3版) [最終閲覧 : 2025/1/3]
- The efficacy and safety of degarelix: a 12-month, comparative, randomized, open-label, parallel-group phase III study in patients with prostate cancer. BJU Int. 2008 Dec;102(11):1531-8. PMID: 19035858
最終更新日 : 2025年1月3日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。