Sorafenib
ソラフェニブ (ネクサバール®)
概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
血管新生阻害薬 ソラフェニブトシル酸塩錠
*バイエル薬品株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量
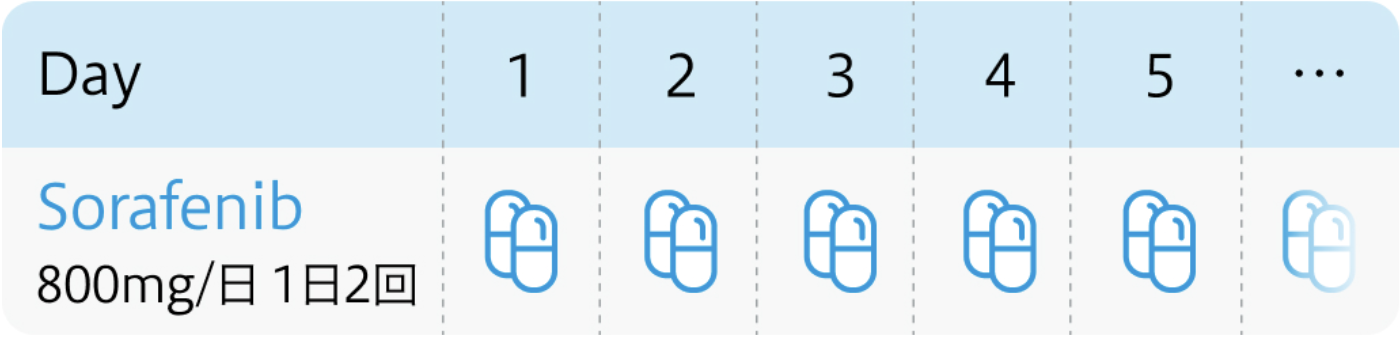
ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
特徴と注意点
2008年に、 血管新生阻害薬単剤で最初に保険承認を得た薬剤である。 開始用量は400mg/回 1日2回経口投与だが、 手足症候群や下痢などの有害事象が適切な支持療法で制御できなければ、 早めに減量を行うことも必要である。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
国際第Ⅱ相試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 14.0% (0%)
- 下痢 16.3% (0%)
- 粘膜炎 2.3% (0%)
- 悪心 2.3% (0%)
- 嘔吐 4.7% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血圧 2.3% (0%)
- 脱毛症 2.3% (0%)
各プロトコル
減量・休薬・中止基準
電子添文¹⁾の基準
皮膚毒性の減量基準
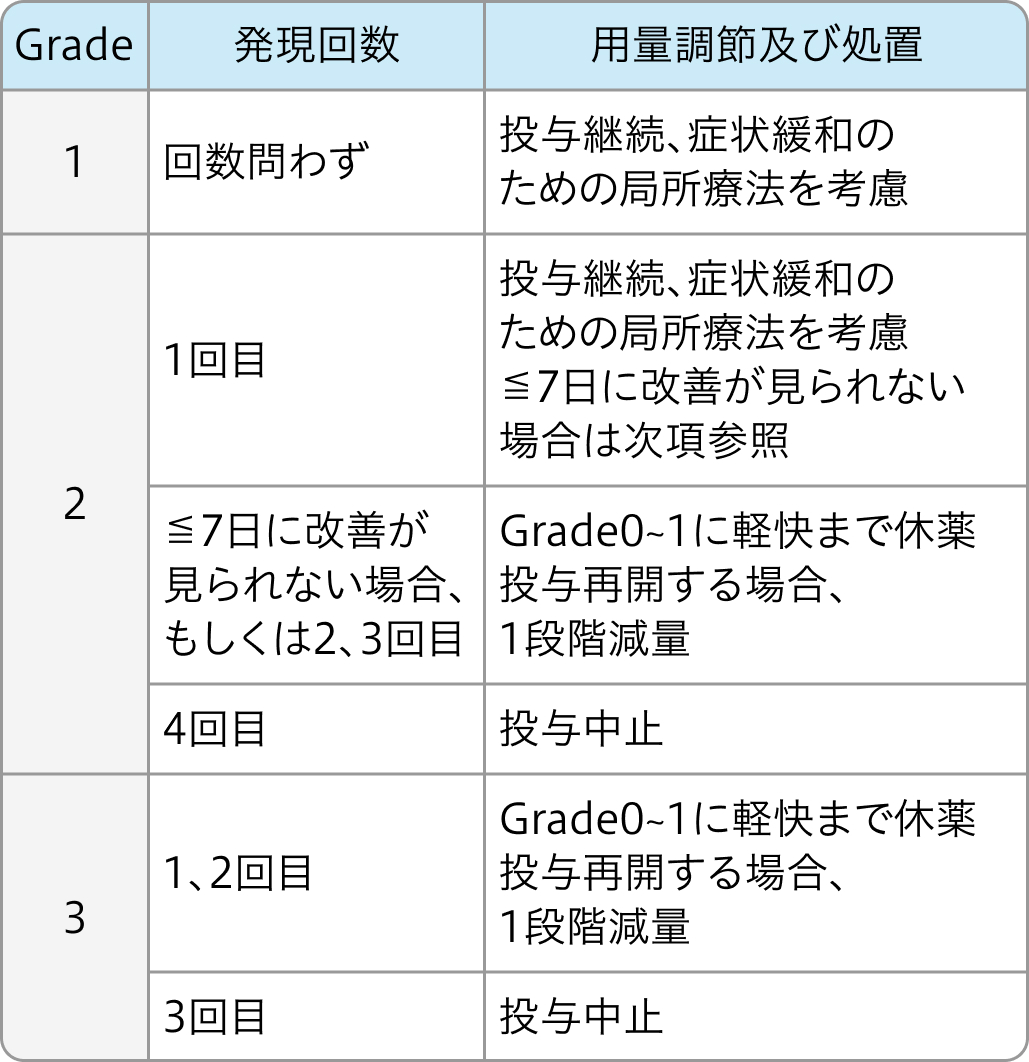
ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
血液毒性の減量基準

ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
非血液毒性の減量基準
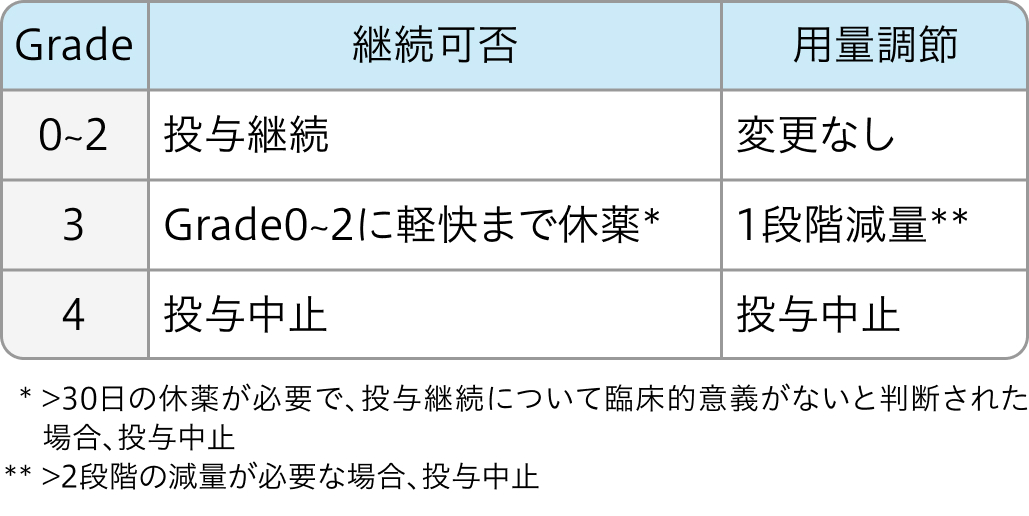
ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
初回基準量と減量レベル
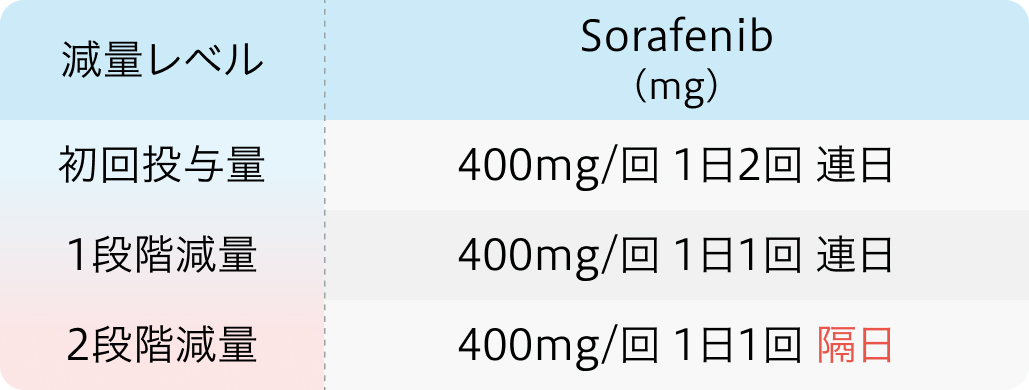
ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
出典
- バイエル薬品株式会社. ネクサバール®電子添文 (2024年9月改訂 第4版) [最終閲覧 : 2024/11/20]
- バイエル薬品株式会社. ネクサバール®適正使用ガイド (2024年5月改訂 第11版) [最終閲覧 : 2024/11/20]
- Randomized phase II trial of first-line treatment with sorafenib versus interferon Alfa-2a in patients with metastatic renal cell carcinoma. J Clin Oncol. 2009 Mar 10;27(8):1280-9. PMID: 19171708
最終更新日 : 2024年11月20日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
Sorafenibの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
Sorafenib
ソラフェニブ (ネクサバール®)
2024年11月20日更新
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
血管新生阻害薬 ソラフェニブトシル酸塩錠
*バイエル薬品株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量

ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
特徴と注意点
2008年に、 血管新生阻害薬単剤で最初に保険承認を得た薬剤である。 開始用量は400mg/回 1日2回経口投与だが、 手足症候群や下痢などの有害事象が適切な支持療法で制御できなければ、 早めに減量を行うことも必要である。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
国際第Ⅱ相試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 倦怠感 14.0% (0%)
- 下痢 16.3% (0%)
- 粘膜炎 2.3% (0%)
- 悪心 2.3% (0%)
- 嘔吐 4.7% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血圧 2.3% (0%)
- 脱毛症 2.3% (0%)
各プロトコル
減量・休薬・中止基準
電子添文¹⁾の基準
皮膚毒性の減量基準

ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
血液毒性の減量基準

ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
非血液毒性の減量基準

ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
初回基準量と減量レベル

ネクサバール®電子添文 (2024年2月改訂 第3版)¹⁾より作図
出典
- バイエル薬品株式会社. ネクサバール®電子添文 (2024年9月改訂 第4版) [最終閲覧 : 2024/11/20]
- バイエル薬品株式会社. ネクサバール®適正使用ガイド (2024年5月改訂 第11版) [最終閲覧 : 2024/11/20]
- Randomized phase II trial of first-line treatment with sorafenib versus interferon Alfa-2a in patients with metastatic renal cell carcinoma. J Clin Oncol. 2009 Mar 10;27(8):1280-9. PMID: 19171708
最終更新日 : 2024年11月20日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
Sorafenibの全コンテンツはアプリからご利用いただけます。
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。