Mitotane
ミトタン (オペプリム®)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
副腎皮質ホルモン合成阻害薬 ミトタン
*ヤクルト本社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与
【催吐性】 中等度~高度 (嘔吐頻度≧30%) *
【FN発症】未報告
*NCCN Guidelines Version 2.2025 Antiemesisを引用
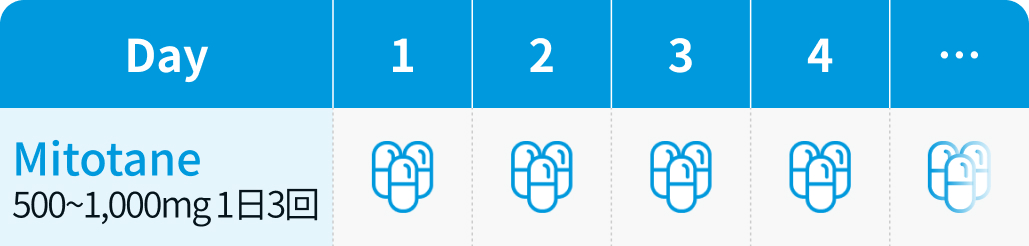
1回500mg~1000mgを1日3回経口投与から開始し、 有効量まで漸増する。 その後は、 症状や血中・尿中ステロイド濃度、 副作用等に応じて適宜増減する。
Key Data|臨床試験結果
📊 ADIUVO試験²⁾
Lancet Diabetes Endocrinol. 2023;11:720-30.
副腎皮質癌でR0切除済み、 ステージI–IIIかつKi67≦10%の低~中等度再発リスクを有する18歳以上の患者91例を対象に実施された、 国際多施設共同のオープンラベル無作為化第III相試験。 ミトタン投与群 (45例) と経過観察群 (46例) に無作為に割り付け、 主要評価項目は無再発生存期間とされた。
【有効性】ミトタン群 (vs 経過観察群)
- 5年無再発生存率 79% (vs 75%)
- 5年OS率 95% (vs 86%)
【安全性】主な有害事象: 全Grade (Grade≧3)
- 無力症または倦怠感 64% (7%)
- 食欲不振 45% (2%)
- 下痢 55% (5%)
- 悪心または嘔吐 62% (2%)
- 女性化乳房 12% (2%)
- 勃起不全 2% (0%)
- 無月経 5% (0%)
- ホットフラッシュ 7% (0%)
- ALT/AST上昇 38% (7%)
- γ-GTP上昇 83% (26%)
- 高コレステロール血症 55% (2%)
- 高トリグリセリド血症 38% (2%)
- 貧血 19% (5%)
- 好中球減少症 7% (0%)
- 皮膚発疹 21% (0%)
- 下肢浮腫 12% (0%)
- 錯乱 21% (0%)
- めまい・浮動性めまい 50% (0%)
- 記憶障害 29% (0%)
- 気分変化 24% (0%)
- 嗜眠 26% (0%)
- 振戦または感覚異常 21% (5%)
- 副腎不全 26% (0%)
ミトタン補助療法は高い毒性を伴い、 専門施設でも約19%が中止に至り、 QOLへの影響も認められた。 症例数の制約から有効性を完全に否定はできないが、 低リスク副腎皮質癌では経過観察のみで管理可能と示唆された。
各プロトコル
適格基準
ADIUVO試験²⁾の主な適格基準
- 18歳以上
- ECOG PS 0-2
- 好中球数 ≧1,000/mm³
- 血小板数 ≧80,000/mm³
- 腎機能 : CrCl≧40mL/min
- 肝機能 : 血清Bil≦2×ULN、 AST/ALT≦3×ULN
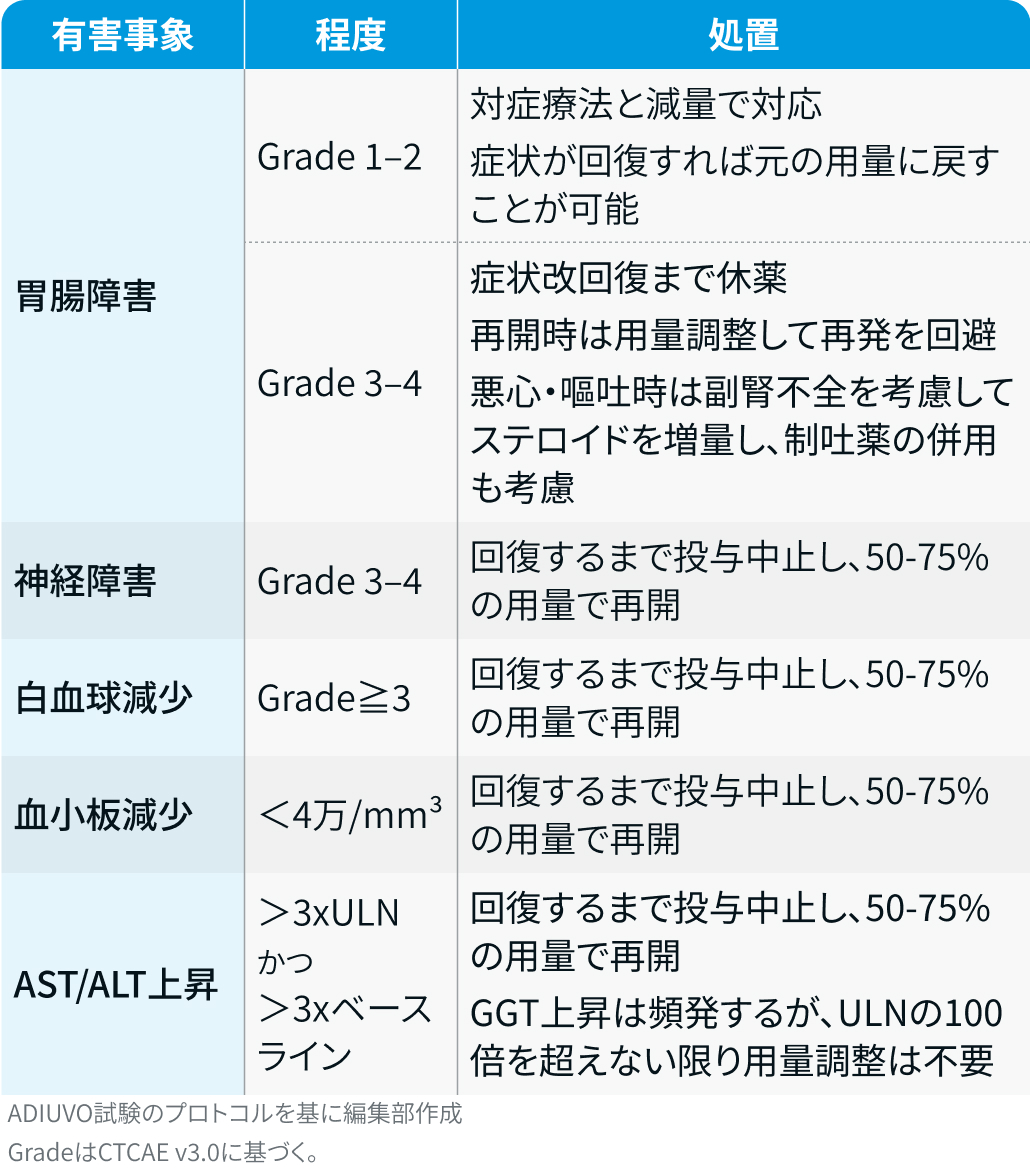
有害事象発現時の減量・休薬・中止基準
ADIUVO試験²⁾では、 以下の基準に基づいて対応が行われた。
レジメンの特徴と注意点
作用機序の特徴
ジクロロジフェニルトリクロロエタン (DDT) の異性体であり、 脂溶性が高く、 副腎皮質の束状層および網状層に選択的に作用して壊死や萎縮を引き起こす。
一方、 球状層は保たれることが多く、 鉱質コルチコイドの欠乏に至ることは稀である。
専門医の視点
国立がん研究センター東病院 腫瘍内科 近藤千紘先生
ミトタンは、 副腎皮質細胞のアポトーシスを誘導することで抗腫瘍効果を発揮し、 副腎皮質癌に対して唯一保険適用のある薬剤である。 治療により副腎皮質機能の不可逆的低下を来し、 コルチコステロイド (ヒドロコルチゾン±フルドロコルチゾン) の生涯補充が必要となる。
術後再発低~中等度リスク (R0切除、 Stage I–III、 Ki-67 index<10%) に対する2年間のミトタン内服は、 無治療経過観察と比較して無再発生存期間およびOSの延長を示さず、 QOLを低下させたことがADIUVO試験で報告されており、 当該患者群には推奨されない。 一方、 再発高リスク例を対象に、 ミトタン単独とEDP-M療法 (エトポシド+シスプラチン+ドキソルビシン+ミトタン) を比較するADIUVO-2試験が現在進行中である。
転移・再発例において、 EDP-M療法の適応とならない高齢者やPS不良例では、 症状緩和を目的にミトタン単剤療法が選択されることがある。 通常は1g/日から開始し、 3日ごとに0.5g/日ずつ増量して3~4g/日で維持する。 血中濃度14~20mg/Lが治療域とされるが、 保険適用内で測定可能な検査法は現時点で存在しない。
薬剤師からのワンポイントアドバイス
国立がん研究センター東病院 薬剤部 楠原佳那子先生
ヒドロコルチゾンの併用について³⁾
コルチゾール過剰が持続している患者を除き、 ミトタン治療中のすべての患者には、 グルココルチコイドの併用が推奨されています。 ミトタン投与初日からヒドロコルチゾン20mg/日を併用する方法に加え、 ミトタン開始2~3週後や副腎機能不全の発症後に投与を開始することも可能です。
CYP3A4誘導作用に注意⁴⁾
ミトタンは強力なCYP3A4誘導剤です。 このため、 アムロジピンなどのジヒドロピリジン系Ca拮抗薬では降圧効果が減弱する可能性があります。 また、 フェンタニルやオキシコドンなど一部のオピオイドも代謝が促進されるため、 モルヒネやヒドロモルフォンへの変更が必要となる場合があります。
レジメン適用時の注意事項
- ショック時や重篤な外傷時は一時的に投与中止
- スピロノラクトン、 ペントバルビタール、 ドラビリン、 エンシトレルビルフマル酸、 レナカバビルとの併用は禁忌
- 長期大量投与により脳機能障害を来すことがあり、 定期的な行動・神経学的評価が必要
出典
- オペプリム®添付文書 (2025年5月改訂第5版)[最終閲覧: 2025/6/20]
- Lancet Diabetes Endocrinol. 2023;11(10):720-730.
- Eur J Endocrinol. 2018;179(4):G1-G46.
- Clin Endocrinol (Oxf). 2011;75(5):585-91.
最終更新日 : 2025年6月20日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
Mitotane
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
副腎皮質ホルモン合成阻害薬 ミトタン
*ヤクルト本社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与
【催吐性】 中等度~高度 (嘔吐頻度≧30%) *
【FN発症】未報告
*NCCN Guidelines Version 2.2025 Antiemesisを引用

1回500mg~1000mgを1日3回経口投与から開始し、 有効量まで漸増する。 その後は、 症状や血中・尿中ステロイド濃度、 副作用等に応じて適宜増減する。
Key Data|臨床試験結果
📊 ADIUVO試験²⁾
Lancet Diabetes Endocrinol. 2023;11:720-30.
副腎皮質癌でR0切除済み、 ステージI–IIIかつKi67≦10%の低~中等度再発リスクを有する18歳以上の患者91例を対象に実施された、 国際多施設共同のオープンラベル無作為化第III相試験。 ミトタン投与群 (45例) と経過観察群 (46例) に無作為に割り付け、 主要評価項目は無再発生存期間とされた。
【有効性】ミトタン群 (vs 経過観察群)
- 5年無再発生存率 79% (vs 75%)
- 5年OS率 95% (vs 86%)
【安全性】主な有害事象: 全Grade (Grade≧3)
- 無力症または倦怠感 64% (7%)
- 食欲不振 45% (2%)
- 下痢 55% (5%)
- 悪心または嘔吐 62% (2%)
- 女性化乳房 12% (2%)
- 勃起不全 2% (0%)
- 無月経 5% (0%)
- ホットフラッシュ 7% (0%)
- ALT/AST上昇 38% (7%)
- γ-GTP上昇 83% (26%)
- 高コレステロール血症 55% (2%)
- 高トリグリセリド血症 38% (2%)
- 貧血 19% (5%)
- 好中球減少症 7% (0%)
- 皮膚発疹 21% (0%)
- 下肢浮腫 12% (0%)
- 錯乱 21% (0%)
- めまい・浮動性めまい 50% (0%)
- 記憶障害 29% (0%)
- 気分変化 24% (0%)
- 嗜眠 26% (0%)
- 振戦または感覚異常 21% (5%)
- 副腎不全 26% (0%)
ミトタン補助療法は高い毒性を伴い、 専門施設でも約19%が中止に至り、 QOLへの影響も認められた。 症例数の制約から有効性を完全に否定はできないが、 低リスク副腎皮質癌では経過観察のみで管理可能と示唆された。
各プロトコル
適格基準
ADIUVO試験²⁾の主な適格基準
- 18歳以上
- ECOG PS 0-2
- 好中球数 ≧1,000/mm³
- 血小板数 ≧80,000/mm³
- 腎機能 : CrCl≧40mL/min
- 肝機能 : 血清Bil≦2×ULN、 AST/ALT≦3×ULN
有害事象発現時の減量・休薬・中止基準
ADIUVO試験²⁾では、 以下の基準に基づいて対応が行われた。

レジメンの特徴と注意点
作用機序の特徴
ジクロロジフェニルトリクロロエタン (DDT) の異性体であり、 脂溶性が高く、 副腎皮質の束状層および網状層に選択的に作用して壊死や萎縮を引き起こす。
一方、 球状層は保たれることが多く、 鉱質コルチコイドの欠乏に至ることは稀である。
専門医の視点
国立がん研究センター東病院 腫瘍内科 近藤千紘先生
ミトタンは、 副腎皮質細胞のアポトーシスを誘導することで抗腫瘍効果を発揮し、 副腎皮質癌に対して唯一保険適用のある薬剤である。 治療により副腎皮質機能の不可逆的低下を来し、 コルチコステロイド (ヒドロコルチゾン±フルドロコルチゾン) の生涯補充が必要となる。
術後再発低~中等度リスク (R0切除、 Stage I–III、 Ki-67 index<10%) に対する2年間のミトタン内服は、 無治療経過観察と比較して無再発生存期間およびOSの延長を示さず、 QOLを低下させたことがADIUVO試験で報告されており、 当該患者群には推奨されない。 一方、 再発高リスク例を対象に、 ミトタン単独とEDP-M療法 (エトポシド+シスプラチン+ドキソルビシン+ミトタン) を比較するADIUVO-2試験が現在進行中である。
転移・再発例において、 EDP-M療法の適応とならない高齢者やPS不良例では、 症状緩和を目的にミトタン単剤療法が選択されることがある。 通常は1g/日から開始し、 3日ごとに0.5g/日ずつ増量して3~4g/日で維持する。 血中濃度14~20mg/Lが治療域とされるが、 保険適用内で測定可能な検査法は現時点で存在しない。
薬剤師からのワンポイントアドバイス
国立がん研究センター東病院 薬剤部 楠原佳那子先生
ヒドロコルチゾンの併用について³⁾
コルチゾール過剰が持続している患者を除き、 ミトタン治療中のすべての患者には、 グルココルチコイドの併用が推奨されています。 ミトタン投与初日からヒドロコルチゾン20mg/日を併用する方法に加え、 ミトタン開始2~3週後や副腎機能不全の発症後に投与を開始することも可能です。
CYP3A4誘導作用に注意⁴⁾
ミトタンは強力なCYP3A4誘導剤です。 このため、 アムロジピンなどのジヒドロピリジン系Ca拮抗薬では降圧効果が減弱する可能性があります。 また、 フェンタニルやオキシコドンなど一部のオピオイドも代謝が促進されるため、 モルヒネやヒドロモルフォンへの変更が必要となる場合があります。
レジメン適用時の注意事項
- ショック時や重篤な外傷時は一時的に投与中止
- スピロノラクトン、 ペントバルビタール、 ドラビリン、 エンシトレルビルフマル酸、 レナカバビルとの併用は禁忌
- 長期大量投与により脳機能障害を来すことがあり、 定期的な行動・神経学的評価が必要
出典
- オペプリム®添付文書 (2025年5月改訂第5版)[最終閲覧: 2025/6/20]
- Lancet Diabetes Endocrinol. 2023;11(10):720-730.
- Eur J Endocrinol. 2018;179(4):G1-G46.
- Clin Endocrinol (Oxf). 2011;75(5):585-91.
最終更新日 : 2025年6月20日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。