HER2/Claudin
提供:MSD株式会社
記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。 また、 承認されたコンパニオン診断薬等の最新情報については、 こちらをご確認ください。

アドバイザー : 国立がん研究センター東病院 遺伝子診療部門 部門長 桑田 健 先生
HER2の概要
HER2とは
Human epidermal growth factor receptor type2 (HER2) はがん遺伝子であるHER2遺伝子によってコードされるタンパク質で、 増殖因子受容体群HERファミリーに属している¹⁾。 HERファミリーは細胞膜を貫通する受容体型チロシンキナーゼであり、 二量体を形成してRAS/RAF/MEK/MAPK経路やPI3キナーゼ (PI3K) /AKT経路の細胞内シグナル伝達を活性化し、 細胞増殖などが促進する²⁾。
HERファミリーによる主な細胞内シグナル経路
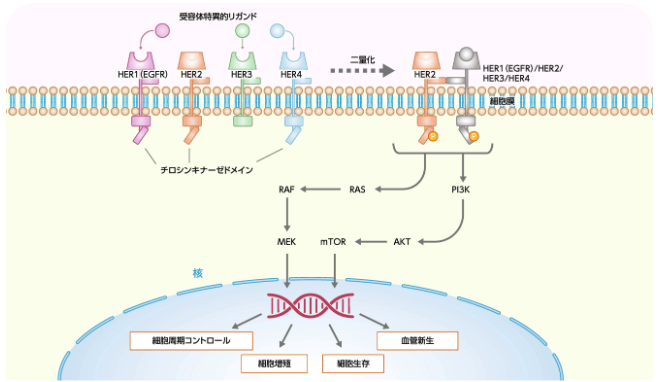
Najjar MK et al, Genes (Basel). 2022; 13: 2065.
Rubin E et al, Int J Mol Sci. 2024; 25: 1064.
Patel A et al, Cancers (Basel). 2020; 12: 2081.をもとに作成
- HERファミリーは、 同じ受容体によるホモ二量体、 あるいは異なる受容体によるヘテロ二量体を形成する¹⁾。
- HER2はリガンドの結合なしで二量体を形成する¹⁾。
- 受容体の組合せによってシグナル強度が異なり、 特にHER2を含む二量体 (HER1/HER2、 HER2/HER2、 HER2/HER3、 HER2/HER4) のシグナル活性が強いとされている¹⁾²⁾。
- 二量体形成によりRAS/RAF/MEK/MAPK経路やPI3K/AKT経路などのシグナル伝達経路が活性化し、 細胞増殖、 生存、 分化、 血管新生、 浸潤などを促進する²⁾³⁾。
乳癌、 胃癌、 卵巣癌などの悪性腫瘍では、 HER2遺伝子増幅によりHER2タンパクが過剰発現することが報告されている⁴⁾。 HER2タンパク過剰発現は乳癌の約20%⁵⁾、 胃癌の15~20%⁶⁾、 卵巣癌の8~66%⁷⁾で認められることも示されており、 HER2タンパクは重要な治療標的となっている。
引用文献
1) 一般社団法人 日本病理学会 編, 乳癌・胃癌HER2病理診断ガイドライン第2版, 金原出版, pp10‐12, 2021.
2) Rubin E et al, Int J Mol Sci. 2024; 25: 1064.
3) Patel A et al, Cancers (Basel). 2020; 12: 2081.
4) Galogre M et al, Crit Rev Oncol Hematol. 2023; 186: 103997.
5) Gutierrez C, Arch Pathol Lab Med. 2011; 135: 55-62.
6) Grieb BC et al, Curr Treat Options Oncol. 2021; 22: 88.
7) Koopman T et al, Histopathology. 2018; 73: 852-863.
HER2検査
HER2検査の種類と特徴
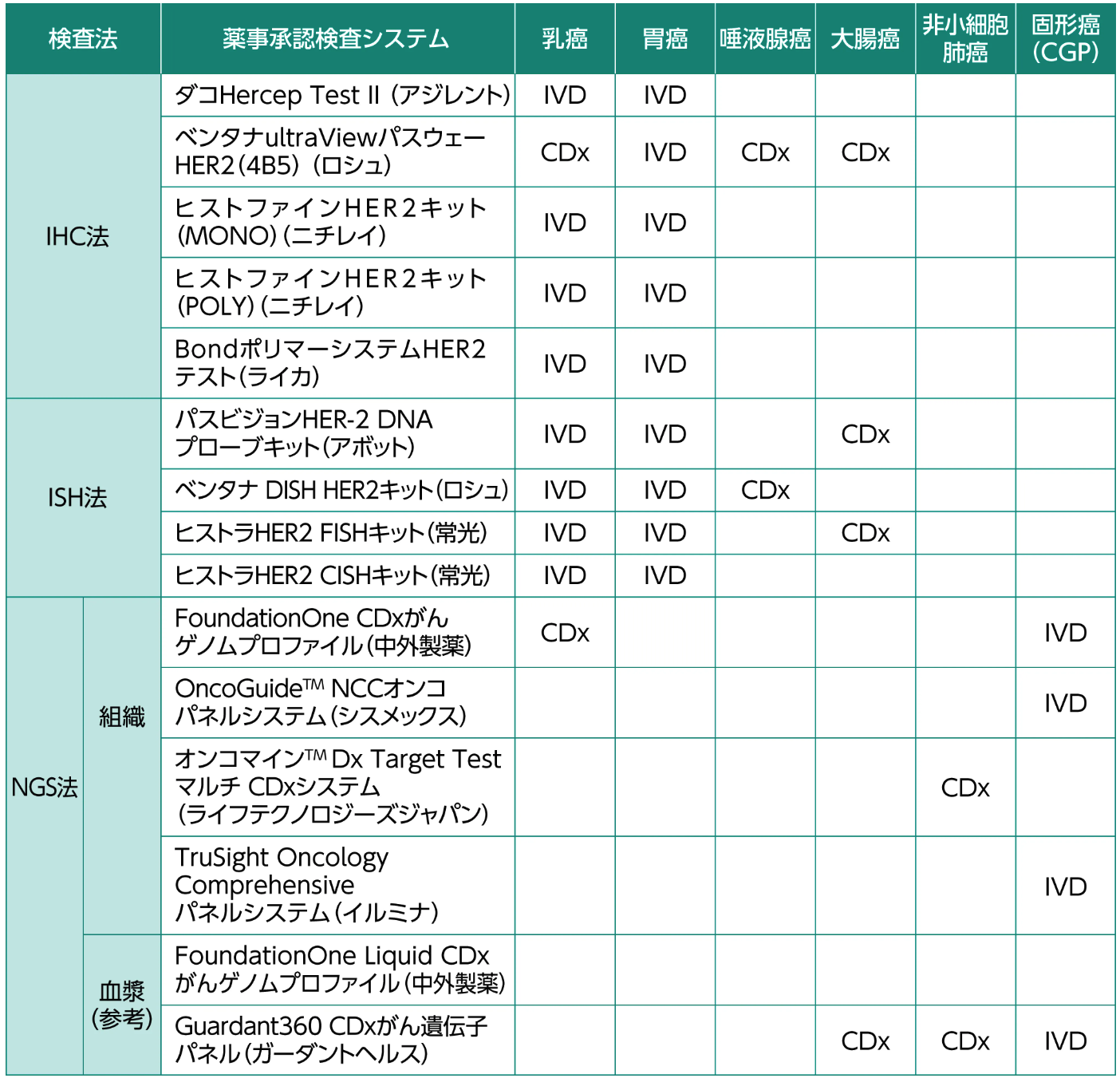
HER2検査には、 HER2タンパク過剰発現を検出する免疫組織化学 (IHC) 法や、 HER2遺伝子増幅を測定するin situ ハイブリダイゼーション (ISH) 法が臨床で使用されており¹⁾²⁾、 次世代シークエンス (NGS) 法によっても検出可能である¹⁾。 現在、 日本で承認されているHER2検査と、 がん種別の判定基準を下表に示した³⁾。
各がん種におけるHER2検査システムの薬事承認形態³⁾
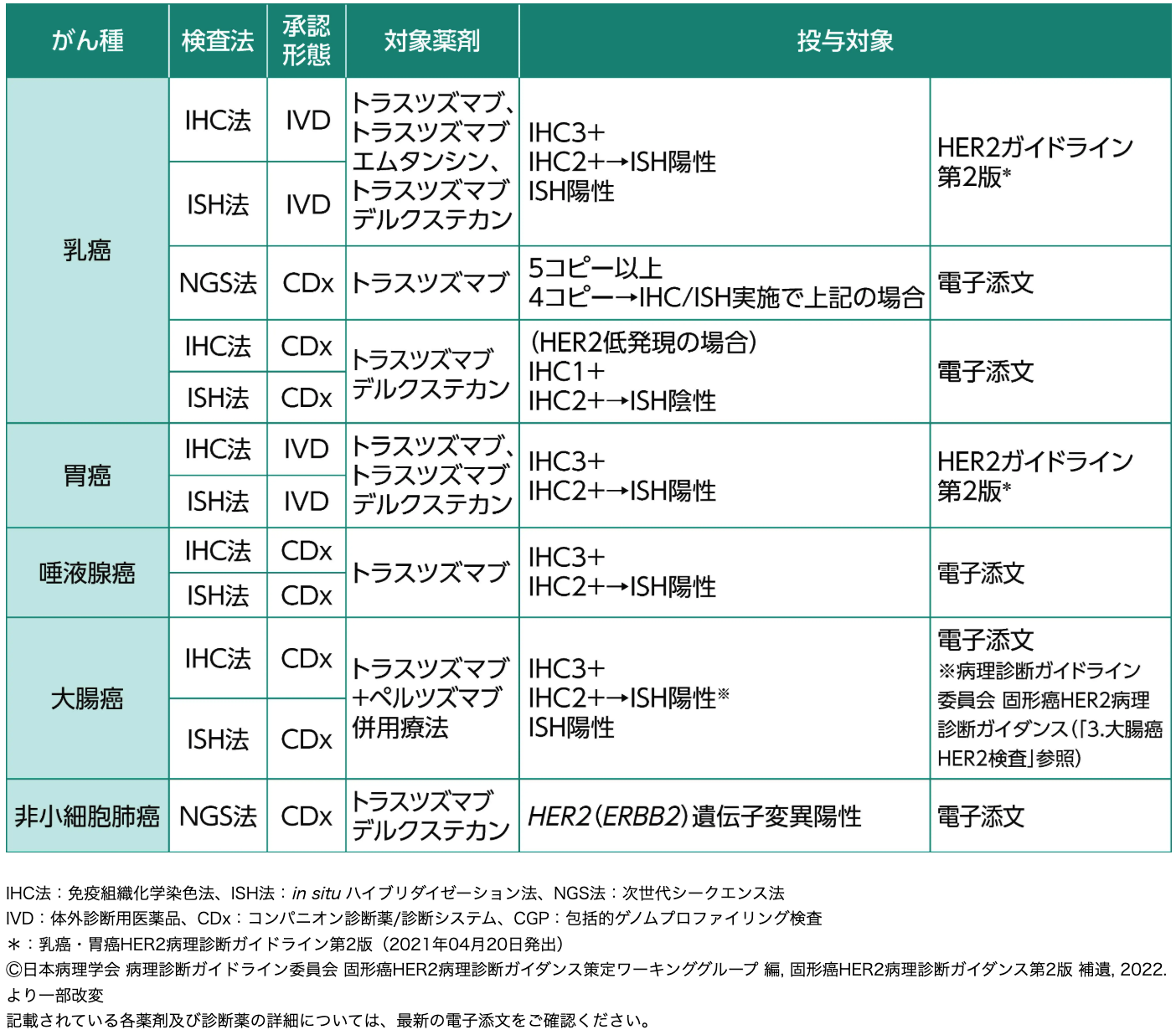
各がん種におけるHER2治療薬とその投与対象³⁾
HER2検査はIHC法とISH法いずれのCDxを先に用いても診断上差し支えないが、 はじめに行う検査としては安価かつ簡便であるIHC法がより望ましい³⁾。
IHC法における判定は細胞膜の染色強度と陽性細胞の割合をもとに、 IHC 0-1+はHER2陰性、 IHC 2+はequivocal、 IHC 3+は陽性と判定される²⁾³⁾。
胃癌および大腸癌の手術検体、 ならびに乳癌と唾液腺癌では10%の腫瘍細胞に染色性が認められることが必要であるが³⁾⁴⁾、 胃癌生検検体では5個以上の陽性となる腫瘍細胞のクラスタで判定が可能であることに注意する¹⁾。
なお、 IHC法におけるIHC 3+以外の症例においてもHER2遺伝子増幅を認める症例が存在することから、 IHC 2+の症例については、 ISH法によるHER2遺伝子増幅を確認する³⁾。
※記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。
保険点数
病理組織標本作製⁵⁾
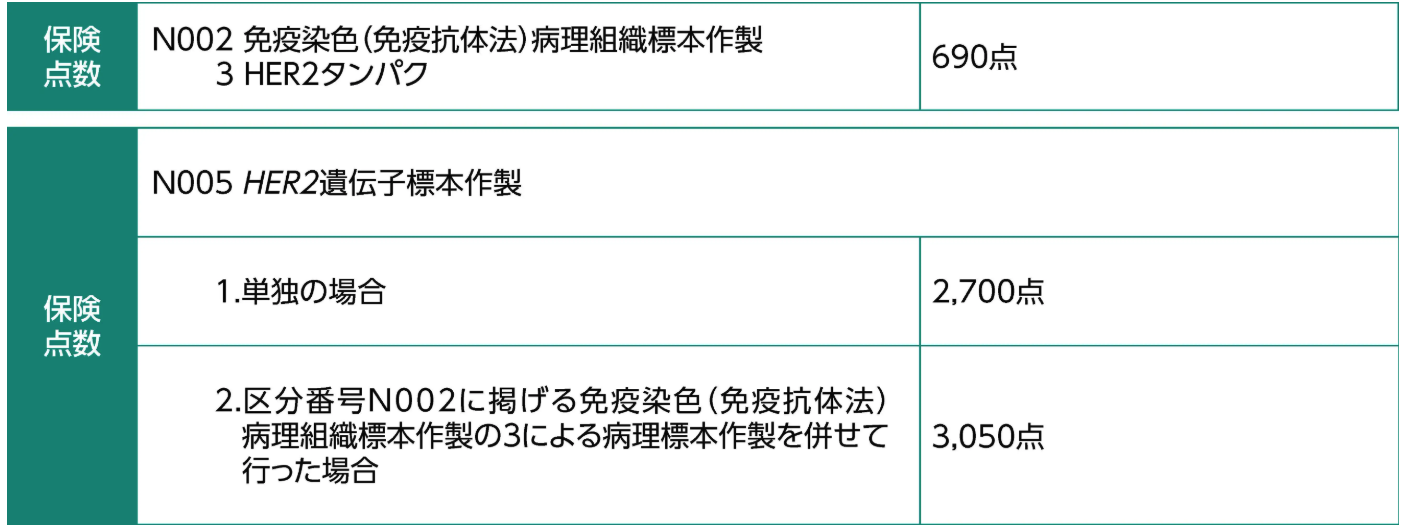
悪性腫瘍組織検査⁵⁾

引用文献
1) 日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会 編, 成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン第3版,金原出版,pp83-84, 2022.
2) 一般社団法人 日本乳癌学会 編, 乳癌診療ガイドライン 2022年版, 金原出版, pp343‐348, 2022.
3) 日本病理学会 病理診断ガイドライン委員会 固形癌HER2病理診断ガイダンス策定ワーキンググループ 編, 固形癌HER2病理診断ガイダンス第2版 補遺, 2022. (https://www.pathology.or.jp/news/20231218_guidance20221228.pdf) (2025/7/10閲覧)
4) 一般社団法人 日本病理学会 編, 乳癌・胃癌HER2病理診断ガイドライン第2版, 金原出版, pp3-9, 2021.
5) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部を改正する告示 (https://www.mhlw.go.jp/content/12404000/001251499.pdf) (2025/7/10閲覧)
Claudinの概要
Claudinとは
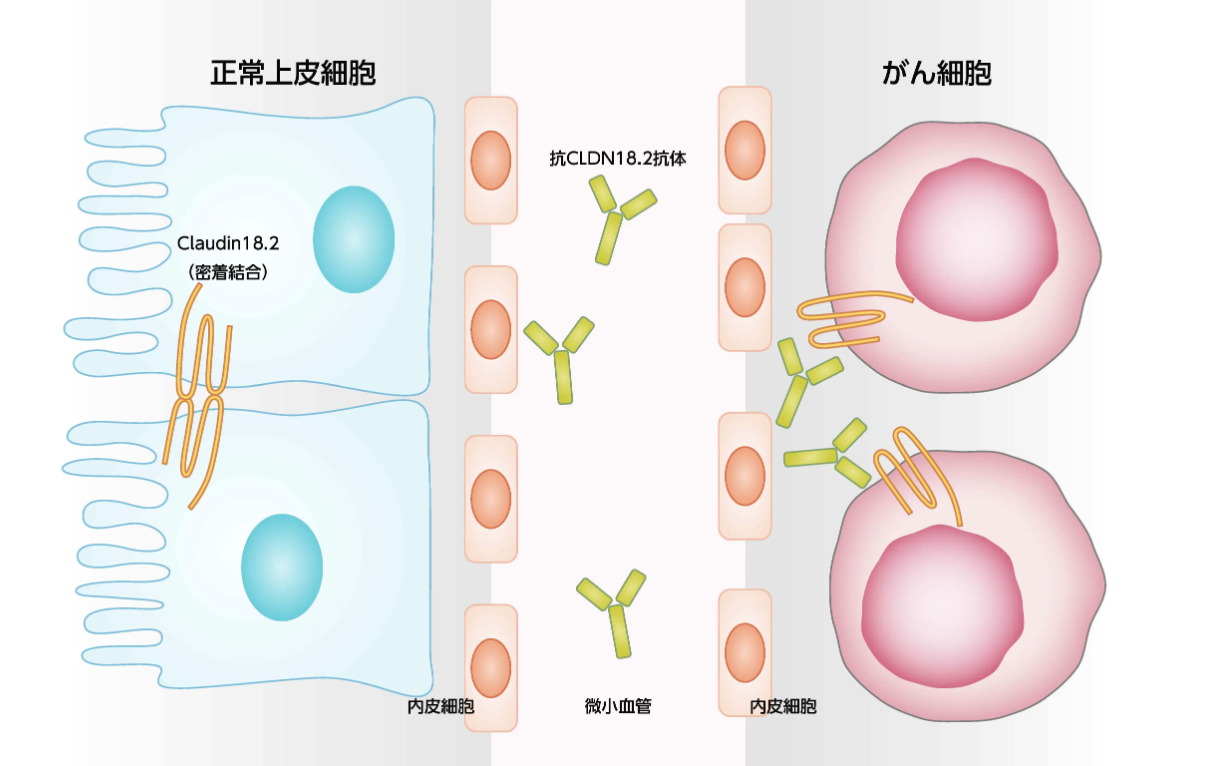
Claudin (CLDN) は細胞間接着のひとつであるタイトジャンクション (密着結合) 形成に関わる細胞膜4回貫通型タンパク質であり¹⁾、 以下の機能により (特に胃において) 細胞間の透過性の調整機能などに関わっている¹⁾²⁾。

CLDNには27のアイソフォームが同定されており¹⁾、 CLDN18.1は肺胞上皮細胞に、 CLDN18.2は胃粘膜上皮細胞に発現している¹⁾。 CLDN18.2は腫瘍細胞の増殖、 分化、 転移に関与しているとの報告もある⁴⁾。
Kyuno D et al, Tissue Barriers 2022; 10: 1967080.
Duong CN et al, Front Physiol 2020; 11: 519.
Kumar V et al, Front Pharmacol 2018; 9: 404.をもとに作成
- 正常な胃粘膜上皮細胞において、 CLDN18.2は細胞系列の分化を制御し、 胃内腔から粘膜下腔への胃酸漏出を防いでいるとされる¹⁾。
- 正常組織では、 CLDN18.2は胃粘膜上皮細胞の側底部に局在しており⁵⁾、 抗CLDN18.2抗体と結合できない¹⁾。
- がん化の過程により細胞極性が乱れることで、 CLDN18.2と抗CLDN18.2抗体の結合が可能となる⁶⁾。
バイオマーカーとしてのCLDN
CLDNのうちCLDN18.2は、 胃癌のバイオマーカーとして位置づけられており、 治療方針決定の際にHER2検査、 PD-L1検査、 MSI/MMR判定検査と同時にCLDN18検査を実施することが推奨されている⁷⁾。
なお、 上記の4検査を同時実施しない場合でも、 4つのバイオマーカー検査が確実に実施されることが重要とされている。 少なくとも、 一次治療の開始に不可欠なHER2検査、 PD-L1検査およびCLDN18検査の3検査は、 一次治療開始前に行うことが推奨されている。 MSI/MMR判定検査においても、 二次治療以降の薬剤選択に関わるコンパニオン診断ではあるが、 対象となる患者の状態や施設の状況を鑑みた上で、 可能な限り、 一次治療開始前に行うことが推奨される⁷⁾。
引用文献
1) Kyuno D et al, Tissue Barriers. 2022; 10: 1967080.
2) 中村桂子 ほか (監訳) . Essential 細胞生物学 原書第5版. 2022 南江堂
3) Sugimoto K et al, Proc Natl Acad Sci U S A. 2019; 116: 24600-24609.
4) Cao W et al, Biomark Res. 2022; 10: 38.
5) Caron TJ et al, Cell Mol Gastroenterol Hepatol. 2021; 11: 783-801.
6) Sahin U et al, Ann Oncol. 2021; 32: 609-619.
7) 一般社団法人 日本胃癌学会 発出. 「切除不能進行・再発胃癌バイオマーカー検査の手引き」 第2版. 2025
Claudin検査
国内で用いられるCLDN検査
現在日本で承認されているのは、 コンパニオン診断薬であるベンタナOptiView CLDN18 (43-14A) である。 本検査ではCLDN18.1とCLDN18.2の両方を認識するが、 正常胃粘膜や胃癌におけるCLDN18.1発現は極めて低いため、 検査結果をCLDN18.2の発現とみなす。

保険点数¹⁾

引用文献
1) 厚生労働省 : 臨床検査の保険適用について (令和6年5月収載予定) 体外診断用医薬品に係る保険適用決定区分及び価格 (案) (https://www.mhlw.go.jp/content/12404000/001248845.pdf) (2025/7/10閲覧) (一部改変)
他のバイオマーカー検査コンテンツ




編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HER2/Claudin
記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。 また、 承認されたコンパニオン診断薬等の最新情報については、 こちらをご確認ください。

アドバイザー : 国立がん研究センター東病院 遺伝子診療部門 部門長 桑田 健 先生
HER2の概要
HER2とは
Human epidermal growth factor receptor type2 (HER2) はがん遺伝子であるHER2遺伝子によってコードされるタンパク質で、 増殖因子受容体群HERファミリーに属している¹⁾。 HERファミリーは細胞膜を貫通する受容体型チロシンキナーゼであり、 二量体を形成してRAS/RAF/MEK/MAPK経路やPI3キナーゼ (PI3K) /AKT経路の細胞内シグナル伝達を活性化し、 細胞増殖などが促進する²⁾。
HERファミリーによる主な細胞内シグナル経路

Najjar MK et al, Genes (Basel). 2022; 13: 2065.
Rubin E et al, Int J Mol Sci. 2024; 25: 1064.
Patel A et al, Cancers (Basel). 2020; 12: 2081.をもとに作成
- HERファミリーは、 同じ受容体によるホモ二量体、 あるいは異なる受容体によるヘテロ二量体を形成する¹⁾。
- HER2はリガンドの結合なしで二量体を形成する¹⁾。
- 受容体の組合せによってシグナル強度が異なり、 特にHER2を含む二量体 (HER1/HER2、 HER2/HER2、 HER2/HER3、 HER2/HER4) のシグナル活性が強いとされている¹⁾²⁾。
- 二量体形成によりRAS/RAF/MEK/MAPK経路やPI3K/AKT経路などのシグナル伝達経路が活性化し、 細胞増殖、 生存、 分化、 血管新生、 浸潤などを促進する²⁾³⁾。
乳癌、 胃癌、 卵巣癌などの悪性腫瘍では、 HER2遺伝子増幅によりHER2タンパクが過剰発現することが報告されている⁴⁾。 HER2タンパク過剰発現は乳癌の約20%⁵⁾、 胃癌の15~20%⁶⁾、 卵巣癌の8~66%⁷⁾で認められることも示されており、 HER2タンパクは重要な治療標的となっている。
引用文献
1) 一般社団法人 日本病理学会 編, 乳癌・胃癌HER2病理診断ガイドライン第2版, 金原出版, pp10‐12, 2021.
2) Rubin E et al, Int J Mol Sci. 2024; 25: 1064.
3) Patel A et al, Cancers (Basel). 2020; 12: 2081.
4) Galogre M et al, Crit Rev Oncol Hematol. 2023; 186: 103997.
5) Gutierrez C, Arch Pathol Lab Med. 2011; 135: 55-62.
6) Grieb BC et al, Curr Treat Options Oncol. 2021; 22: 88.
7) Koopman T et al, Histopathology. 2018; 73: 852-863.
HER2検査
HER2検査の種類と特徴
HER2検査には、 HER2タンパク過剰発現を検出する免疫組織化学 (IHC) 法や、 HER2遺伝子増幅を測定するin situ ハイブリダイゼーション (ISH) 法が臨床で使用されており¹⁾²⁾、 次世代シークエンス (NGS) 法によっても検出可能である¹⁾。 現在、 日本で承認されているHER2検査と、 がん種別の判定基準を下表に示した³⁾。
各がん種におけるHER2検査システムの薬事承認形態³⁾

各がん種におけるHER2治療薬とその投与対象³⁾

HER2検査はIHC法とISH法いずれのCDxを先に用いても診断上差し支えないが、 はじめに行う検査としては安価かつ簡便であるIHC法がより望ましい³⁾。
IHC法における判定は細胞膜の染色強度と陽性細胞の割合をもとに、 IHC 0-1+はHER2陰性、 IHC 2+はequivocal、 IHC 3+は陽性と判定される²⁾³⁾。
胃癌および大腸癌の手術検体、 ならびに乳癌と唾液腺癌では10%の腫瘍細胞に染色性が認められることが必要であるが³⁾⁴⁾、 胃癌生検検体では5個以上の陽性となる腫瘍細胞のクラスタで判定が可能であることに注意する¹⁾。
なお、 IHC法におけるIHC 3+以外の症例においてもHER2遺伝子増幅を認める症例が存在することから、 IHC 2+の症例については、 ISH法によるHER2遺伝子増幅を確認する³⁾。
※記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。
保険点数
病理組織標本作製⁵⁾

悪性腫瘍組織検査⁵⁾

引用文献
1) 日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会 編, 成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン第3版,金原出版,pp83-84, 2022.
2) 一般社団法人 日本乳癌学会 編, 乳癌診療ガイドライン 2022年版, 金原出版, pp343‐348, 2022.
3) 日本病理学会 病理診断ガイドライン委員会 固形癌HER2病理診断ガイダンス策定ワーキンググループ 編, 固形癌HER2病理診断ガイダンス第2版 補遺, 2022. (https://www.pathology.or.jp/news/20231218_guidance20221228.pdf) (2025/7/10閲覧)
4) 一般社団法人 日本病理学会 編, 乳癌・胃癌HER2病理診断ガイドライン第2版, 金原出版, pp3-9, 2021.
5) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部を改正する告示 (https://www.mhlw.go.jp/content/12404000/001251499.pdf) (2025/7/10閲覧)
Claudinの概要
Claudinとは
Claudin (CLDN) は細胞間接着のひとつであるタイトジャンクション (密着結合) 形成に関わる細胞膜4回貫通型タンパク質であり¹⁾、 以下の機能により (特に胃において) 細胞間の透過性の調整機能などに関わっている¹⁾²⁾。

CLDNには27のアイソフォームが同定されており¹⁾、 CLDN18.1は肺胞上皮細胞に、 CLDN18.2は胃粘膜上皮細胞に発現している¹⁾。 CLDN18.2は腫瘍細胞の増殖、 分化、 転移に関与しているとの報告もある⁴⁾。

Kyuno D et al, Tissue Barriers 2022; 10: 1967080.
Duong CN et al, Front Physiol 2020; 11: 519.
Kumar V et al, Front Pharmacol 2018; 9: 404.をもとに作成
- 正常な胃粘膜上皮細胞において、 CLDN18.2は細胞系列の分化を制御し、 胃内腔から粘膜下腔への胃酸漏出を防いでいるとされる¹⁾。
- 正常組織では、 CLDN18.2は胃粘膜上皮細胞の側底部に局在しており⁵⁾、 抗CLDN18.2抗体と結合できない¹⁾。
- がん化の過程により細胞極性が乱れることで、 CLDN18.2と抗CLDN18.2抗体の結合が可能となる⁶⁾。
バイオマーカーとしてのCLDN
CLDNのうちCLDN18.2は、 胃癌のバイオマーカーとして位置づけられており、 治療方針決定の際にHER2検査、 PD-L1検査、 MSI/MMR判定検査と同時にCLDN18検査を実施することが推奨されている⁷⁾。
なお、 上記の4検査を同時実施しない場合でも、 4つのバイオマーカー検査が確実に実施されることが重要とされている。 少なくとも、 一次治療の開始に不可欠なHER2検査、 PD-L1検査およびCLDN18検査の3検査は、 一次治療開始前に行うことが推奨されている。 MSI/MMR判定検査においても、 二次治療以降の薬剤選択に関わるコンパニオン診断ではあるが、 対象となる患者の状態や施設の状況を鑑みた上で、 可能な限り、 一次治療開始前に行うことが推奨される⁷⁾。
引用文献
1) Kyuno D et al, Tissue Barriers. 2022; 10: 1967080.
2) 中村桂子 ほか (監訳) . Essential 細胞生物学 原書第5版. 2022 南江堂
3) Sugimoto K et al, Proc Natl Acad Sci U S A. 2019; 116: 24600-24609.
4) Cao W et al, Biomark Res. 2022; 10: 38.
5) Caron TJ et al, Cell Mol Gastroenterol Hepatol. 2021; 11: 783-801.
6) Sahin U et al, Ann Oncol. 2021; 32: 609-619.
7) 一般社団法人 日本胃癌学会 発出. 「切除不能進行・再発胃癌バイオマーカー検査の手引き」 第2版. 2025
Claudin検査
国内で用いられるCLDN検査
現在日本で承認されているのは、 コンパニオン診断薬であるベンタナOptiView CLDN18 (43-14A) である。 本検査ではCLDN18.1とCLDN18.2の両方を認識するが、 正常胃粘膜や胃癌におけるCLDN18.1発現は極めて低いため、 検査結果をCLDN18.2の発現とみなす。

保険点数¹⁾

引用文献
1) 厚生労働省 : 臨床検査の保険適用について (令和6年5月収載予定) 体外診断用医薬品に係る保険適用決定区分及び価格 (案) (https://www.mhlw.go.jp/content/12404000/001248845.pdf) (2025/7/10閲覧) (一部改変)
他のバイオマーカー検査コンテンツ




編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




