がん遺伝子パネル検査
提供:MSD株式会社
記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。 また、 承認されたコンパニオン診断薬等の最新情報については、 こちらをご確認ください。

アドバイザー : 国立がん研究センター中央病院 病理診断科 科長 谷田部 恭 先生、 近畿大学医学部 ゲノム生物学教室 教授 西尾 和人 先生
がん遺伝子パネル検査の概要
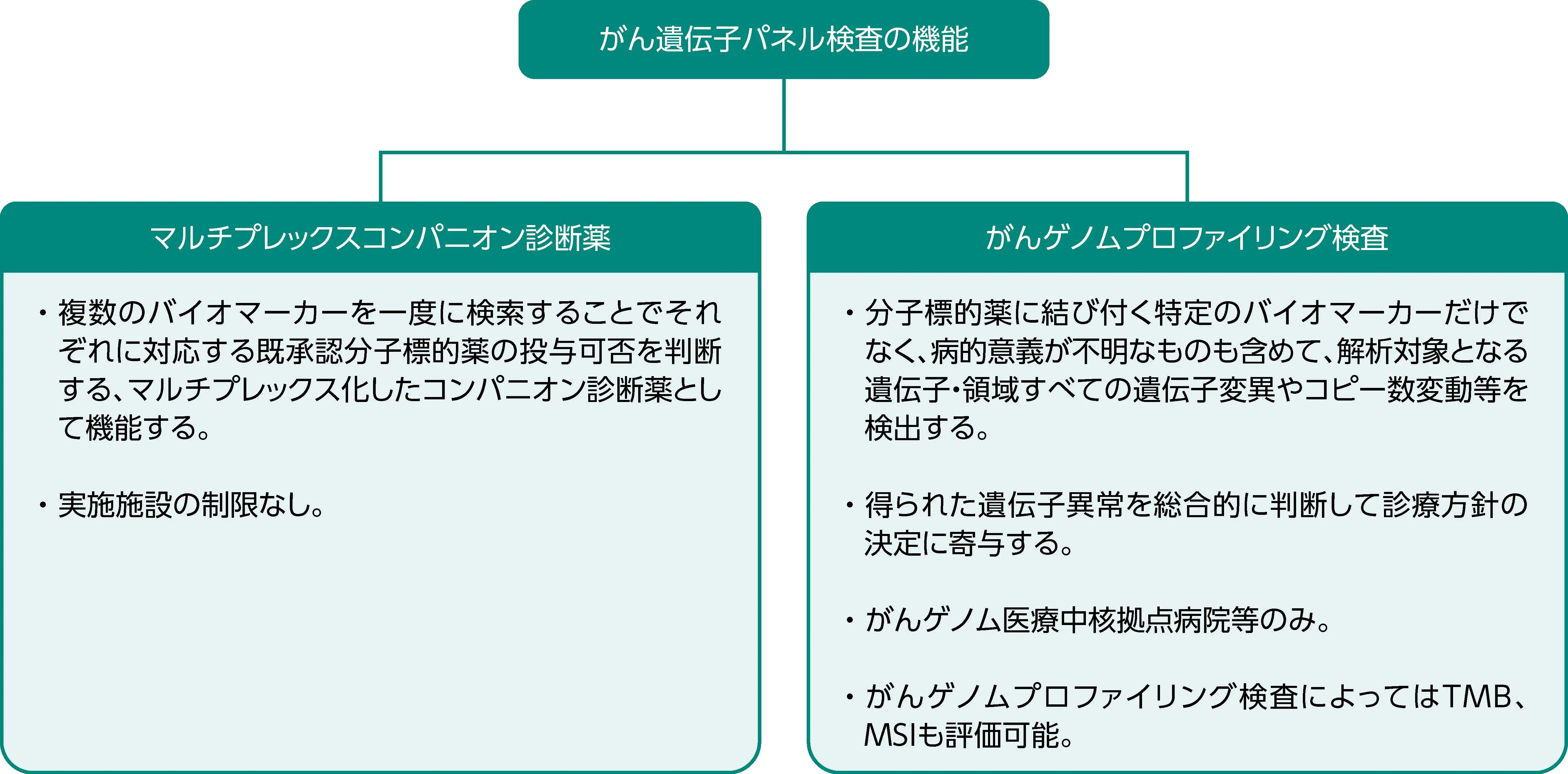
がん遺伝子パネル検査の機能と分類
がん遺伝子パネル検査は、 その機能から、 「マルチプレックスコンパニオン診断薬」 と 「がんゲノムプロファイリング検査」 の2種類に大別できる¹⁾。
TMB: tumor mutation burden MSI:microsatellite instability
角南久仁子著. 臨床のためのがん遺伝子パネル検査のABC. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p31-41, 2020より作図
MSI、 TMBの詳細につきましては、 以下を参照ください。 MSI/MMR TMB
- 従来のがん遺伝子検査は、 分子標的薬の適応となるバイオマーカーの有無を調べるためのコンパニオン診断薬が主体であった¹⁾。
- マルチプレックスコンパニオン診断薬の代表的なものが、 肺癌の遺伝子異常を調べるオンコマインᵀᴹ Dx Target Test マルチCDxシステムであり、 2019年に薬事承認された¹⁾。 2025年7月時点において、 BRAF遺伝子 V600E変異、 EGFR遺伝子変異、 HER2遺伝子変異、 ALK融合遺伝子、 ROS1融合遺伝子、 RET融合遺伝子、 MET遺伝子エクソン14スキッピング変異、 RET遺伝子変異を対象とした分子標的薬の適応判定の補助を目的とした検査である²⁾。 また、 2021年に承認されたAmoyDx® 肺癌マルチ遺伝子PCRパネルでは、 DNA中の遺伝子変異 (EGFR遺伝子変異、 BRAF遺伝子変異 (V600E) 及びKRAS遺伝子変異 (G12C) )、 RNA中の融合遺伝子 (ALK融合遺伝子、 ROS1融合遺伝子、 RET融合遺伝子)、 MET遺伝子エクソン14スキッピング変異の検出が可能となっている (2025年7月時点) ³⁾。
- 肺癌におけるEGFR遺伝子、 ALK融合遺伝子、 ROS1融合遺伝子、 大腸癌におけるKRAS遺伝子、 NRAS遺伝子など、 一部の遺伝子及びがん種について、 コンパニオン診断薬としての機能を有しているがんゲノムプロファイリング検査もある¹⁾。
検査に用いる検体は組織検体と血漿検体の2種類⁴⁾⁵⁾
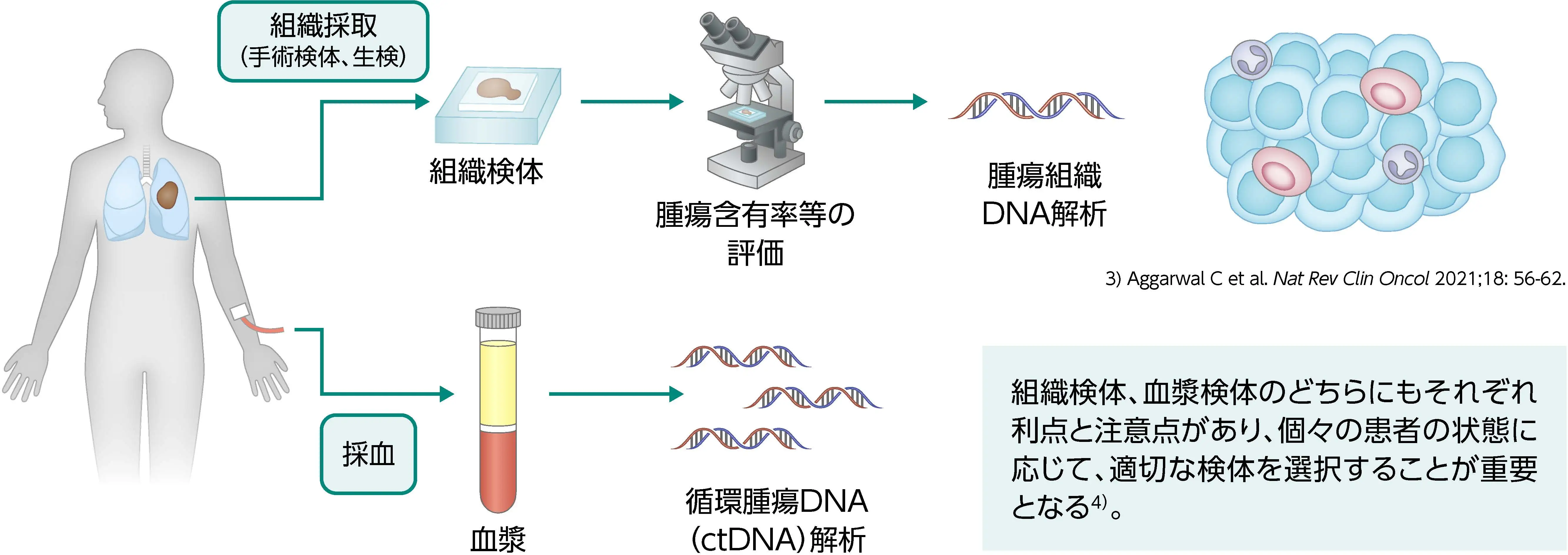
- リキッドバイオプシーや検体の使い分け、 ctDNAの詳細等は下部の「リキッドバイオプシー」 の項をご参照ください。
- 実際の検体の取り扱いにあたっては、 各医療機器の電子添文及びゲノム研究用・診療用病理組織検体取扱い規程⁶⁾等を参考にしてください。
各がんゲノムプロファイリング検査の主な特徴¹⁾⁶⁻¹²⁾
固形がんを対象とした主ながんゲノムプロファイリング検査の特徴を表に示した。 このうち、 FoundationOne® CDx及びLiquid CDx、 Guardant360 CDxはマルチプレックスコンパニオン診断薬としての機能も有している。


がんゲノムプロファイリング検査の保険点数
保険診療における対象患者
保険診療におけるがんゲノムプロファイリング検査の対象は、 標準治療がない固形がん患者、 または標準治療が終了となった局所進行/転移を有する固形がん患者とされている¹⁵⁾。
本検査は、 標準治療がない*¹固形がん患者又は局所進行若しくは転移が認められ標準治療が終了*²となった固形がん患者 (終了が見込まれる者を含む。 )
かつ
関連学会の化学療法に関するガイドライン等に基づき、 全身状態及び臓器機能等から、 本検査施行後に化学療法の適応となる可能性が高いと主治医が判断した患者¹⁶⁾
*¹ 希少がんや原発不明がん等、 標準治療が確立していない固形がん患者には、 治療法の選択の一助とすることを想定し治療開始前の実施が推奨される¹⁷⁾。
*² 各疾患における標準治療がどの範囲を指すのかについては、 関連学会等のガイドラインに従い、 個々の症例で担当医が判断をすべきである¹⁷⁾。
検査実施の流れと保険点数の算定
がんゲノムプロファイリング検査関連の保険点数は、 事前の患者説明及び同意取得後、 検体を検査機関に提出した時点で44,000点、 エキスパートパネルで解析レポートについて検討し、 その結果と治療方針等について患者に説明を行った時点で12,000点を算定することができる¹⁵⁾¹⁸⁾。

- 血漿検体の利用は 「医学的な理由により、 固形腫瘍の腫瘍細胞を検体としてがんゲノムプロファイリング検査を行うことが困難な場合」 または 「固形腫瘍の腫瘍細胞を検体として実施したがんゲノムプロファイリング検査において、 包括的なゲノムプロファイルの結果を得られなかった場合」 に限定されている¹⁹⁾。
引用文献
1) 角南久仁子著. 臨床のためのがん遺伝子パネル検査のABC. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p31-41, 2020
2) オンコマインᵀᴹ Dx Target Test マルチ CDxシステム電子添文 (第21版)
3) AmoyDx® 肺癌マルチ遺伝子PCRパネル電子添文 (第11版)
4) Aggarwal C et al. Nat Rev Clin Oncol 2021;18: 56-62. 本論文の著者にMSD社よりコンサルタント料等を受領している者が含まれる。
5) 日本臨床腫瘍学会、 日本癌治療学会、 日本癌学会 3学会合同ゲノム医療推進タスクフォース. 血中循環腫瘍DNAを用いたがんゲノムプロファイリング検査の適正使用に関する政策提言. 2021
6) 日本病理学会編.ゲノム研究用・診療用病理組織検体取扱い規程, 羊土社, 2019
7) 梶原敦子 他著. FoundationOne® Liquid. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p219-224, 2020
8) FoundationOne® CDx がんゲノムプロファイル電子添文 (第23版)
9) OncoGuideᵀᴹ NCC オンコパネル システム電子添文 (第5版)
10) FoundationOne® Luquid CDx がんゲノムプロファイル電子添文 (第6版)
11) Guardant360® CDx がん遺伝子パネル電子添文 (第6版)
12) 株式会社エスアールエル. SRL総合検査案内 Guardant360® CDxがん遺伝子パネル.
(https://test-guide.srl.info/hachioji/test/detail/04531A101) (2025/7/25閲覧)
13) GenMineTOP® がんゲノムプロファイリングシステム電子添文 (第3版)
14) TruSight Oncology Comprehensive パネルシステム電子添文 (第1版)
15) 二宮貴一朗 他. Current Therapy 2020; 38: 877-881、 厚生労働省. 令和4年度診療報酬改定の概要 (全体版) より作図
16) 厚生労働省. 医療機器の保険適用について (令和元年6月収載予定)
(https://www.mhlw.go.jp/content/12404000/000513115.pdf) (2025/7/25閲覧)
17) 日本臨床腫瘍学会・日本癌治療学会・日本癌学会 次世代シークエンサー等を用いた 遺伝子パネル検査に基づく がん診療ガイダンス, p89, 2020
18) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部を改正する告示
(https://www.mhlw.go.jp/content/12404000/001251499.pdf) (2025/7/25閲覧)
19) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部改正に伴う実施上の留意事項について
(https://www.mhlw.go.jp/content/12404000/001293312.pdf) (2025/7/25閲覧)
がん遺伝子パネル検査に関する制度
がんゲノム医療の提供体制
がんゲノムプロファイリング検査は、 厚生労働大臣が指定した 「がんゲノム医療中核拠点病院 (中核拠点病院) 」、 「がんゲノム医療拠点病院 (拠点病院) 」、 「がんゲノム医療連携病院 (連携病院) 」 でのみ検査実施が可能となっている¹⁾。
がんゲノム医療中核拠点病院の主な指定要件 (診療機能) ¹⁾²⁾

がんゲノム中核拠点病院等の指定を受けた医療機関 (令和7年8月1日時点)

最新のがんゲノム医療中核拠点病院等の一覧については厚生労働省ホームページをご参照ください。
がんゲノム医療中核拠点病院、 拠点病院及び連携病院の全体像
がんゲノム医療を必要とする患者が全国どこにいてもがんゲノム医療を受けられるように、 がんゲノム医療を牽引する中核拠点病院、 中核拠点病院と連携しながらゲノム医療を行う医療機関として拠点病院及び連携病院による体制が整備されている²⁾³⁾。
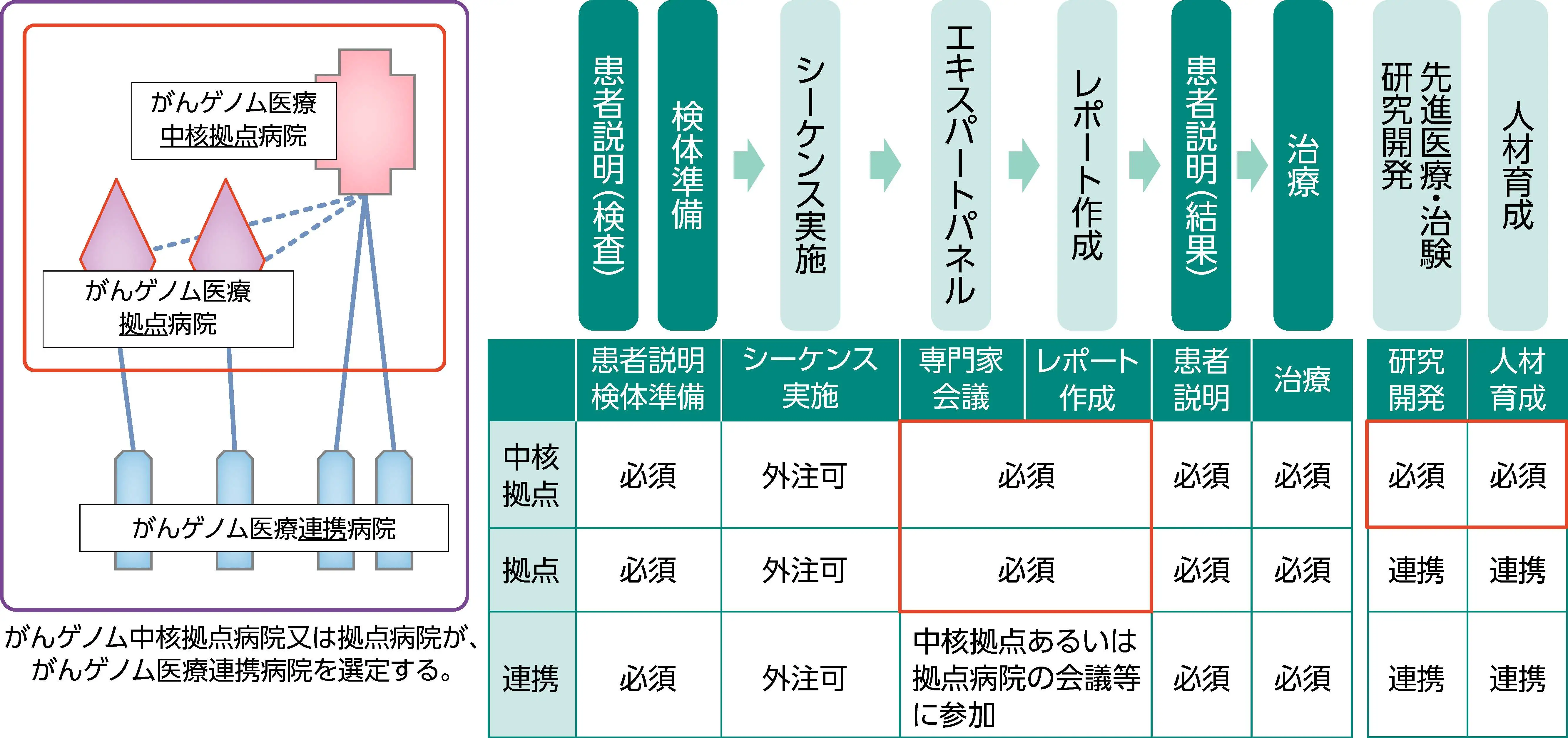
- がんゲノム医療中核拠点病院 : がんゲノム医療の提供においてすべての工程を行える施設。 がんゲノム医療の実施だけでなく、 人材育成、 診療支援、 治験や先進医療の主導、 研究開発などを担い、 がんゲノム医療をけん引する高度な機能を有する医療施設である²⁻⁴⁾。
- がんゲノム医療拠点病院 : がんゲノム医療を提供する機能を有し、 拠点となる医療機関。 がん遺伝子パネル検査の医学的な解釈が自施設で完結できる。 人材育成、 治験・先進医療の主導、 研究開発に関してがんゲノム医療中核拠点病院と連携すること以外は、 がんゲノム医療中核拠点病院と同じ医療体制となる²⁻⁴⁾。
- がんゲノム医療連携病院 : 中核拠点病院または拠点病院によって指定された医療機関で、 患者説明や検体準備、 治療方針の説明、 その後の治療などを担う。 解析結果の解釈は中核拠点病院または拠点病院に依頼し、 担当医がエキスパートパネルに参加する²⁻⁴⁾。

引用文献
1) 沖田南都子著. がんゲノム医療の提供体制. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p12-20, 2020
2) 厚生労働省. がんゲノム医療中核拠点病院等の整備について (令和4年8月1日) (https://www.mhlw.go.jp/content/001216103.pdf) (2025/7/25閲覧)
3) 上野秀樹. Current Therapy 2020; 38: 858-864
4) 厚生労働省. がんゲノム医療中核拠点病院等の指定について (令和5年2月13日) (https://www.mhlw.go.jp/content/10901000/001056905.pdf) (2025/7/25閲覧)
二次的所見と遺伝カウンセリング
がん遺伝子パネル検査における“二次的所見”
「二次的所見」 とは、 がんの治療方針の策定という本来の検査目的ではない所見、 特に生殖細胞系列に病的と確定できる遺伝子変異 (バリアント) が検出されることを指す¹⁾。

がんゲノムプロファイリング検査の事前説明の段階で、 二次的所見が得られる可能性があること、 そして二次的所見がみられた場合の結果の開示を希望するか否かを確認する必要がある¹⁾。 日本医療研究開発機構 (AMED) の研究班や厚生労働省のワーキンググループから、 二次的所見の説明・同意のポイントをまとめたフローや患者説明文書案等が公開されている。
二次的所見に関する説明・同意のフロー²⁾
T/Nペア検査 : 腫瘍部組織と生殖細胞系列の変異を (正常細胞や採血等により) 同時に調べるパネル検査
(例 : OncoGuideᵀᴹ NCCオンコパネルシステム)
T only検査 : 腫瘍部組織のみを調べるパネル検査
(例 : FoundationOne® CDx がんゲノムプロファイル)
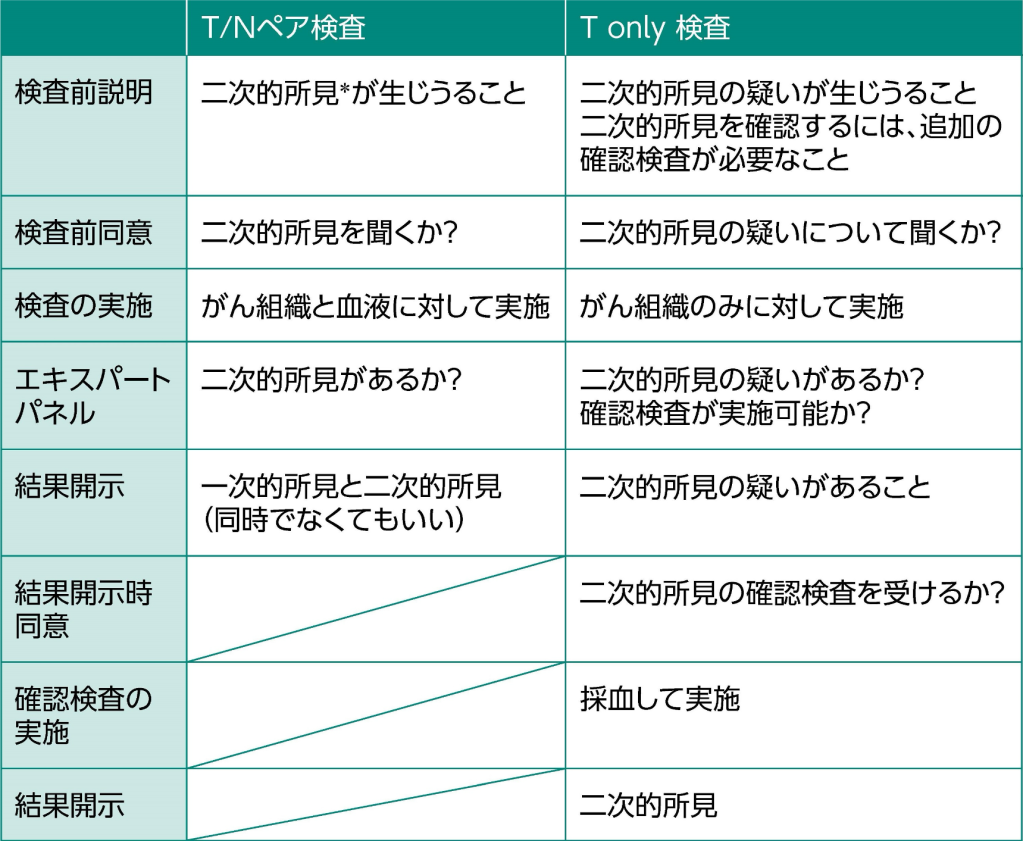
*この表での 「二次的所見」 とは、 開示すべき (対処法のある) 二次的所見を意味する。
患者説明文書・同意文書 (モデル文書) ³⁾

「がん遺伝子パネル検査に関する説明文書案 (モデル文書) 」 (2025/7/25閲覧)
遺伝カウンセリング
エキスパートパネルにおいて病歴や家族歴から遺伝性腫瘍の可能性が指摘された場合や、 結果開示の説明において、 患者・家族から遺伝性腫瘍についての懸念が示された場合は、 遺伝カウンセリングを含めた専門家による対応が求められる¹⁾。

悪性腫瘍の治療選択を目的としたMSI/MMR IHC検査を実施する際の患者説明と遺伝カウンセリングについては、 MSI/MMRをご参照ください。
引用文献
1) 平田真著. 二次的所見への対応. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p173-183, 2020
2) 日本医療研究開発機構. ゲノム医療における情報伝達プロセスに関する提言 その1 : がん遺伝子パネル検査を中心に (改定第2版)
3) 厚生労働省. 第2回がんゲノム医療推進コンソーシアム運営会議 (資料3-3) (https://www.mhlw.go.jp/content/10901000/000486801.pdf) (2025/7/25閲覧)
4) 浦川優作. 臨床検査 2020; 64: 1215-1240
リキッドバイオプシーを用いたバイオマーカー解析
リキッドバイオプシーの解析対象
リキッドバイオプシーとは血液や胸水、 尿などの中に存在する腫瘍由来の細胞やDNAなどを用いた解析である¹⁾²⁾。 本項では、 血液を中心に紹介する。
リキッドバイオプシーの解析対象には血中遊離DNA (cfDNA)、 血中循環腫瘍DNA (ctDNA)、 血中循環腫瘍細胞 (CTC) などがあるが、 ctDNAを用いたバイオマーカーの研究が盛んに行われている¹⁾³⁾。
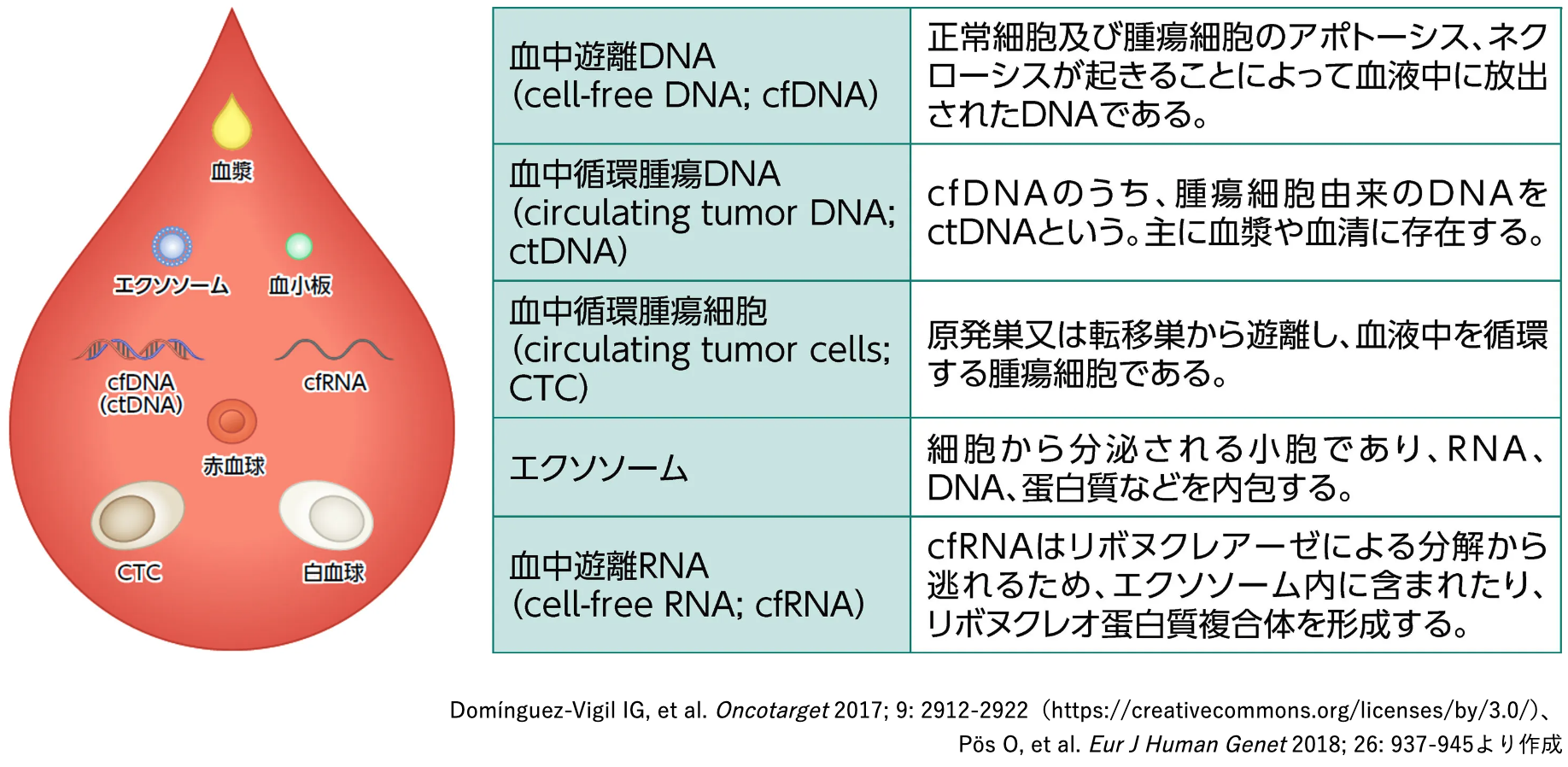
ctDNA検査とは
末梢血中のctDNAを対象としたリキッドバイオプシーは、 組織生検と比較して低侵襲であり、 繰り返し検体を採取することが可能である¹⁾³⁾。 また、 ctDNAの量は腫瘍量と相関し、 半減期は約2時間であることから、 ctDNAは腫瘍の不均一性やサブクローン変異、 腫瘍量などの変化を、 経時的かつリアルタイムに確認できると考えられている¹⁾³⁾⁴⁾。

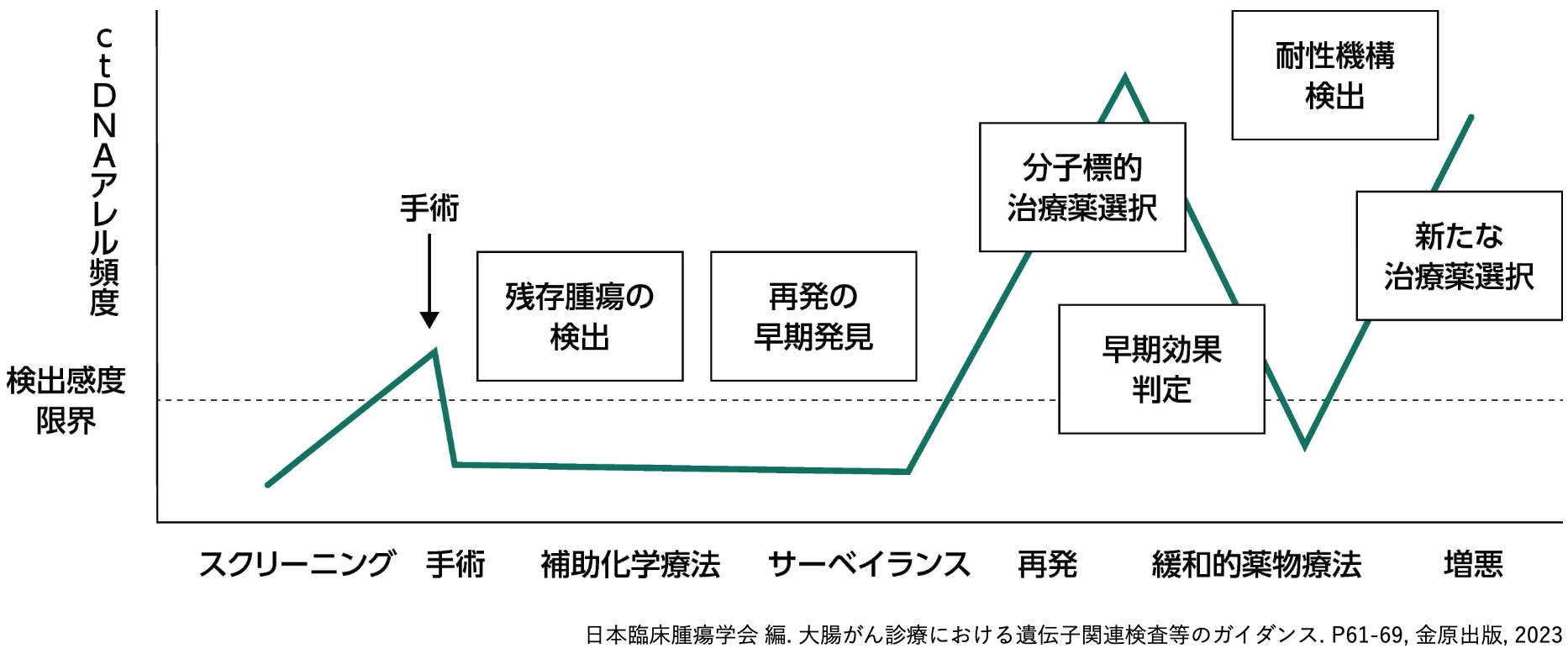
ctDNA検査が用いられる場面
ctDNAはリアルタイムにがんの遺伝的情報を確認することができることから、 がんの早期診断や再発の発見、 予後予測、 治療効果判定や薬剤耐性の検出などの臨床応用が期待される¹⁾⁴⁻⁶⁾。

臨床におけるctDNA検査を行うタイミング (大腸癌)
引用文献
1) Domínguez-Vigil IG, et al. Oncotarget 2017; 9: 2912-2922
2) Lone SN, et al. Mol Cancer 2022; 21(1): 79
3) Chen X, et al. Med Sci Monit 2020; 26: e921040
4) Pös O, et al. Eur J Human Genet 2018; 26: 937-945
5) Cheng ML, et al. CA Cancer J Clin 2021; 71: 176–190 本論文の著者にMSD社より資金提供等を受領している者が含まれる。
6) 西尾和人. 実験医学 2020; 38: 2536-2541
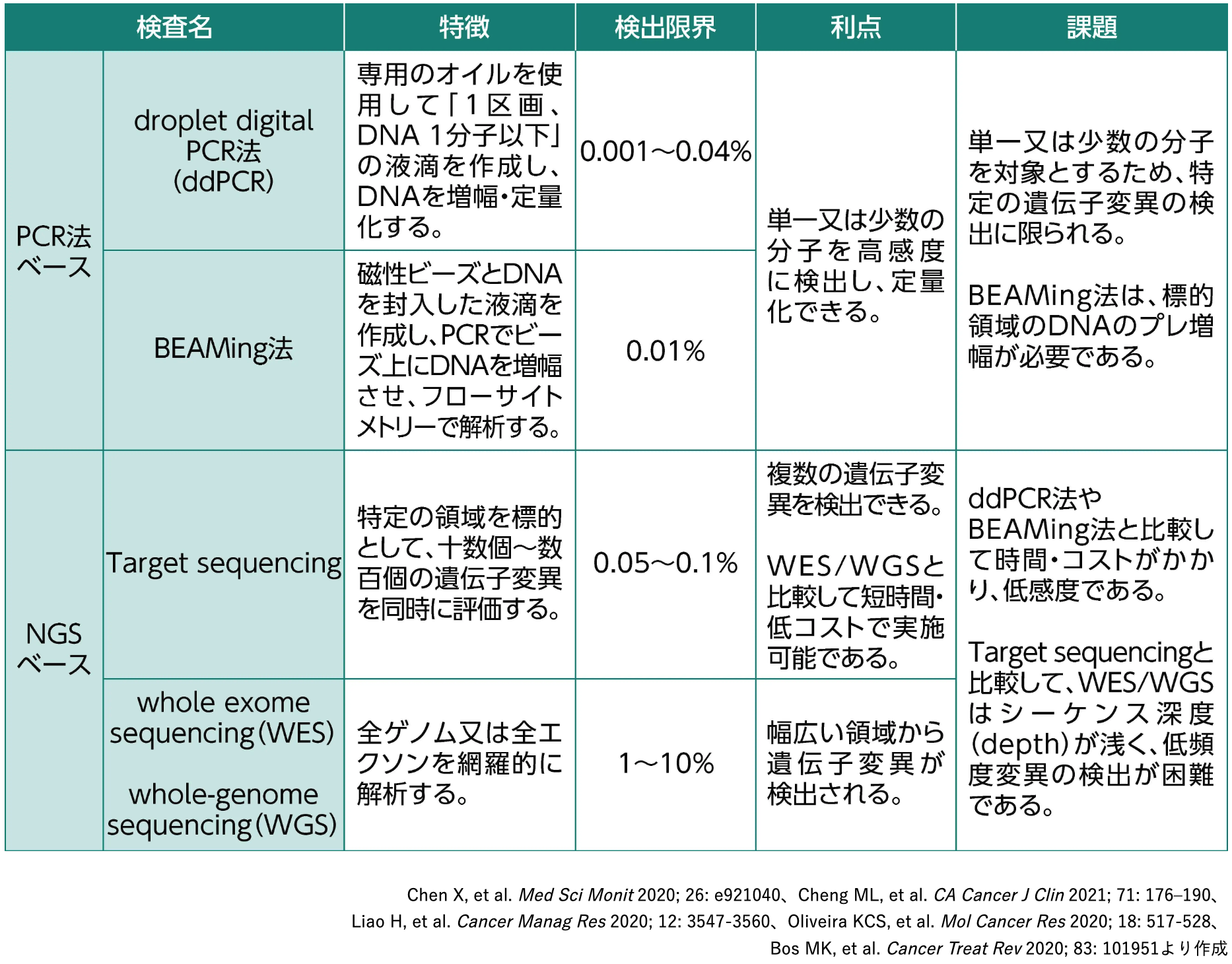
ctDNA検査方法の特徴
主なctDNA検査方法
ctDNAの解析には、 PCR法や次世代シーケンサー (NGS) をベースとした検査方法が用いられる。 これらの検査は感度、 検出可能な遺伝子の数・範囲などが異なり、 それぞれに利点や課題がある¹⁻³⁾。
引用文献
1) 西尾和人. 実験医学 2020; 38: 2536-2541
2) Bronkhorst AJ, et al. Biomol Detect Quantif 2019; 17: 100087
3) Liao H, et al. Cancer Manag Res 2020; 12: 3547-3560
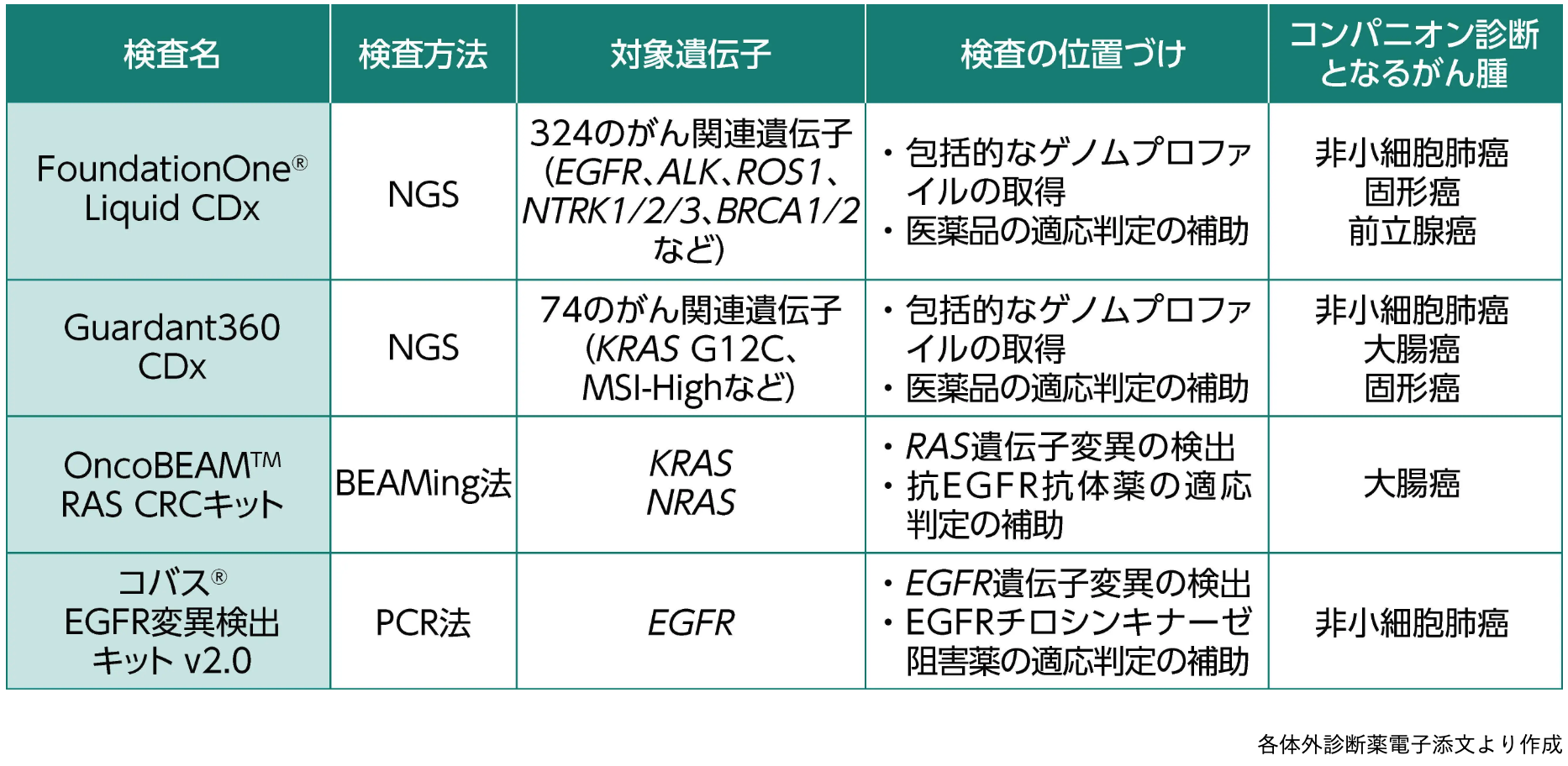
国内におけるリキッドバイオプシー検査の位置づけ
国内におけるリキッドバイオプシー検査
国内で使用可能なリキッドバイオプシーは、 主に包括的なゲノムプロファイルの取得、 医薬品の適応判定の補助に用いられている¹⁻⁴⁾。
医薬品の適応判定の補助として承認されているリキッドバイオプシーの最新情報は、 PMDAの 「コンパニオン診断薬等の情報」 をご参照ください
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
血漿検体と組織検体の使い分け
リキッドバイオプシーは低侵襲かつ検体採取が容易であるが、 ctDNA検査では十分な量のctDNAを採取できなければ遺伝子変異の検出率に影響し、 偽陰性となる恐れがある。 また、 正常細胞内のクローン造血由来の遺伝子変異 (clonal hematopoiesis of indeterminate potential; CHIP) との鑑別が困難であり、 偽陽性となる可能性もある⁵⁾。 組織検体においても、 検体の経年劣化や検体の処理、 保管条件などが影響して、 十分な核酸品質が得られない可能性があり、 実臨床では個々の患者の状態に応じて、 適切な検体を選択することが重要となる⁵⁾⁶⁾。
CGP検査において血漿検体を用いることが優先される状況

CGP検査において組織検体を用いることが優先される状況

引用文献
1) FoundationOne® Liquid CDx がんゲノムプロファイル電子添文 (第6版)
2) Guardant360 CDx がん遺伝子パネル電子添文 (第6版)
3) OncoBEAMTM RAS CRCキット電子添文 (第6版)
4) コバス® EGFR変異検出キット v2.0電子添文 (第12版)
5) 日本臨床腫瘍学会、 日本癌治療学会、 日本癌学会 3学会合同ゲノム医療推進タスクフォース. 血中循環腫瘍DNAを用いたがんゲノムプロファイリング検査の適正使用に関する政策提言. 2021
6) 日本病理学会編. ゲノム研究用・診療用病理組織検体取扱い規程.P129-155、 羊土社、 2019
他のバイオマーカー検査コンテンツ




編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん遺伝子パネル検査
記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。 また、 承認されたコンパニオン診断薬等の最新情報については、 こちらをご確認ください。

アドバイザー : 国立がん研究センター中央病院 病理診断科 科長 谷田部 恭 先生、 近畿大学医学部 ゲノム生物学教室 教授 西尾 和人 先生
がん遺伝子パネル検査の概要
がん遺伝子パネル検査の機能と分類
がん遺伝子パネル検査は、 その機能から、 「マルチプレックスコンパニオン診断薬」 と 「がんゲノムプロファイリング検査」 の2種類に大別できる¹⁾。

TMB: tumor mutation burden MSI:microsatellite instability
角南久仁子著. 臨床のためのがん遺伝子パネル検査のABC. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p31-41, 2020より作図
MSI、 TMBの詳細につきましては、 以下を参照ください。 MSI/MMR TMB
- 従来のがん遺伝子検査は、 分子標的薬の適応となるバイオマーカーの有無を調べるためのコンパニオン診断薬が主体であった¹⁾。
- マルチプレックスコンパニオン診断薬の代表的なものが、 肺癌の遺伝子異常を調べるオンコマインᵀᴹ Dx Target Test マルチCDxシステムであり、 2019年に薬事承認された¹⁾。 2025年7月時点において、 BRAF遺伝子 V600E変異、 EGFR遺伝子変異、 HER2遺伝子変異、 ALK融合遺伝子、 ROS1融合遺伝子、 RET融合遺伝子、 MET遺伝子エクソン14スキッピング変異、 RET遺伝子変異を対象とした分子標的薬の適応判定の補助を目的とした検査である²⁾。 また、 2021年に承認されたAmoyDx® 肺癌マルチ遺伝子PCRパネルでは、 DNA中の遺伝子変異 (EGFR遺伝子変異、 BRAF遺伝子変異 (V600E) 及びKRAS遺伝子変異 (G12C) )、 RNA中の融合遺伝子 (ALK融合遺伝子、 ROS1融合遺伝子、 RET融合遺伝子)、 MET遺伝子エクソン14スキッピング変異の検出が可能となっている (2025年7月時点) ³⁾。
- 肺癌におけるEGFR遺伝子、 ALK融合遺伝子、 ROS1融合遺伝子、 大腸癌におけるKRAS遺伝子、 NRAS遺伝子など、 一部の遺伝子及びがん種について、 コンパニオン診断薬としての機能を有しているがんゲノムプロファイリング検査もある¹⁾。
検査に用いる検体は組織検体と血漿検体の2種類⁴⁾⁵⁾

- リキッドバイオプシーや検体の使い分け、 ctDNAの詳細等は下部の「リキッドバイオプシー」 の項をご参照ください。
- 実際の検体の取り扱いにあたっては、 各医療機器の電子添文及びゲノム研究用・診療用病理組織検体取扱い規程⁶⁾等を参考にしてください。
各がんゲノムプロファイリング検査の主な特徴¹⁾⁶⁻¹²⁾
固形がんを対象とした主ながんゲノムプロファイリング検査の特徴を表に示した。 このうち、 FoundationOne® CDx及びLiquid CDx、 Guardant360 CDxはマルチプレックスコンパニオン診断薬としての機能も有している。


がんゲノムプロファイリング検査の保険点数
保険診療における対象患者
保険診療におけるがんゲノムプロファイリング検査の対象は、 標準治療がない固形がん患者、 または標準治療が終了となった局所進行/転移を有する固形がん患者とされている¹⁵⁾。
本検査は、 標準治療がない*¹固形がん患者又は局所進行若しくは転移が認められ標準治療が終了*²となった固形がん患者 (終了が見込まれる者を含む。 )
かつ
関連学会の化学療法に関するガイドライン等に基づき、 全身状態及び臓器機能等から、 本検査施行後に化学療法の適応となる可能性が高いと主治医が判断した患者¹⁶⁾
*¹ 希少がんや原発不明がん等、 標準治療が確立していない固形がん患者には、 治療法の選択の一助とすることを想定し治療開始前の実施が推奨される¹⁷⁾。
*² 各疾患における標準治療がどの範囲を指すのかについては、 関連学会等のガイドラインに従い、 個々の症例で担当医が判断をすべきである¹⁷⁾。
検査実施の流れと保険点数の算定
がんゲノムプロファイリング検査関連の保険点数は、 事前の患者説明及び同意取得後、 検体を検査機関に提出した時点で44,000点、 エキスパートパネルで解析レポートについて検討し、 その結果と治療方針等について患者に説明を行った時点で12,000点を算定することができる¹⁵⁾¹⁸⁾。

- 血漿検体の利用は 「医学的な理由により、 固形腫瘍の腫瘍細胞を検体としてがんゲノムプロファイリング検査を行うことが困難な場合」 または 「固形腫瘍の腫瘍細胞を検体として実施したがんゲノムプロファイリング検査において、 包括的なゲノムプロファイルの結果を得られなかった場合」 に限定されている¹⁹⁾。
引用文献
1) 角南久仁子著. 臨床のためのがん遺伝子パネル検査のABC. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p31-41, 2020
2) オンコマインᵀᴹ Dx Target Test マルチ CDxシステム電子添文 (第21版)
3) AmoyDx® 肺癌マルチ遺伝子PCRパネル電子添文 (第11版)
4) Aggarwal C et al. Nat Rev Clin Oncol 2021;18: 56-62. 本論文の著者にMSD社よりコンサルタント料等を受領している者が含まれる。
5) 日本臨床腫瘍学会、 日本癌治療学会、 日本癌学会 3学会合同ゲノム医療推進タスクフォース. 血中循環腫瘍DNAを用いたがんゲノムプロファイリング検査の適正使用に関する政策提言. 2021
6) 日本病理学会編.ゲノム研究用・診療用病理組織検体取扱い規程, 羊土社, 2019
7) 梶原敦子 他著. FoundationOne® Liquid. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p219-224, 2020
8) FoundationOne® CDx がんゲノムプロファイル電子添文 (第23版)
9) OncoGuideᵀᴹ NCC オンコパネル システム電子添文 (第5版)
10) FoundationOne® Luquid CDx がんゲノムプロファイル電子添文 (第6版)
11) Guardant360® CDx がん遺伝子パネル電子添文 (第6版)
12) 株式会社エスアールエル. SRL総合検査案内 Guardant360® CDxがん遺伝子パネル.
(https://test-guide.srl.info/hachioji/test/detail/04531A101) (2025/7/25閲覧)
13) GenMineTOP® がんゲノムプロファイリングシステム電子添文 (第3版)
14) TruSight Oncology Comprehensive パネルシステム電子添文 (第1版)
15) 二宮貴一朗 他. Current Therapy 2020; 38: 877-881、 厚生労働省. 令和4年度診療報酬改定の概要 (全体版) より作図
16) 厚生労働省. 医療機器の保険適用について (令和元年6月収載予定)
(https://www.mhlw.go.jp/content/12404000/000513115.pdf) (2025/7/25閲覧)
17) 日本臨床腫瘍学会・日本癌治療学会・日本癌学会 次世代シークエンサー等を用いた 遺伝子パネル検査に基づく がん診療ガイダンス, p89, 2020
18) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部を改正する告示
(https://www.mhlw.go.jp/content/12404000/001251499.pdf) (2025/7/25閲覧)
19) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部改正に伴う実施上の留意事項について
(https://www.mhlw.go.jp/content/12404000/001293312.pdf) (2025/7/25閲覧)
がん遺伝子パネル検査に関する制度
がんゲノム医療の提供体制
がんゲノムプロファイリング検査は、 厚生労働大臣が指定した 「がんゲノム医療中核拠点病院 (中核拠点病院) 」、 「がんゲノム医療拠点病院 (拠点病院) 」、 「がんゲノム医療連携病院 (連携病院) 」 でのみ検査実施が可能となっている¹⁾。
がんゲノム医療中核拠点病院の主な指定要件 (診療機能) ¹⁾²⁾

がんゲノム中核拠点病院等の指定を受けた医療機関 (令和7年8月1日時点)

最新のがんゲノム医療中核拠点病院等の一覧については厚生労働省ホームページをご参照ください。
がんゲノム医療中核拠点病院、 拠点病院及び連携病院の全体像
がんゲノム医療を必要とする患者が全国どこにいてもがんゲノム医療を受けられるように、 がんゲノム医療を牽引する中核拠点病院、 中核拠点病院と連携しながらゲノム医療を行う医療機関として拠点病院及び連携病院による体制が整備されている²⁾³⁾。

- がんゲノム医療中核拠点病院 : がんゲノム医療の提供においてすべての工程を行える施設。 がんゲノム医療の実施だけでなく、 人材育成、 診療支援、 治験や先進医療の主導、 研究開発などを担い、 がんゲノム医療をけん引する高度な機能を有する医療施設である²⁻⁴⁾。
- がんゲノム医療拠点病院 : がんゲノム医療を提供する機能を有し、 拠点となる医療機関。 がん遺伝子パネル検査の医学的な解釈が自施設で完結できる。 人材育成、 治験・先進医療の主導、 研究開発に関してがんゲノム医療中核拠点病院と連携すること以外は、 がんゲノム医療中核拠点病院と同じ医療体制となる²⁻⁴⁾。
- がんゲノム医療連携病院 : 中核拠点病院または拠点病院によって指定された医療機関で、 患者説明や検体準備、 治療方針の説明、 その後の治療などを担う。 解析結果の解釈は中核拠点病院または拠点病院に依頼し、 担当医がエキスパートパネルに参加する²⁻⁴⁾。

引用文献
1) 沖田南都子著. がんゲノム医療の提供体制. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p12-20, 2020
2) 厚生労働省. がんゲノム医療中核拠点病院等の整備について (令和4年8月1日) (https://www.mhlw.go.jp/content/001216103.pdf) (2025/7/25閲覧)
3) 上野秀樹. Current Therapy 2020; 38: 858-864
4) 厚生労働省. がんゲノム医療中核拠点病院等の指定について (令和5年2月13日) (https://www.mhlw.go.jp/content/10901000/001056905.pdf) (2025/7/25閲覧)
二次的所見と遺伝カウンセリング
がん遺伝子パネル検査における“二次的所見”
「二次的所見」 とは、 がんの治療方針の策定という本来の検査目的ではない所見、 特に生殖細胞系列に病的と確定できる遺伝子変異 (バリアント) が検出されることを指す¹⁾。

がんゲノムプロファイリング検査の事前説明の段階で、 二次的所見が得られる可能性があること、 そして二次的所見がみられた場合の結果の開示を希望するか否かを確認する必要がある¹⁾。 日本医療研究開発機構 (AMED) の研究班や厚生労働省のワーキンググループから、 二次的所見の説明・同意のポイントをまとめたフローや患者説明文書案等が公開されている。
二次的所見に関する説明・同意のフロー²⁾
T/Nペア検査 : 腫瘍部組織と生殖細胞系列の変異を (正常細胞や採血等により) 同時に調べるパネル検査
(例 : OncoGuideᵀᴹ NCCオンコパネルシステム)
T only検査 : 腫瘍部組織のみを調べるパネル検査
(例 : FoundationOne® CDx がんゲノムプロファイル)

*この表での 「二次的所見」 とは、 開示すべき (対処法のある) 二次的所見を意味する。
患者説明文書・同意文書 (モデル文書) ³⁾

「がん遺伝子パネル検査に関する説明文書案 (モデル文書) 」 (2025/7/25閲覧)
遺伝カウンセリング
エキスパートパネルにおいて病歴や家族歴から遺伝性腫瘍の可能性が指摘された場合や、 結果開示の説明において、 患者・家族から遺伝性腫瘍についての懸念が示された場合は、 遺伝カウンセリングを含めた専門家による対応が求められる¹⁾。

悪性腫瘍の治療選択を目的としたMSI/MMR IHC検査を実施する際の患者説明と遺伝カウンセリングについては、 MSI/MMRをご参照ください。
引用文献
1) 平田真著. 二次的所見への対応. 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, p173-183, 2020
2) 日本医療研究開発機構. ゲノム医療における情報伝達プロセスに関する提言 その1 : がん遺伝子パネル検査を中心に (改定第2版)
3) 厚生労働省. 第2回がんゲノム医療推進コンソーシアム運営会議 (資料3-3) (https://www.mhlw.go.jp/content/10901000/000486801.pdf) (2025/7/25閲覧)
4) 浦川優作. 臨床検査 2020; 64: 1215-1240
リキッドバイオプシーを用いたバイオマーカー解析
リキッドバイオプシーの解析対象
リキッドバイオプシーとは血液や胸水、 尿などの中に存在する腫瘍由来の細胞やDNAなどを用いた解析である¹⁾²⁾。 本項では、 血液を中心に紹介する。
リキッドバイオプシーの解析対象には血中遊離DNA (cfDNA)、 血中循環腫瘍DNA (ctDNA)、 血中循環腫瘍細胞 (CTC) などがあるが、 ctDNAを用いたバイオマーカーの研究が盛んに行われている¹⁾³⁾。

ctDNA検査とは
末梢血中のctDNAを対象としたリキッドバイオプシーは、 組織生検と比較して低侵襲であり、 繰り返し検体を採取することが可能である¹⁾³⁾。 また、 ctDNAの量は腫瘍量と相関し、 半減期は約2時間であることから、 ctDNAは腫瘍の不均一性やサブクローン変異、 腫瘍量などの変化を、 経時的かつリアルタイムに確認できると考えられている¹⁾³⁾⁴⁾。

ctDNA検査が用いられる場面
ctDNAはリアルタイムにがんの遺伝的情報を確認することができることから、 がんの早期診断や再発の発見、 予後予測、 治療効果判定や薬剤耐性の検出などの臨床応用が期待される¹⁾⁴⁻⁶⁾。

臨床におけるctDNA検査を行うタイミング (大腸癌)

引用文献
1) Domínguez-Vigil IG, et al. Oncotarget 2017; 9: 2912-2922
2) Lone SN, et al. Mol Cancer 2022; 21(1): 79
3) Chen X, et al. Med Sci Monit 2020; 26: e921040
4) Pös O, et al. Eur J Human Genet 2018; 26: 937-945
5) Cheng ML, et al. CA Cancer J Clin 2021; 71: 176–190 本論文の著者にMSD社より資金提供等を受領している者が含まれる。
6) 西尾和人. 実験医学 2020; 38: 2536-2541
ctDNA検査方法の特徴
主なctDNA検査方法
ctDNAの解析には、 PCR法や次世代シーケンサー (NGS) をベースとした検査方法が用いられる。 これらの検査は感度、 検出可能な遺伝子の数・範囲などが異なり、 それぞれに利点や課題がある¹⁻³⁾。

引用文献
1) 西尾和人. 実験医学 2020; 38: 2536-2541
2) Bronkhorst AJ, et al. Biomol Detect Quantif 2019; 17: 100087
3) Liao H, et al. Cancer Manag Res 2020; 12: 3547-3560
国内におけるリキッドバイオプシー検査の位置づけ
国内におけるリキッドバイオプシー検査
国内で使用可能なリキッドバイオプシーは、 主に包括的なゲノムプロファイルの取得、 医薬品の適応判定の補助に用いられている¹⁻⁴⁾。

医薬品の適応判定の補助として承認されているリキッドバイオプシーの最新情報は、 PMDAの 「コンパニオン診断薬等の情報」 をご参照ください
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
血漿検体と組織検体の使い分け
リキッドバイオプシーは低侵襲かつ検体採取が容易であるが、 ctDNA検査では十分な量のctDNAを採取できなければ遺伝子変異の検出率に影響し、 偽陰性となる恐れがある。 また、 正常細胞内のクローン造血由来の遺伝子変異 (clonal hematopoiesis of indeterminate potential; CHIP) との鑑別が困難であり、 偽陽性となる可能性もある⁵⁾。 組織検体においても、 検体の経年劣化や検体の処理、 保管条件などが影響して、 十分な核酸品質が得られない可能性があり、 実臨床では個々の患者の状態に応じて、 適切な検体を選択することが重要となる⁵⁾⁶⁾。
CGP検査において血漿検体を用いることが優先される状況

CGP検査において組織検体を用いることが優先される状況

引用文献
1) FoundationOne® Liquid CDx がんゲノムプロファイル電子添文 (第6版)
2) Guardant360 CDx がん遺伝子パネル電子添文 (第6版)
3) OncoBEAMTM RAS CRCキット電子添文 (第6版)
4) コバス® EGFR変異検出キット v2.0電子添文 (第12版)
5) 日本臨床腫瘍学会、 日本癌治療学会、 日本癌学会 3学会合同ゲノム医療推進タスクフォース. 血中循環腫瘍DNAを用いたがんゲノムプロファイリング検査の適正使用に関する政策提言. 2021
6) 日本病理学会編. ゲノム研究用・診療用病理組織検体取扱い規程.P129-155、 羊土社、 2019
他のバイオマーカー検査コンテンツ




編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




