PD-L1
提供:MSD株式会社
記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。 また、 承認されたコンパニオン診断薬等の最新情報については、 こちらをご確認ください。

アドバイザー : 国立がん研究センター中央病院 病理診断科 科長 谷田部恭先生、 関西医科大学 病理学講座 教授 蔦幸治先生
PD-L1の概要
PD-L1とは
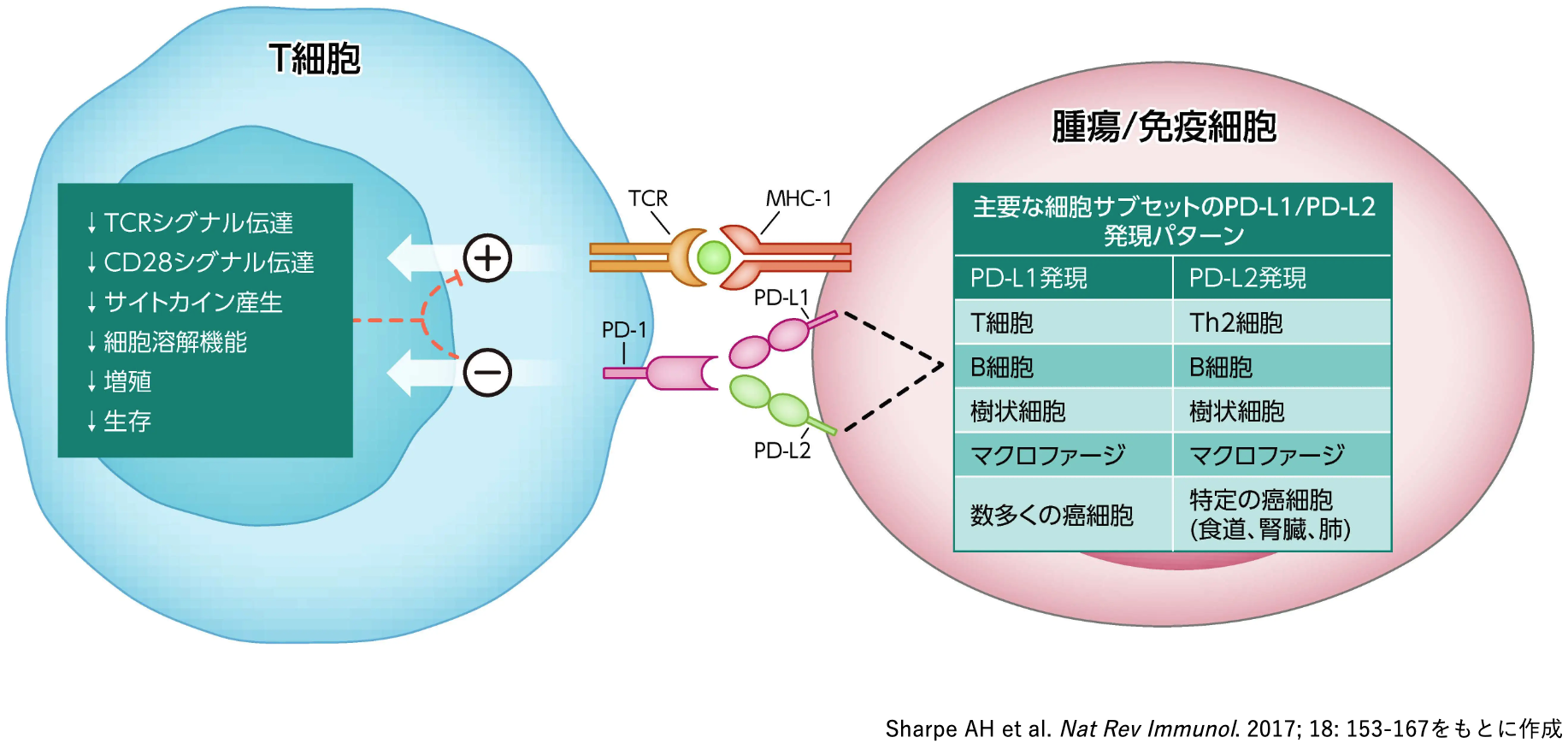
PD-L1は免疫応答に関与するT細胞、 B細胞、 NK細胞のほか、 樹状細胞や制御性T細胞、 骨髄由来抑制細胞などに発現する免疫チェックポイント分子である¹⁾²⁾。
PD-L1は、 活性化するT細胞上に発現するPD-1と結合することでT細胞の活性化を抑制し、 感染症における過剰な炎症反応や自己免疫に対する免疫寛容に関与する²⁾。
しかし、 腫瘍微小環境下で種々の細胞に発現するPD-L1は腫瘍細胞の免疫逃避に関わることから、 治療標的として注目されている。

PD-1/PD-L1経路を介した免疫逃避メカニズム
PD-1は、 腫瘍微小環境中に発現するPD-L1/2と結合することで、 T細胞の活性化や増殖、 サイトカイン産生などを抑制し、 腫瘍細胞の生存に関与する¹⁾²⁾。
PD-1/PD-L1経路は、 主としてT細胞による腫瘍細胞への攻撃の抑制において重要な役割を担っている。 また、 抗原提示によるT細胞活性化の阻害にも関与していると考えられている¹⁾³⁾。
引用文献
1) Sharpe AH et al. Nat Rev Immunol. 2017; 18: 153-167.
2) Pardoll DM Nat Rev Cancer. 2012; 12: 252-264.
3) Chen DS et al. Immunity. 2013; 39: 1-10.
効果予測バイオマーカーとしてのPD-L1
PD-L1のメカニズムに基づく効果予測
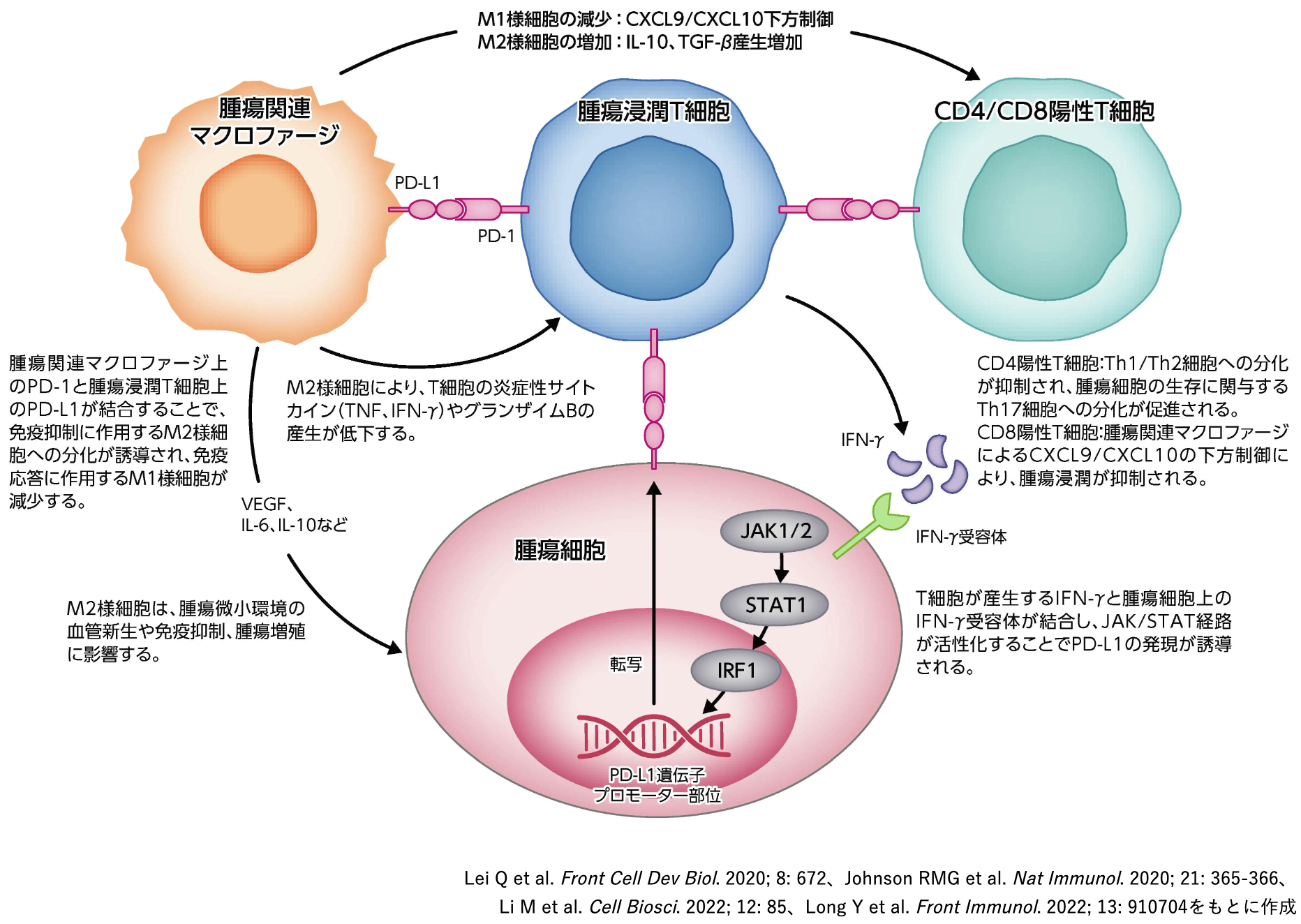
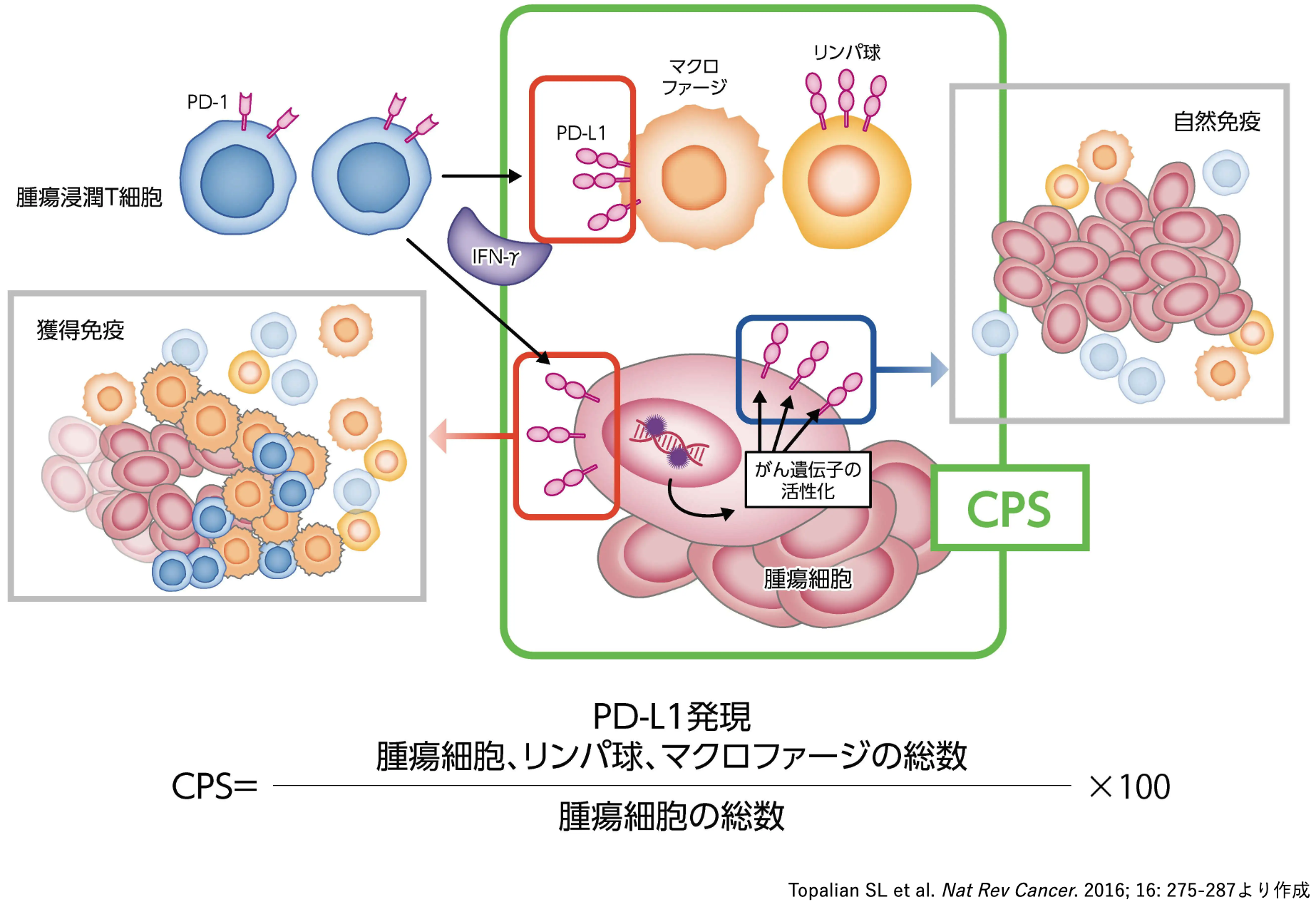
T細胞に発現するPD-1は、 腫瘍微小環境下の種々の細胞で発現するPD-L1と結合し、 T細胞の過剰な活性化を抑制して免疫寛容を成立させる。 したがってPD-L1は、 腫瘍細胞に限らず正常な免疫細胞、 樹状細胞などにも発現が認められる¹⁻³⁾。 PD-L1およびPD-L2の発現は炎症性サイトカインやインターフェロン (IFN) によって誘導され、 腫瘍微小環境では浸潤したT細胞が産生するIFNによって腫瘍、 マクロファージおよび免疫細胞上に発現が誘導される¹⁾。 そのため、 腫瘍組織におけるPD-L1の発現は、 腫瘍に浸潤したT細胞によって、 抗原特異的な免疫反応が起こっている事を示す指標になると考えられる⁴⁾。 一方、 腫瘍微小環境下で発現するPD-L1は、 T細胞上に発現するPD-1を介して腫瘍細胞特異的な免疫反応を抑制する。 したがって、 PD-L1の発現は、 PD-1/PD-L1経路を遮断してT細胞の腫瘍免疫を回復する免疫チェックポイント阻害剤の効果予測バイオマーカーとなることが報告されている⁵⁾。
引用文献
1) Sharpe AH et al. Nat Rev Immunol. 2017; 18: 153-167.
2) Pardoll DM Nat Rev Cancer. 2012; 12: 252-264.
3) Dolled-Filhart M et al. Arch Pathol Lab Med. 2016; 140: 1243-1249.
4) Yi M et al. Mol Cancer. 2018; 17: 129.
5) Sunshine J et al. Curr Opin Pharmacol. 2015; 23: 32-38.
日本で承認されているPD-L1検査の種類
国内で用いられるPD-L1検査の特徴
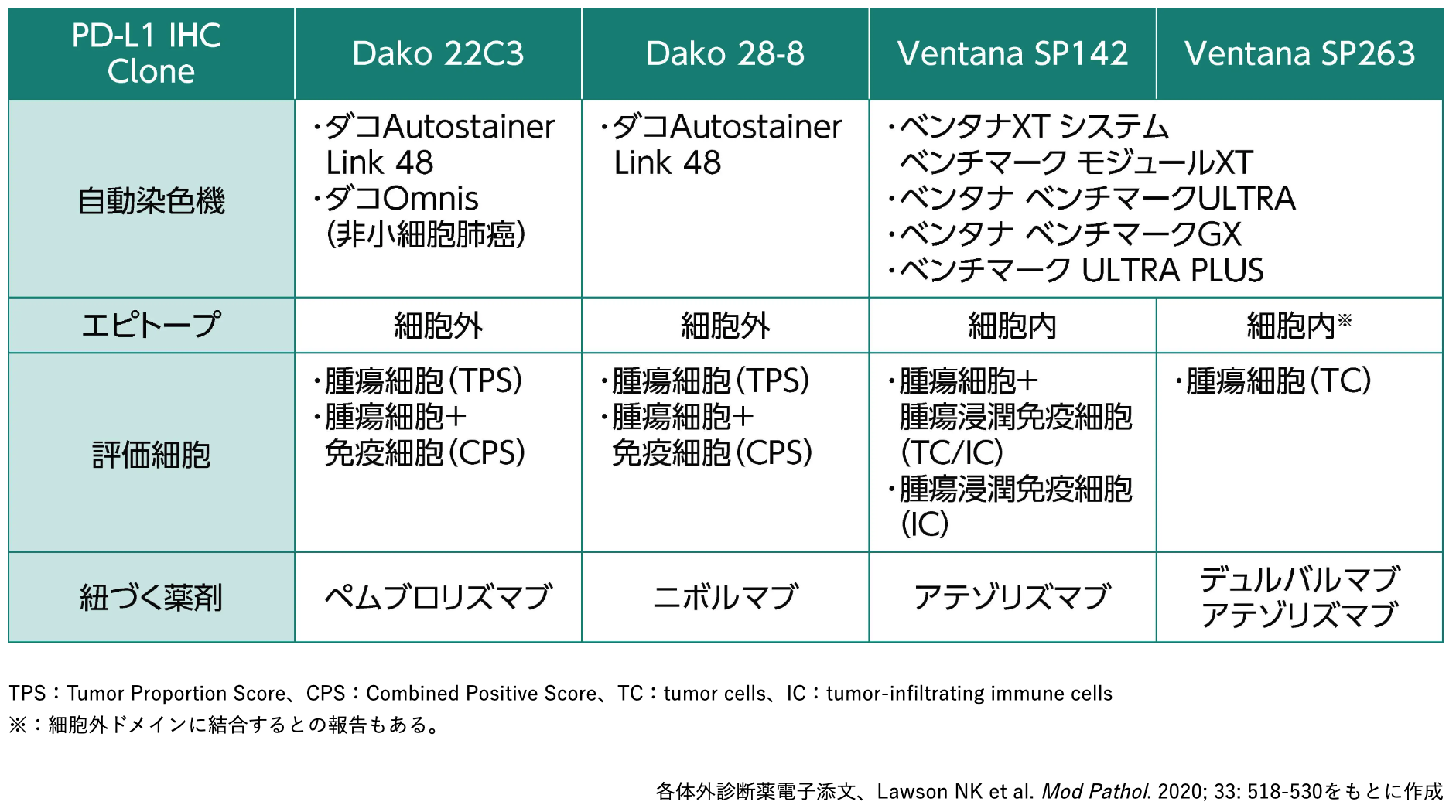
免疫組織化学染色 (IHC) によるPD-L1検査は、 抗体ごとに特性、 評価法、 および紐づく抗PD-1/L1抗体薬が異なる。 現在、 日本で承認されているPD-L1検査の種類を下表にまとめた (2025年7月時点)。
臓器別PD-L1検査の承認状況
がん種・診断薬別のPD-L1検査の位置づけ
抗PD-1/L1抗体薬におけるPD-L1検査の位置づけはがん種によって異なり、 コンパニオン診断 (投与前の必須の検査)、 またはコンプリメンタリー診断 (参考になるが必須の検査ではない) として用いられる。
また、 がん種によって評価方法 (TPS、 CPS、 TC、 IC)、 薬剤適応のカットオフ値も異なる。


22C3抗体による評価方法 : TPS、 CPS
本項から、 22C3抗体による検査方法について紹介する。
PD-L1検査の指標 (TPS/CPS)
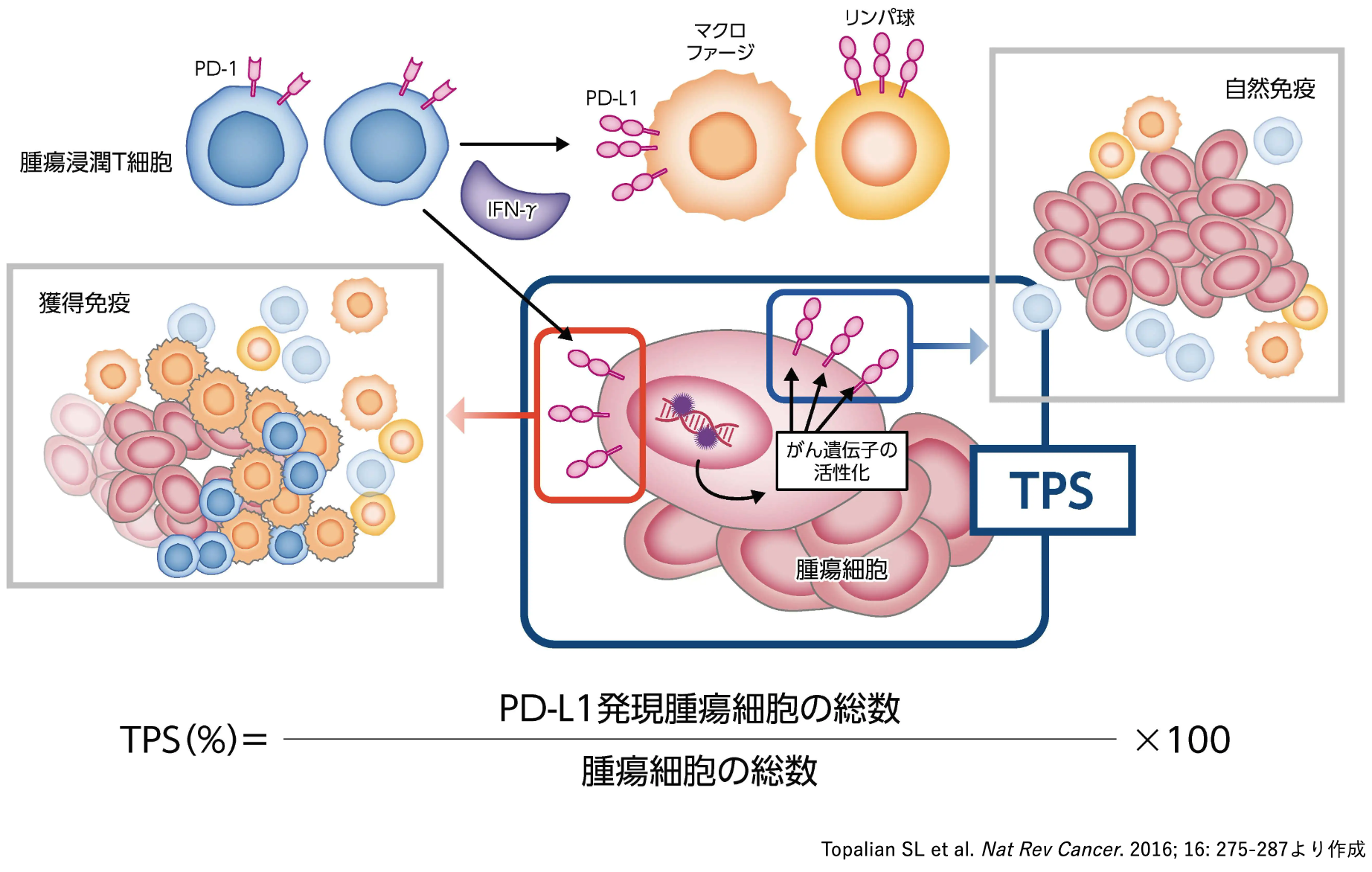
PD-L1検査には、 腫瘍細胞のみに発現しているPD-L1のみを評価する指標であるTPS (Tumor Proportion Score) と、 腫瘍および免疫細胞に発現しているPD-L1を合わせて評価する指標であるCPS (Combined Positive Score) の2つが存在する。 PD-L1検査を、 免疫チェックポイント阻害剤の効果予測バイオマーカーとして使用する場合は、 がん種、 薬剤毎に、 臨床試験で有効性が検証された指標を使用しなければならない。
TPS (Tumor Proportion Score)
TPSは、 染色標本上の全腫瘍細胞に対し、 PD-L1陽性の腫瘍細胞が占める割合 (%) を示した指標である¹⁻³⁾。 ペムブロリズマブのコンパニオン診断としては、 切除不能な進行・再発の非小細胞肺癌のみに用いられる。

CPS (Combined Positive Score)
CPSは、 染色標本上の浸潤部位において、 PD-L1陽性の腫瘍細胞および免疫細胞 (リンパ球、 マクロファージ) を合わせて評価する指標である²⁾⁴⁻⁸⁾。 ペムブロリズマブのコンパニオン診断、 コンプリメンタリー診断のいずれにも用いられている (対象となるがん種は前述の「臓器別PD-L1検査の承認状況」 を参照)。

引用文献
1) PD-L1 IHC 22C3 pharmDx 「ダコ」 (Code No. GE006、 ダコ Omnis) 電子添文
2) PD-L1 IHC 22C3 pharmDx 「ダコ」 (Code No. SK006、 ダコ Autostainer Link 48) 電子添文
3) PD-L1 IHC 22C3 pharmDx 「ダコ」 非小細胞肺癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29403ja-d62944-02-pd-l1-ihc-22c3-as-omnis-nsclc-im-ja-jp.pdf (2025/7/10閲覧)
4) PD-L1 IHC 22C3 pharmDx 「ダコ」 頭頸部癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29339jajp_pd_l1_ihc_22c3_hnscc_interpretation_manual.pdf) (2025/7/10閲覧)
5) PD-L1 IHC 22C3 pharmDx 「ダコ」 食道扁平上皮癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29361ja_pd_l1_ihc_22c3_escc_interpretation_manual_kn181.pdf) (2025/7/10閲覧)
6) PD-L1 IHC 22C3 pharmDx 「ダコ」 トリプルネガティブ乳癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29425ja-d66489-pdl1-ihc-22C3-pharmdx-tnbc-interpretation-manual-japan.pdf) (2025/7/10閲覧)
7) PD-L1 IHC 22C3 pharmDx 「ダコ」 子宮頸癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29558ja-pd-l1-22c3-cervical-interpretation-manual-kn826.pdf) (2025/7/10閲覧)
8) PD-L1 IHC 22C3 pharmDx 「ダコ」 胃癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29621ja-pdl1-22c3-gastric-im-jp.pdf) (2025/7/10閲覧)
22C3抗体によるがん種別のPD-L1発現頻度
ペムブロリズマブの各国際共同試験におけるPD-L1の発現頻度
ペムブロリズマブの各国際共同試験におけるPD-L1発現頻度を下表にまとめた¹⁻¹²⁾。
また、 各臨床試験のPD-L1検査では、 22C3抗体が用いられた。


引用文献
1) Herbst RS et al. Lancet. 2016; 387: 1540-1550.
2) 承認時評価資料 : 国際共同第Ⅱ/Ⅲ相試験 (KEYNOTE-010試験)
3) Reck M et al. N Engl J Med. 2016; 375: 1823-1833.
4) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-024試験)
5) Mok TSK et al. Lancet. 2019; 393: 1819-1830.
6) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-042試験)
7) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-048試験)
8) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-181試験)
9) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-355試験)
10) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-826試験)
11) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-859試験)
12) 電子添文改訂時評価資料 : 国際共同第III相試験 (KEYNOTE-811試験)
論文1,3,5)は、 MSD社の資金提供及び著者に同社の社員を含む。
PD-L1検査(22C3抗体)における検体の取り扱い
検査および検体の取り扱いにおける留意点¹⁻⁹⁾
適切なPD-L1検査を行うには、 技術的な差異が結果に影響するリスクをできる限り最小化し、 精度を高めることが重要になる。 治療薬に対応した特定の診断薬キットの使用方法を遵守し、 手技に習熟するなどの取り組みによって、 ばらつきを少なくすることが可能である。

各がん種における薄切後の切片の保管¹⁻⁸⁾
組織検体の抗原性低下によって偽陰性が生じる可能性があるため、 薄切した未染色組織検体は冷暗所 (2~8℃) での保管が推奨される。 また、 室温 (25℃まで) での保管も可能である。
各がん種毎に未染色組織検体の保管期間が検討されており、 冷暗所 (2~8度) で2~6ヵ月、 室温 (25℃) で1~4ヵ月との報告がある。 詳細については、 Dako社の判定マニュアルを参考にすること³⁻⁸⁾。
引用文献
1) PD-L1 IHC 22C3 pharmDx 「ダコ」 (Code No. GE006、 ダコ Omnis) 電子添文
2) PD-L1 IHC 22C3 pharmDx 「ダコ」 (Code No. SK006、 ダコ Autostainer Link 48) 電子添文
3) PD-L1 IHC 22C3 pharmDx 「ダコ」 非小細胞肺癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29403ja-d62944-02-pd-l1-ihc-22c3-as-omnis-nsclc-im-ja-jp.pdf) (2025/7/10閲覧)
4) PD-L1 IHC 22C3 pharmDx 「ダコ」 頭頸部癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29339jajp_pd_l1_ihc_22c3_hnscc_interpretation_manual.pdf) (2025/7/10閲覧)
5) PD-L1 IHC 22C3 pharmDx 「ダコ」 食道扁平上皮癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29361ja_pd_l1_ihc_22c3_escc_interpretation_manual_kn181.pdf) (2025/7/10閲覧)
6) PD-L1 IHC 22C3 pharmDx 「ダコ」 トリプルネガティブ乳癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29425ja-d66489-pdl1-ihc-22C3-pharmdx-tnbc-interpretation-manual-japan.pdf) (2025/7/10閲覧)
7) PD-L1 IHC 22C3 pharmDx 「ダコ」 子宮頸癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29558ja-pd-l1-22c3-cervical-interpretation-manual-kn826.pdf) (2025/7/10閲覧)
8) PD-L1 IHC 22C3 pharmDx 「ダコ」 胃癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29621ja-pdl1-22c3-gastric-im-jp.pdf) (2025/7/10閲覧)
9) 日本肺癌学会バイオマーカー委員会 編 : 肺癌患者におけるバイオマーカー検査の手引きv2.1.1. 2025
国内におけるPD-L1検査の概要
PD-L1検査の診療報酬¹⁾²⁾
診療報酬点数表 : 第2章 特掲診療料―第13部 病理診断―第1節 病理標本作製料

引用文献
1) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部を改正する告示 (https://www.mhlw.go.jp/content/12404000/001251499.pdf) (2025/7/10閲覧)
2) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部改正に伴う実施上の留意事項について (https://www.mhlw.go.jp/content/12404000/001293312.pdf) (2025/7/10閲覧)
PD-L1発現陽性のカットオフ
ROC曲線を用いた感度分析
臨床において、 効果予測バイオマーカーを測定する目的の一つは、 特定の薬剤の治療効果が期待できる患者を予測、 同定することである。 検査にて測定した結果を正しく解釈する為に、 適切なカットオフ値を設定する必要がある。 カットオフ値の設定には、 臨床試験で得られた検査の真の陽性率 : 感度 (Sensitivity) と真の陰性率 : 特異度 (Specificity) を基に、 Receiver Operating Characteristic Curve (以下、 ROC曲線) を用い、 真の陽性率が最大に、 偽陽性率が最小となるようなカットオフ値を検討し、 設定する¹⁾。
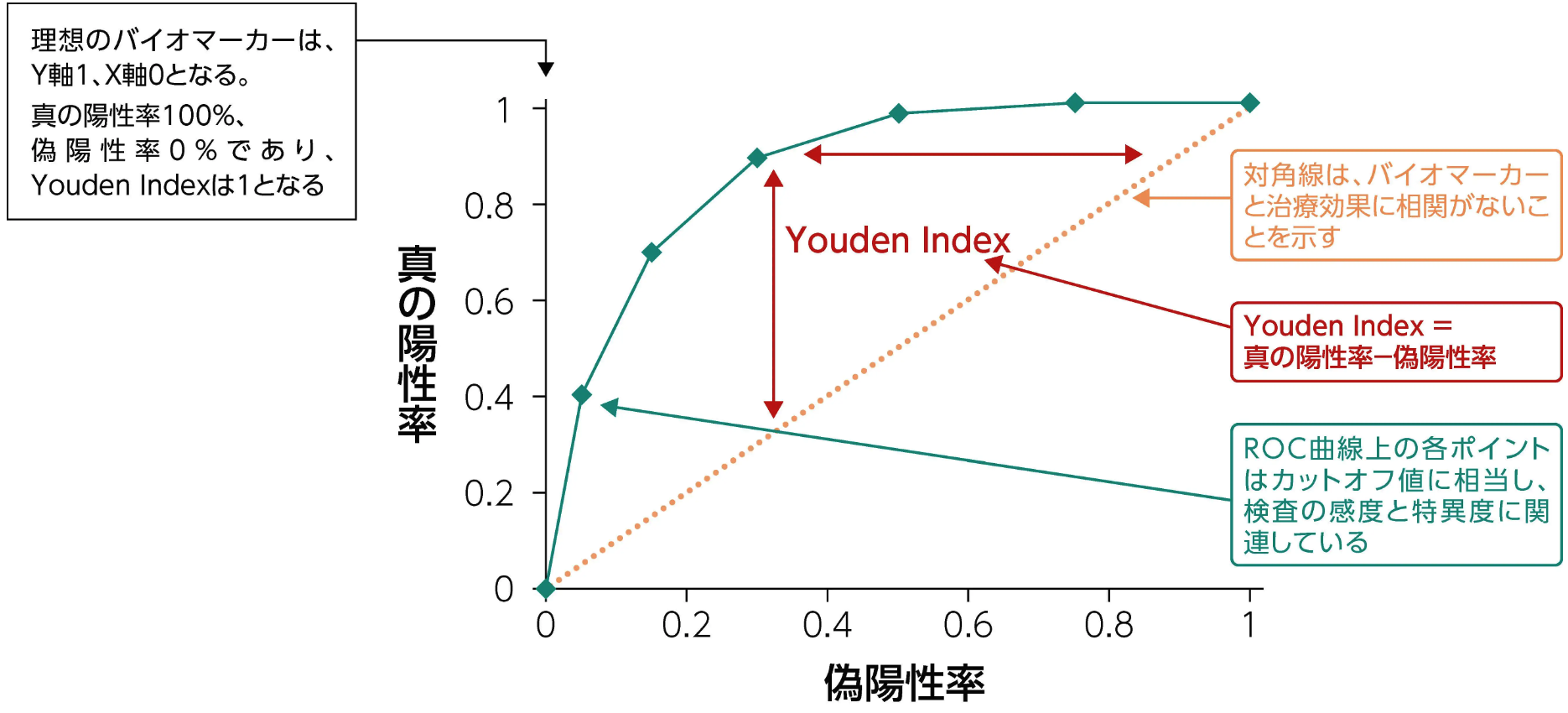
ROC曲線は、 連続する変数 (カットオフ値) から得られた真の陽性率 (Y軸)、 偽陽性率 (X軸) をプロットした曲線である¹⁾²⁾。 図の左上の頂点 (X軸0、 Y軸1) がプロットされるカットオフ値は 「真の陽性率100%、 偽陽性率0%」 となる理想のカットオフ値であり、 一方でいずれのカットオフ値を代入しても、 図の右上から左下への対角線上にプロットされてしまうバイオマーカーは、 いずれのカットオフ値でも 「真の陽性率=偽陽性率」 となることから、 有用性のないバイオマーカーと判断される¹⁾²⁾。 左上の頂点に最も近い点、 又は 「真の陽性率 (Y軸) -偽陽性率 (X軸) 」 が最大になる点 (Youden Index) がプロットされるカットオフ値が最適なカットオフ値となる²⁾。
ROC曲線を用いた非小細胞肺癌のPD-L1発現のカットオフ値の設定

KEYNOTE-001試験では、 Training Set 182例中146例*¹の奏効率*²と、 PD-L1の免疫組織染色の結果を基にROC曲線を解析し、 Youden Indexを用いてTPS (Tumor Proportion Score) 47.5%が最適なカットオフ値であることが示された (図) ³⁾。 また、 コンパニオン診断薬のスコアを簡素化してTPS≧50%をPD-L1高発現と定義し、 Validation Set 313例*³を対象にカットオフ値TPS≧50%の臨床的な妥当性が検討された³⁾*⁴。
*¹ ペムブロリズマブ投与を1回以上受け、 ベースライン時にirRC評価で測定可能病変を有し、 Clinical Trial Assayで測定可能な検体を有する患者
*² 19週以上の経過観察後、 irRCを用いた治験担当医師評価
*³ 既治療患者223例、 未治療患者90例
*⁴ 腫瘍細胞のうち、 PD-L1発現陽性細胞の割合が50%以上
図 Training Setにおける奏効率とPD-L1発現量の解析 (ROC解析)
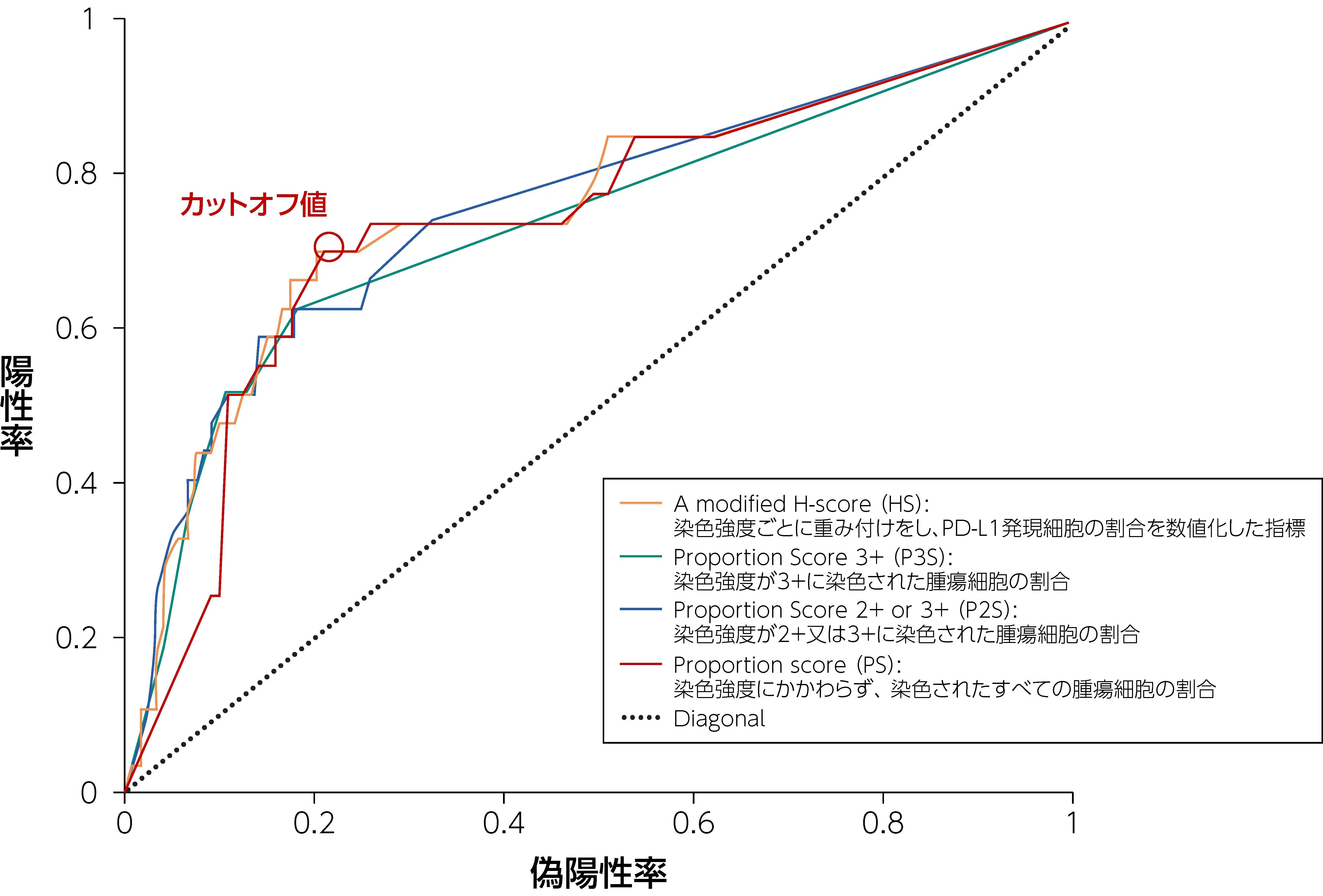
KEYNOTE-001試験では、 免疫組織染色の評価法として、 複数の手法が用いられたが、 いずれの評価法を用いても、 ROC曲線に大きな変化が見られなかったことから、 簡便な評価方法として、 染色強度に関わらず、 染色されたすべての腫瘍細胞を評価する手法であるTumor Proportion Score (TPS) が選択された。


引用文献
1) Dobin KK et al. J Immunother Cancer. 2016; 4: 77.
2) Habibzadeh F et al. Biochem Med (Zagreb). 2016; 26: 297-307.
3) 承認時評価資料 : 海外第Ⅰ相試験パートC、 F (KEYNOTE-001試験)
他のバイオマーカー検査コンテンツ




編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
PD-L1
記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。 また、 承認されたコンパニオン診断薬等の最新情報については、 こちらをご確認ください。

アドバイザー : 国立がん研究センター中央病院 病理診断科 科長 谷田部恭先生、 関西医科大学 病理学講座 教授 蔦幸治先生
PD-L1の概要
PD-L1とは
PD-L1は免疫応答に関与するT細胞、 B細胞、 NK細胞のほか、 樹状細胞や制御性T細胞、 骨髄由来抑制細胞などに発現する免疫チェックポイント分子である¹⁾²⁾。
PD-L1は、 活性化するT細胞上に発現するPD-1と結合することでT細胞の活性化を抑制し、 感染症における過剰な炎症反応や自己免疫に対する免疫寛容に関与する²⁾。
しかし、 腫瘍微小環境下で種々の細胞に発現するPD-L1は腫瘍細胞の免疫逃避に関わることから、 治療標的として注目されている。

PD-1/PD-L1経路を介した免疫逃避メカニズム
PD-1は、 腫瘍微小環境中に発現するPD-L1/2と結合することで、 T細胞の活性化や増殖、 サイトカイン産生などを抑制し、 腫瘍細胞の生存に関与する¹⁾²⁾。
PD-1/PD-L1経路は、 主としてT細胞による腫瘍細胞への攻撃の抑制において重要な役割を担っている。 また、 抗原提示によるT細胞活性化の阻害にも関与していると考えられている¹⁾³⁾。

引用文献
1) Sharpe AH et al. Nat Rev Immunol. 2017; 18: 153-167.
2) Pardoll DM Nat Rev Cancer. 2012; 12: 252-264.
3) Chen DS et al. Immunity. 2013; 39: 1-10.
効果予測バイオマーカーとしてのPD-L1
PD-L1のメカニズムに基づく効果予測
T細胞に発現するPD-1は、 腫瘍微小環境下の種々の細胞で発現するPD-L1と結合し、 T細胞の過剰な活性化を抑制して免疫寛容を成立させる。 したがってPD-L1は、 腫瘍細胞に限らず正常な免疫細胞、 樹状細胞などにも発現が認められる¹⁻³⁾。 PD-L1およびPD-L2の発現は炎症性サイトカインやインターフェロン (IFN) によって誘導され、 腫瘍微小環境では浸潤したT細胞が産生するIFNによって腫瘍、 マクロファージおよび免疫細胞上に発現が誘導される¹⁾。 そのため、 腫瘍組織におけるPD-L1の発現は、 腫瘍に浸潤したT細胞によって、 抗原特異的な免疫反応が起こっている事を示す指標になると考えられる⁴⁾。 一方、 腫瘍微小環境下で発現するPD-L1は、 T細胞上に発現するPD-1を介して腫瘍細胞特異的な免疫反応を抑制する。 したがって、 PD-L1の発現は、 PD-1/PD-L1経路を遮断してT細胞の腫瘍免疫を回復する免疫チェックポイント阻害剤の効果予測バイオマーカーとなることが報告されている⁵⁾。

引用文献
1) Sharpe AH et al. Nat Rev Immunol. 2017; 18: 153-167.
2) Pardoll DM Nat Rev Cancer. 2012; 12: 252-264.
3) Dolled-Filhart M et al. Arch Pathol Lab Med. 2016; 140: 1243-1249.
4) Yi M et al. Mol Cancer. 2018; 17: 129.
5) Sunshine J et al. Curr Opin Pharmacol. 2015; 23: 32-38.
日本で承認されているPD-L1検査の種類
国内で用いられるPD-L1検査の特徴
免疫組織化学染色 (IHC) によるPD-L1検査は、 抗体ごとに特性、 評価法、 および紐づく抗PD-1/L1抗体薬が異なる。 現在、 日本で承認されているPD-L1検査の種類を下表にまとめた (2025年7月時点)。

臓器別PD-L1検査の承認状況
がん種・診断薬別のPD-L1検査の位置づけ
抗PD-1/L1抗体薬におけるPD-L1検査の位置づけはがん種によって異なり、 コンパニオン診断 (投与前の必須の検査)、 またはコンプリメンタリー診断 (参考になるが必須の検査ではない) として用いられる。
また、 がん種によって評価方法 (TPS、 CPS、 TC、 IC)、 薬剤適応のカットオフ値も異なる。


22C3抗体による評価方法 : TPS、 CPS
本項から、 22C3抗体による検査方法について紹介する。
PD-L1検査の指標 (TPS/CPS)
PD-L1検査には、 腫瘍細胞のみに発現しているPD-L1のみを評価する指標であるTPS (Tumor Proportion Score) と、 腫瘍および免疫細胞に発現しているPD-L1を合わせて評価する指標であるCPS (Combined Positive Score) の2つが存在する。 PD-L1検査を、 免疫チェックポイント阻害剤の効果予測バイオマーカーとして使用する場合は、 がん種、 薬剤毎に、 臨床試験で有効性が検証された指標を使用しなければならない。
TPS (Tumor Proportion Score)
TPSは、 染色標本上の全腫瘍細胞に対し、 PD-L1陽性の腫瘍細胞が占める割合 (%) を示した指標である¹⁻³⁾。 ペムブロリズマブのコンパニオン診断としては、 切除不能な進行・再発の非小細胞肺癌のみに用いられる。


CPS (Combined Positive Score)
CPSは、 染色標本上の浸潤部位において、 PD-L1陽性の腫瘍細胞および免疫細胞 (リンパ球、 マクロファージ) を合わせて評価する指標である²⁾⁴⁻⁸⁾。 ペムブロリズマブのコンパニオン診断、 コンプリメンタリー診断のいずれにも用いられている (対象となるがん種は前述の「臓器別PD-L1検査の承認状況」 を参照)。


引用文献
1) PD-L1 IHC 22C3 pharmDx 「ダコ」 (Code No. GE006、 ダコ Omnis) 電子添文
2) PD-L1 IHC 22C3 pharmDx 「ダコ」 (Code No. SK006、 ダコ Autostainer Link 48) 電子添文
3) PD-L1 IHC 22C3 pharmDx 「ダコ」 非小細胞肺癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29403ja-d62944-02-pd-l1-ihc-22c3-as-omnis-nsclc-im-ja-jp.pdf (2025/7/10閲覧)
4) PD-L1 IHC 22C3 pharmDx 「ダコ」 頭頸部癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29339jajp_pd_l1_ihc_22c3_hnscc_interpretation_manual.pdf) (2025/7/10閲覧)
5) PD-L1 IHC 22C3 pharmDx 「ダコ」 食道扁平上皮癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29361ja_pd_l1_ihc_22c3_escc_interpretation_manual_kn181.pdf) (2025/7/10閲覧)
6) PD-L1 IHC 22C3 pharmDx 「ダコ」 トリプルネガティブ乳癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29425ja-d66489-pdl1-ihc-22C3-pharmdx-tnbc-interpretation-manual-japan.pdf) (2025/7/10閲覧)
7) PD-L1 IHC 22C3 pharmDx 「ダコ」 子宮頸癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29558ja-pd-l1-22c3-cervical-interpretation-manual-kn826.pdf) (2025/7/10閲覧)
8) PD-L1 IHC 22C3 pharmDx 「ダコ」 胃癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29621ja-pdl1-22c3-gastric-im-jp.pdf) (2025/7/10閲覧)
22C3抗体によるがん種別のPD-L1発現頻度
ペムブロリズマブの各国際共同試験におけるPD-L1の発現頻度
ペムブロリズマブの各国際共同試験におけるPD-L1発現頻度を下表にまとめた¹⁻¹²⁾。
また、 各臨床試験のPD-L1検査では、 22C3抗体が用いられた。


引用文献
1) Herbst RS et al. Lancet. 2016; 387: 1540-1550.
2) 承認時評価資料 : 国際共同第Ⅱ/Ⅲ相試験 (KEYNOTE-010試験)
3) Reck M et al. N Engl J Med. 2016; 375: 1823-1833.
4) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-024試験)
5) Mok TSK et al. Lancet. 2019; 393: 1819-1830.
6) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-042試験)
7) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-048試験)
8) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-181試験)
9) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-355試験)
10) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-826試験)
11) 承認時評価資料 : 国際共同第Ⅲ相試験 (KEYNOTE-859試験)
12) 電子添文改訂時評価資料 : 国際共同第III相試験 (KEYNOTE-811試験)
論文1,3,5)は、 MSD社の資金提供及び著者に同社の社員を含む。
PD-L1検査(22C3抗体)における検体の取り扱い
検査および検体の取り扱いにおける留意点¹⁻⁹⁾
適切なPD-L1検査を行うには、 技術的な差異が結果に影響するリスクをできる限り最小化し、 精度を高めることが重要になる。 治療薬に対応した特定の診断薬キットの使用方法を遵守し、 手技に習熟するなどの取り組みによって、 ばらつきを少なくすることが可能である。

各がん種における薄切後の切片の保管¹⁻⁸⁾
組織検体の抗原性低下によって偽陰性が生じる可能性があるため、 薄切した未染色組織検体は冷暗所 (2~8℃) での保管が推奨される。 また、 室温 (25℃まで) での保管も可能である。
各がん種毎に未染色組織検体の保管期間が検討されており、 冷暗所 (2~8度) で2~6ヵ月、 室温 (25℃) で1~4ヵ月との報告がある。 詳細については、 Dako社の判定マニュアルを参考にすること³⁻⁸⁾。
引用文献
1) PD-L1 IHC 22C3 pharmDx 「ダコ」 (Code No. GE006、 ダコ Omnis) 電子添文
2) PD-L1 IHC 22C3 pharmDx 「ダコ」 (Code No. SK006、 ダコ Autostainer Link 48) 電子添文
3) PD-L1 IHC 22C3 pharmDx 「ダコ」 非小細胞肺癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29403ja-d62944-02-pd-l1-ihc-22c3-as-omnis-nsclc-im-ja-jp.pdf) (2025/7/10閲覧)
4) PD-L1 IHC 22C3 pharmDx 「ダコ」 頭頸部癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29339jajp_pd_l1_ihc_22c3_hnscc_interpretation_manual.pdf) (2025/7/10閲覧)
5) PD-L1 IHC 22C3 pharmDx 「ダコ」 食道扁平上皮癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29361ja_pd_l1_ihc_22c3_escc_interpretation_manual_kn181.pdf) (2025/7/10閲覧)
6) PD-L1 IHC 22C3 pharmDx 「ダコ」 トリプルネガティブ乳癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29425ja-d66489-pdl1-ihc-22C3-pharmdx-tnbc-interpretation-manual-japan.pdf) (2025/7/10閲覧)
7) PD-L1 IHC 22C3 pharmDx 「ダコ」 子宮頸癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29558ja-pd-l1-22c3-cervical-interpretation-manual-kn826.pdf) (2025/7/10閲覧)
8) PD-L1 IHC 22C3 pharmDx 「ダコ」 胃癌染色結果判定マニュアル (https://www.agilent.com/cs/library/usermanuals/public/29621ja-pdl1-22c3-gastric-im-jp.pdf) (2025/7/10閲覧)
9) 日本肺癌学会バイオマーカー委員会 編 : 肺癌患者におけるバイオマーカー検査の手引きv2.1.1. 2025
国内におけるPD-L1検査の概要
PD-L1検査の診療報酬¹⁾²⁾
診療報酬点数表 : 第2章 特掲診療料―第13部 病理診断―第1節 病理標本作製料

引用文献
1) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部を改正する告示 (https://www.mhlw.go.jp/content/12404000/001251499.pdf) (2025/7/10閲覧)
2) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部改正に伴う実施上の留意事項について (https://www.mhlw.go.jp/content/12404000/001293312.pdf) (2025/7/10閲覧)
PD-L1発現陽性のカットオフ
ROC曲線を用いた感度分析
臨床において、 効果予測バイオマーカーを測定する目的の一つは、 特定の薬剤の治療効果が期待できる患者を予測、 同定することである。 検査にて測定した結果を正しく解釈する為に、 適切なカットオフ値を設定する必要がある。 カットオフ値の設定には、 臨床試験で得られた検査の真の陽性率 : 感度 (Sensitivity) と真の陰性率 : 特異度 (Specificity) を基に、 Receiver Operating Characteristic Curve (以下、 ROC曲線) を用い、 真の陽性率が最大に、 偽陽性率が最小となるようなカットオフ値を検討し、 設定する¹⁾。

ROC曲線は、 連続する変数 (カットオフ値) から得られた真の陽性率 (Y軸)、 偽陽性率 (X軸) をプロットした曲線である¹⁾²⁾。 図の左上の頂点 (X軸0、 Y軸1) がプロットされるカットオフ値は 「真の陽性率100%、 偽陽性率0%」 となる理想のカットオフ値であり、 一方でいずれのカットオフ値を代入しても、 図の右上から左下への対角線上にプロットされてしまうバイオマーカーは、 いずれのカットオフ値でも 「真の陽性率=偽陽性率」 となることから、 有用性のないバイオマーカーと判断される¹⁾²⁾。 左上の頂点に最も近い点、 又は 「真の陽性率 (Y軸) -偽陽性率 (X軸) 」 が最大になる点 (Youden Index) がプロットされるカットオフ値が最適なカットオフ値となる²⁾。

ROC曲線を用いた非小細胞肺癌のPD-L1発現のカットオフ値の設定

KEYNOTE-001試験では、 Training Set 182例中146例*¹の奏効率*²と、 PD-L1の免疫組織染色の結果を基にROC曲線を解析し、 Youden Indexを用いてTPS (Tumor Proportion Score) 47.5%が最適なカットオフ値であることが示された (図) ³⁾。 また、 コンパニオン診断薬のスコアを簡素化してTPS≧50%をPD-L1高発現と定義し、 Validation Set 313例*³を対象にカットオフ値TPS≧50%の臨床的な妥当性が検討された³⁾*⁴。
*¹ ペムブロリズマブ投与を1回以上受け、 ベースライン時にirRC評価で測定可能病変を有し、 Clinical Trial Assayで測定可能な検体を有する患者
*² 19週以上の経過観察後、 irRCを用いた治験担当医師評価
*³ 既治療患者223例、 未治療患者90例
*⁴ 腫瘍細胞のうち、 PD-L1発現陽性細胞の割合が50%以上
図 Training Setにおける奏効率とPD-L1発現量の解析 (ROC解析)

KEYNOTE-001試験では、 免疫組織染色の評価法として、 複数の手法が用いられたが、 いずれの評価法を用いても、 ROC曲線に大きな変化が見られなかったことから、 簡便な評価方法として、 染色強度に関わらず、 染色されたすべての腫瘍細胞を評価する手法であるTumor Proportion Score (TPS) が選択された。


引用文献
1) Dobin KK et al. J Immunother Cancer. 2016; 4: 77.
2) Habibzadeh F et al. Biochem Med (Zagreb). 2016; 26: 297-307.
3) 承認時評価資料 : 海外第Ⅰ相試験パートC、 F (KEYNOTE-001試験)
他のバイオマーカー検査コンテンツ




編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




