TMB
提供:MSD株式会社
記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。 また、 承認されたコンパニオン診断薬等の最新情報については、 こちらをご確認ください。

アドバイザー : 国立がん研究センター中央病院 病理診断科 科長 谷田部 恭 先生、 国立研究開発法人国立がん研究センター 先端医療開発センタートランスレーショナルインフォマティクス分野 分野長 土原 一哉 先生
腫瘍遺伝子変異量 (TMB) の概要
がんと遺伝子変異
腫瘍性の形質転換 (neoplastic transformation) は、 遺伝子変異の蓄積によって生じる¹⁾。 遺伝子変異の種類や発現頻度は、 個々の腫瘍によって、 また腫瘍のタイプによってばらつきがある。
がんに関連する遺伝子変異は、 体細胞変異 (somatic mutation) と生殖細胞系列変異 (germline mutation) に大別される。

ゲノムの塩基配列のバリアント
ゲノム上に存在する塩基配列の違いは、 バリアントと呼ばれ、 変異及び多型 (先天的に存在するバリアントのなかで、 病的でないもの) を含む³⁾。 主なバリアントの種類を、 下表に示す³⁾。
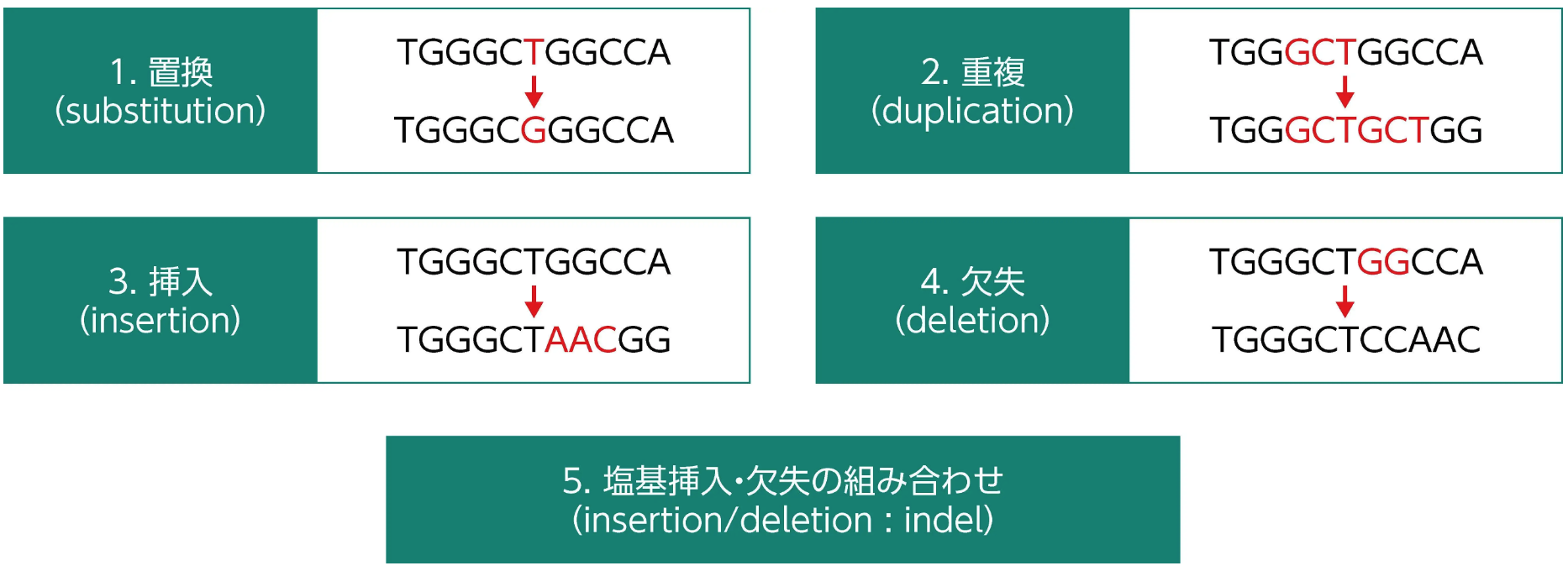
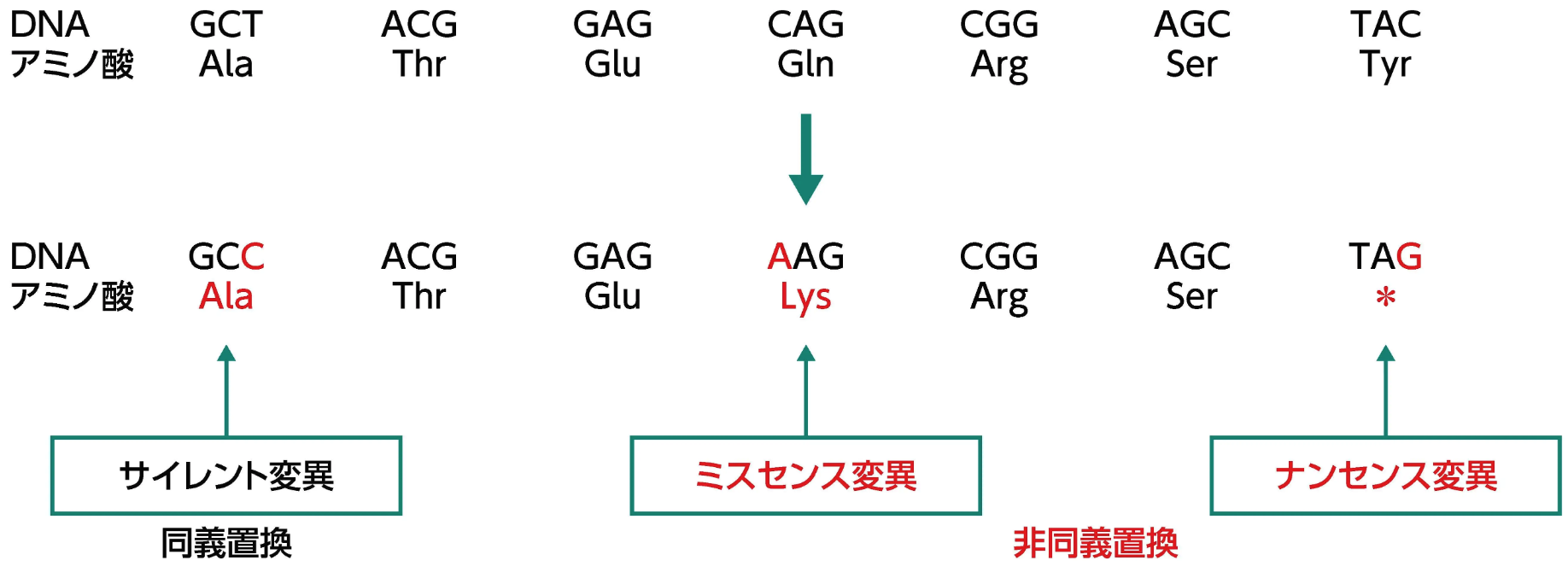
遺伝子の翻訳領域内に生じた塩基配列の置換には、 同義置換と非同義置換がある。 同義置換は、 アミノ酸のコーディングに変化を与えない変異 (サイレント変異) ¹⁾で、 通常、 変異を生じた遺伝子の機能に影響を与えないと考えられている³⁾。 非同義置換は、 アミノ酸が変化する変異 (ミスセンス変異、 ナンセンス変異) ¹⁾で、 変異を生じた遺伝子の機能に影響することが知られている³⁾ 。
TMBとは
腫瘍遺伝子変異量 (tumor mutation burden : TMB) とは、 腫瘍のゲノムのタンパク質コード部分における体細胞変異の総数である¹⁾⁴⁾。

引用文献
1) Chan TA et al. Ann Oncol. 2019; 30(1): 44-56 本論文の著者にMSD社から講演料、 研究助成金、 コンサルタント料などを受領したものが含まれる。
2) Griffiths AJF et al. An Introduction to Genetic Analysis. 7th edition. New York: W. H. Freeman; 2000. Somatic versus germinal mutation.
3) 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, pp54-66, 2020
4) Champiat S et al. Oncoimmunology. 2014; 3(1): e27817 本論文の著者にMSD社からコンサルタント料などを受領したものが含まれる。
5) Galuppini F et al. Cancer Cell Int. 2019; 19: 209
TMBの増加に関連するがん遺伝子変異
がん遺伝子変異とTMBの関連性 (海外データ) ¹⁾
TMBの増加に関連する遺伝子異常として、 ミスマッチ修復 (MMR) 関連遺伝子 (MSH2、 MSH6、 MLH1、 PMS2) やDNAポリメラーゼ (POL) 遺伝子 (POLE、 POLD1) が知られている。 DNA POLは、 DNA複製時のエラー修復機能 (校正機能) やMMR過程の一部を担う。 POLE、 POLD1は、 それぞれのエラー修復機構に関与している。
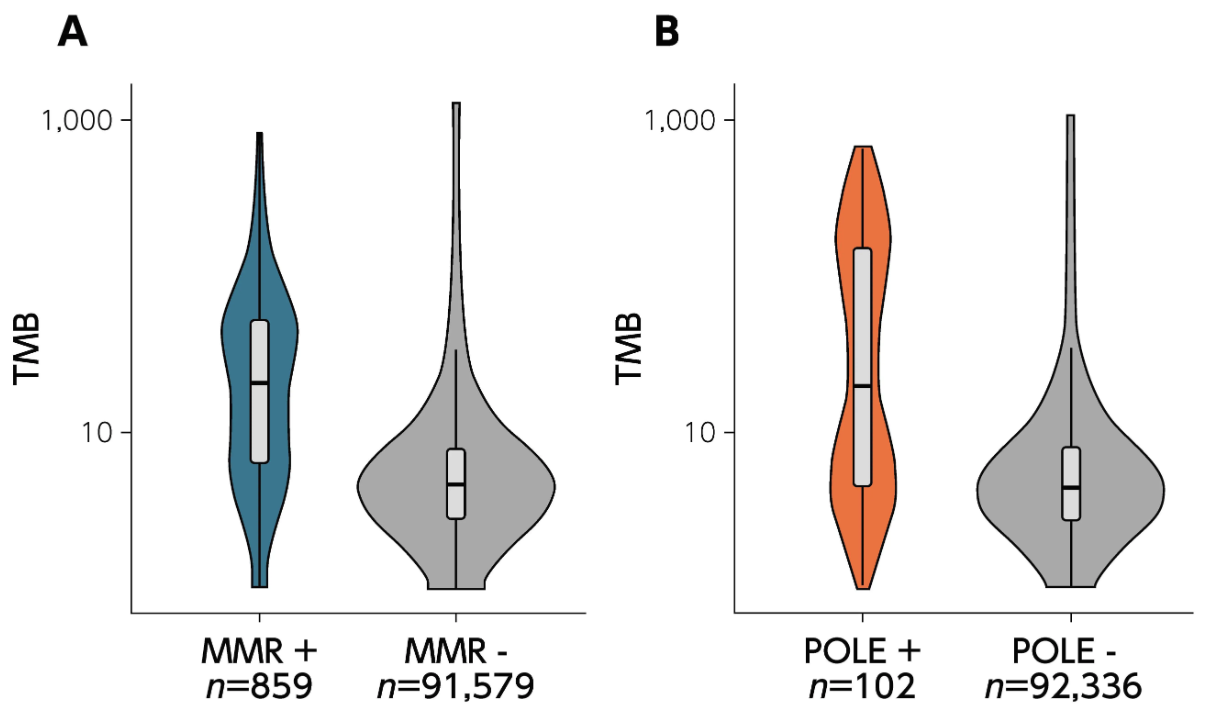

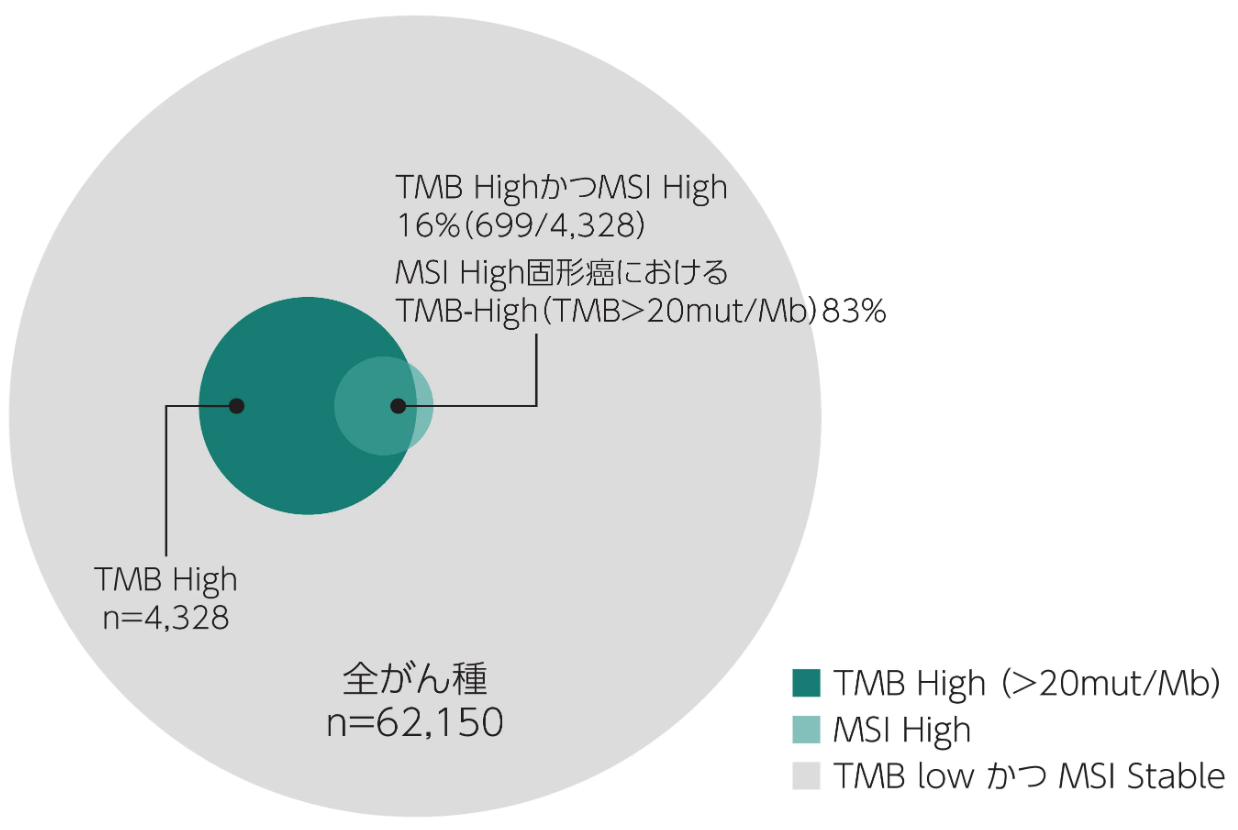
TMB-HighとMSI-Highの関連性 (海外データ) ¹⁾
MSI-Highとは、 ミスマッチ修復 (mismatch repair : MMR) 機能不全により、 後天的にマイクロサテライトの反復回数の変化が高頻度に認められる状態を示す。 MSI-High固形癌ではTMB-Highになることが多いが、 TMB-High固形癌のすべてがMSI-Highとは限らない。

引用文献
1) Chalmers ZR et al. Genome Med. 2017; 9(1): 34
効果予測バイオマーカーとしてのTMB
腫瘍細胞の遺伝子変異由来のネオアンチゲンと免疫応答¹⁻³⁾
ネオアンチゲンは、 アミノ酸が変化する変異由来またはウイルスに関連した抗原であり、 免疫系によって 「異物」 または 「非自己」 として認識される。 ネオアンチゲンは、 腫瘍・免疫細胞表面に発現し、 T細胞に認識され、 T細胞の活性化につながることから、 がん免疫療法の効果予測において重要と考えられている。
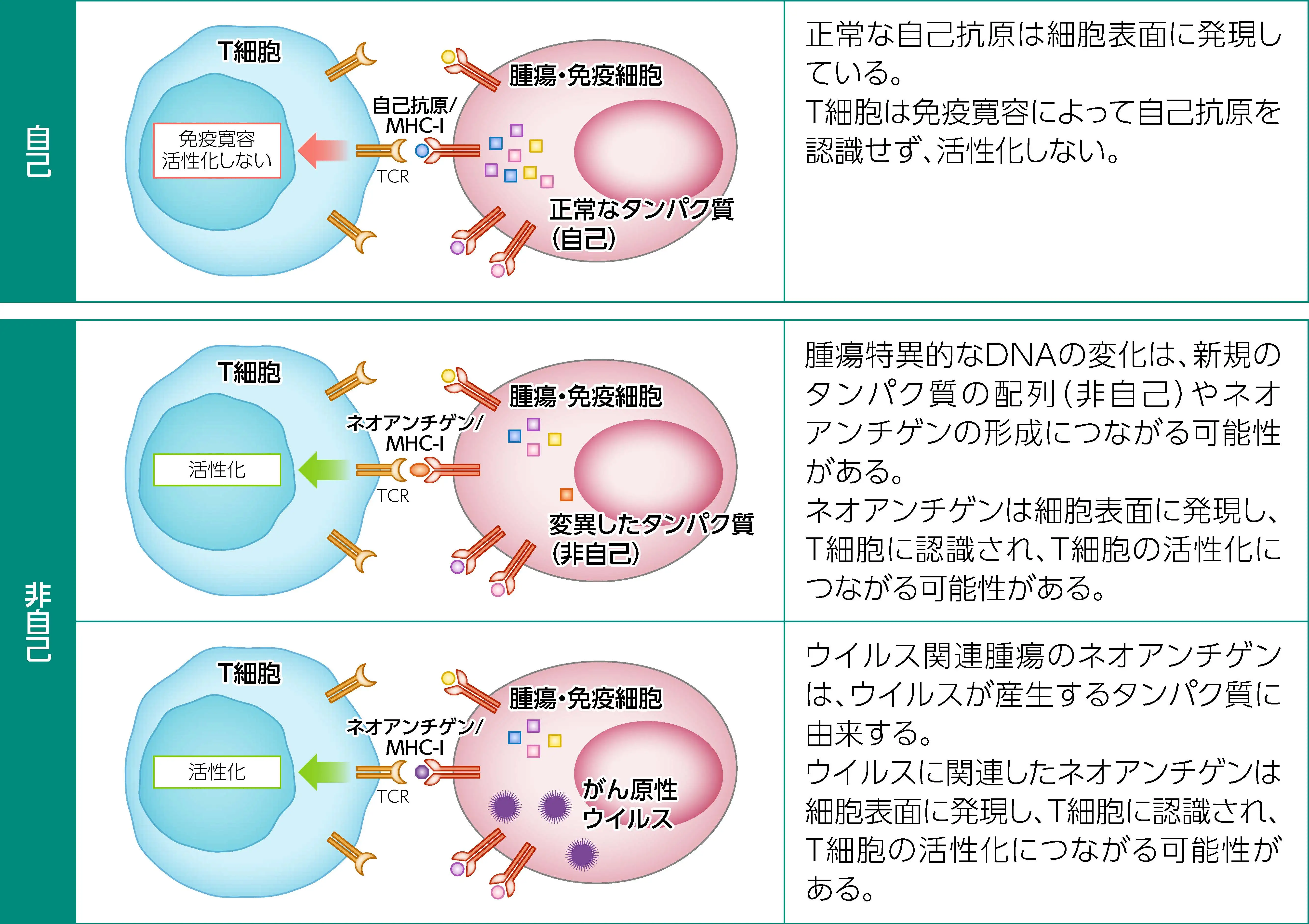
効果予測バイオマーカーとしてのTMB⁴⁾
腫瘍の体細胞変異が多いほど、 ネオアンチゲンも多く形成されることから、 TMBは腫瘍によるネオアンチゲン量の推定に役立つと考えられる。 腫瘍・免疫細胞の表面に提示されるネオアンチゲンがすべて免疫原性を示すわけではないが、 TMBが高いほど、 腫瘍・免疫細胞上に免疫原性のネオアンチゲンが提示される可能性が高いことが知られている。 TMB-High腫瘍では遺伝子変異量が増加することでネオアンチゲン反応性T細胞による認識が高まる可能性があるため、 免疫チェックポイント阻害剤が反応しやすいと考えられている。
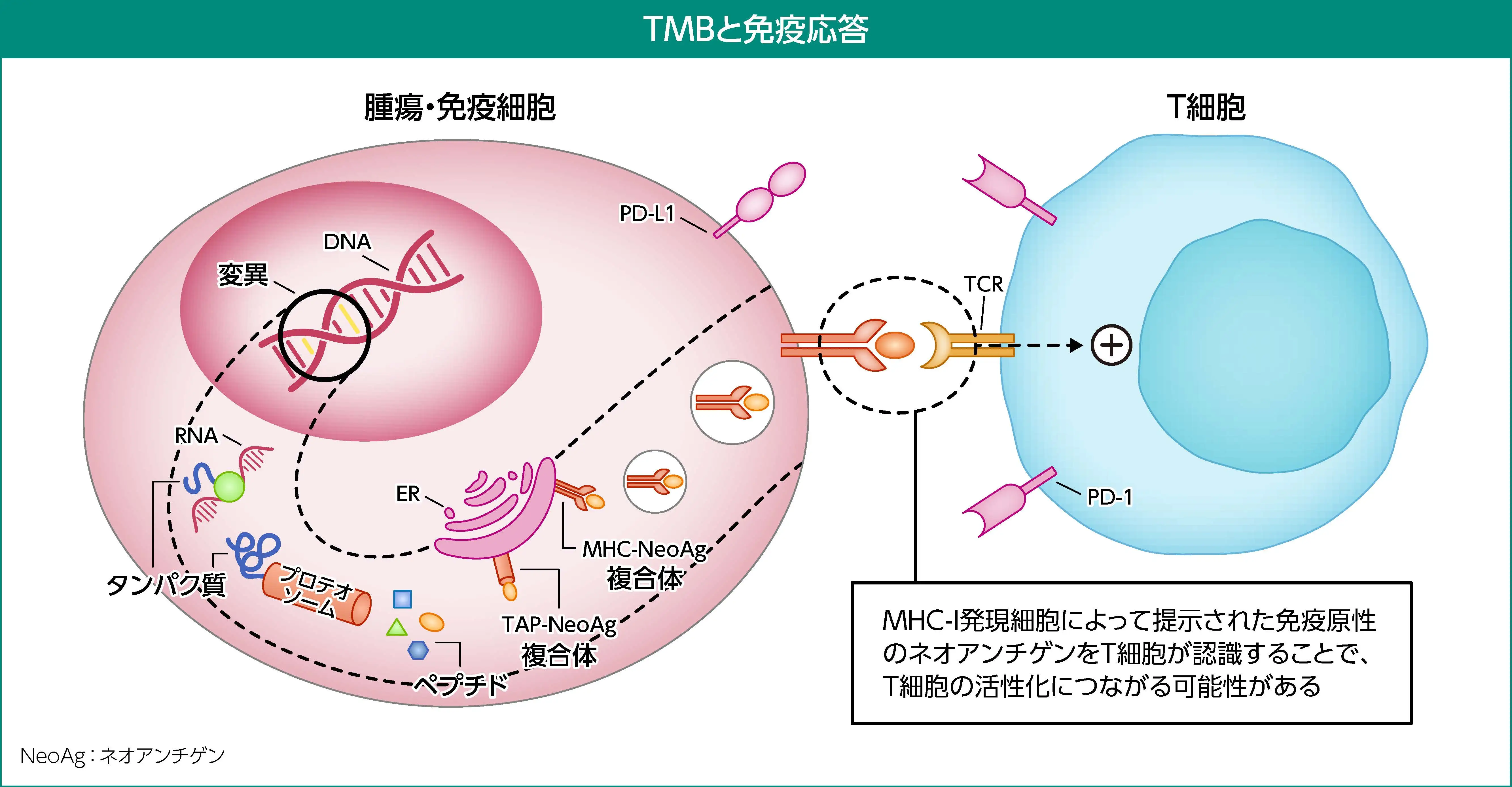
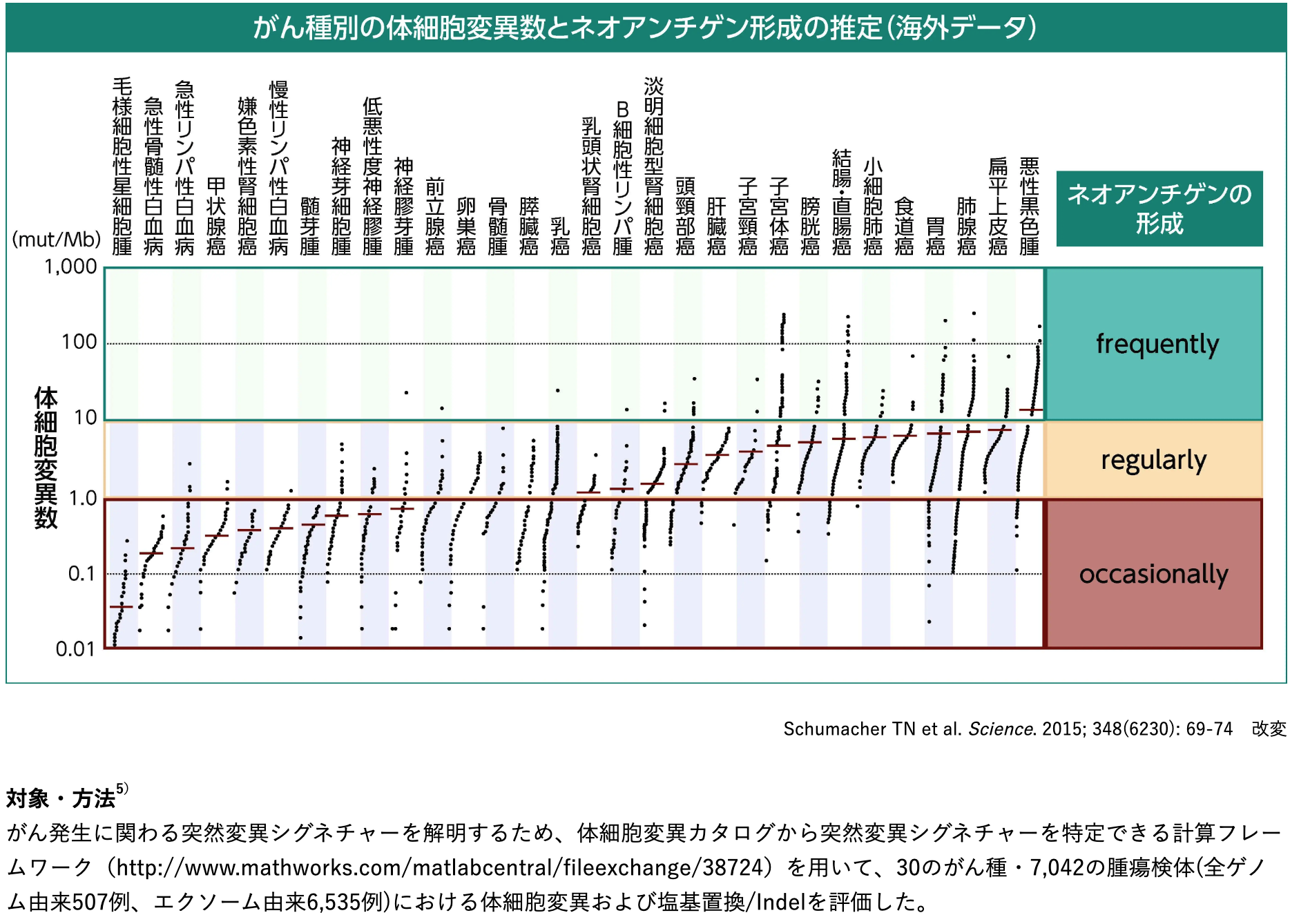
体細胞変異とネオアンチゲン²⁾⁵⁾
肺癌 (タバコ) や悪性黒色腫 (紫外線) など慢性的な変異原への曝露に関連するがんでは、 体細胞変異数が多く、 ネオアンチゲンが形成される可能性も高い。
30のがん種・7,042の腫瘍検体における4,938,362の塩基置換/Indelについて評価した結果、 体細胞変異数はがん種によって異なり、 同じがん種でも個体差が大きいことが示された (範囲 : 0.01 mut/Mb未満~400 mut/Mb超)。
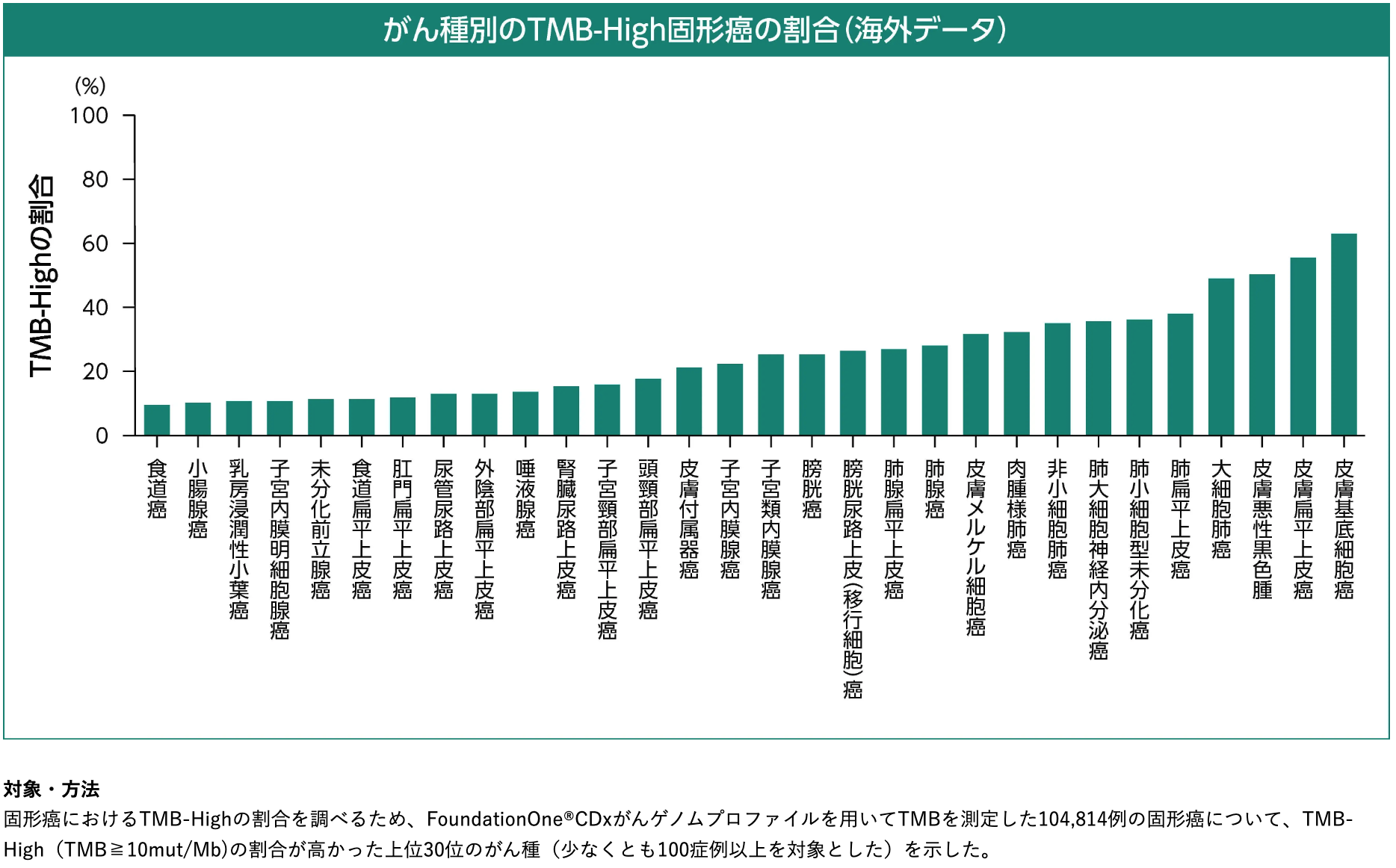
がん種別のTMB-Highの割合⁴⁾⁶⁾
引用文献
1) Newkirk, K et al. Pathologic Basis of Veterinary Disease (Sixth Edition), 2017, Pages 286-321.e1
2) Schumacher TN et al. Science. 2015; 348(6230): 69-74
3) Bluestone JA Immunol Rev. 2011; 241(1): 5-19
4) Chan TA et al. Ann Oncol. 2019; 30(1): 44-56 本論文の著者にMSD社から講演料、 研究助成金、 コンサルタント料などを受領したものが含まれる。
5) Alexandrov LB et al. Nature. 2013; 500(7463): 415-421
6) 承認時評価資料 : 国際共同第Ⅱ相試験 (KEYNOTE-158試験)
TMBの測定検査
検査の概要
現在、 TMB-Highを有する固形癌に対してペムブロリズマブが承認されている*。 ペムブロリズマブの適応を判定するためのコンパニオン診断には、 TMB測定検査としてFoundationOne®CDxがんゲノムプロファイル (F1CDx) のみが承認されている¹⁾。 コンパニオン診断としてF1CDxを用いる場合は、 結果の特別な解釈は必要なく、 専門家による会議体であるエキスパートパネルでの検討は不要である²⁾。
一方、 下表のがん遺伝子パネル検査は、 TMBスコアを算出可能な包括的がんゲノムプロファイリング検査 (CGP) としても使用される。 なお、 OncoGuideᵀᴹ NCCオンコパネルシステムおよびGenMineTOP®がんゲノムプロファイリングシステムによるTMBスコア算出の手法は臨床的に確立されていないが³⁾⁴⁾、 いずれのCGPもTMBスコアはレポートに記載される。 CGPは、 得られた遺伝子異常の病的意義や対応する候補薬剤の有無などに関して、 エキスパートパネルでの検討が必要となる。
*効能又は効果 (抜粋) : がん化学療法後に増悪した高い腫瘍遺伝子変異量 (TMB-High) を有する進行・再発の固形癌 (標準的な治療が困難な場合に限る)
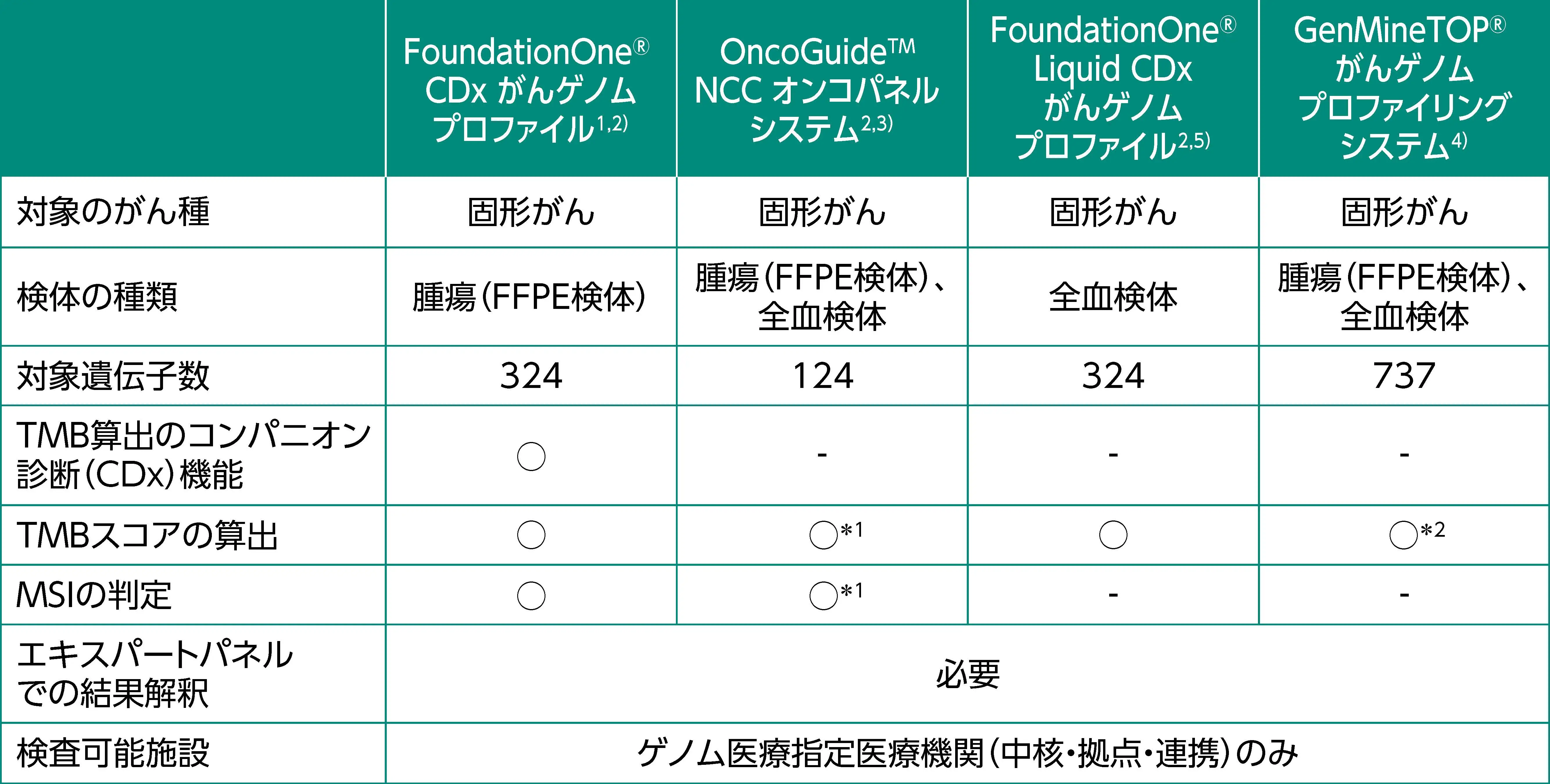


がん遺伝子パネル検査の詳細は、 がん遺伝子パネル検査を参照ください。
保険点数
腫瘍遺伝子変異量検査⁷⁾

がんゲノムプロファイリング検査等⁷⁾

国内ガイドラインでの記載
日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会編の 「成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン 第3版⁸⁾」 において、 TMB-Highの項目が新設され、 TMB測定の検査対象・方法・治療が詳細に解説されている。 また、 Clinical question (CQ) では、 TMB検査の対象 (CQ6)、 TMB検査法 (CQ7)、 TMB-Highに対する治療 (CQ8) について推奨度が示されている。
引用文献
1) FoundationOne® CDx がんゲノムプロファイル電子添文 (第23版)
2) 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, pp32-34, 2020
3) OncoGuideᵀᴹ NCCオンコパネル システム電子添文 (第5版)
4) GenMineTOP®がんゲノムプロファイリングシステム電子添文 (第3版)
5) FoundationOne® Liquid CDx がんゲノムプロファイル電子添文 (第6版)
6) 厚生労働省 令和元年5月31日事務連絡 遺伝子パネル検査の保険適用に係る留意点についてhttps://ajhc.or.jp/siryo/20190531-2.pdf (2025/7/15閲覧)
7) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部を改正する告示 (https://www.mhlw.go.jp/content/12404000/001251499.pdf) (2025/7/15閲覧)
8) 日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会 編, 成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン 第3版, 金原出版, pp61-77, 2022
TMBのカットオフ値
KEYNOTE-158試験におけるTMB-Highの定義
現在、 化学療法歴のある進行・再発の固形癌に対するペムブロリズマブの有効性および安全性を検討するKEYNOTE-158試験のデータ¹⁾に基づき、 「がん化学療法後に増悪した高い腫瘍遺伝子変異量 (TMB-High) を有する進行・再発の固形癌 (標準的な治療が困難な場合に限る) 」 に対する適応が承認されている。
なお、 本試験では、 FoundationOne® CDxで解析されたTMBが10mut/Mb以上の症例をTMB-Highとして定義された。
臨床試験の主要文献につきましては、 下記をご参照ください。 KEYNOTE-158試験 (TMB-H) (PMID 32919526 : Marabelle A et al. Lancet Oncol. 2020;21 : 1353-1365.)
本試験の論文はMSD社の資金提供及び著者に同社の社員、 及び著者に同社より謝礼、 講演料、 顧問料、 旅費などを受領している者を含む。
組織検体を用いた包括的ゲノムプロファイリング検査 : TMB-H
大腸がん診療における遺伝子関連検査等のガイダンス改訂第5版²⁾
- KEYNOTE-158試験ではFoundationOne® CDxで解析されたTMBが10mut/Mb以上の症例がTMB-Hとして定義され、 わが国でもコンパニオン診断となっている。
- TMBのカットオフ値である10mut/Mbは、 がん種横断的なカットオフ値の適用に向けた産官学によるコンソーシアムにて、 コンセンサスが得られた値である³⁾⁴⁾。
- 一方で、 TMBについては、 がん種ごとにICIの有効性に係わるカットオフ値が異なる可能性が示唆されている⁵⁾⁶⁾。
引用文献
1) Marabelle A et al. Lancet Oncol. 2020; 21(10): 1353-1365
2)日本臨床腫瘍学会 編,大腸がん診療における遺伝子関連検査等のガイダンス改訂第5版, 金原出版 pp53-60, 2023
3)日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会 編, 成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン 第3版, 金原出版, pp61-77, 2022
4) Merino DM et al. J Immunother Cancer 8(1): e000147, 2020
5) Valero C et al. JAMA Oncol. 2021; 7(5): 739-743
6) Rousseau B et al. N Engl J Med. 2021; 384(12): 1168-1170
論文1) は、 MSD社の資金提供及び著者に同社の社員、 及び著者に同社より謝礼、 講演料、 顧問料、 旅費などを受領している者を含む。
論文4) は、 著者にMSD社から研究助成金、 コンサルタント料などを受領したものが含まれる。
がんゲノム検査とTMB測定
がんゲノム検査とTMB¹⁾
がんゲノム検査は、 対象となる遺伝子の範囲によって、 下記の4つに大きく分けられる。
TMBは、 研究のみで実施されている全ゲノム検査 (WGS) や全エクソン検査 (WES) で従来評価されていた。 近年、 がん遺伝子パネル検査でも高感度にTMBを算出できることが報告され、 WES TMBと相関することから、 臨床で使用されている²⁾。
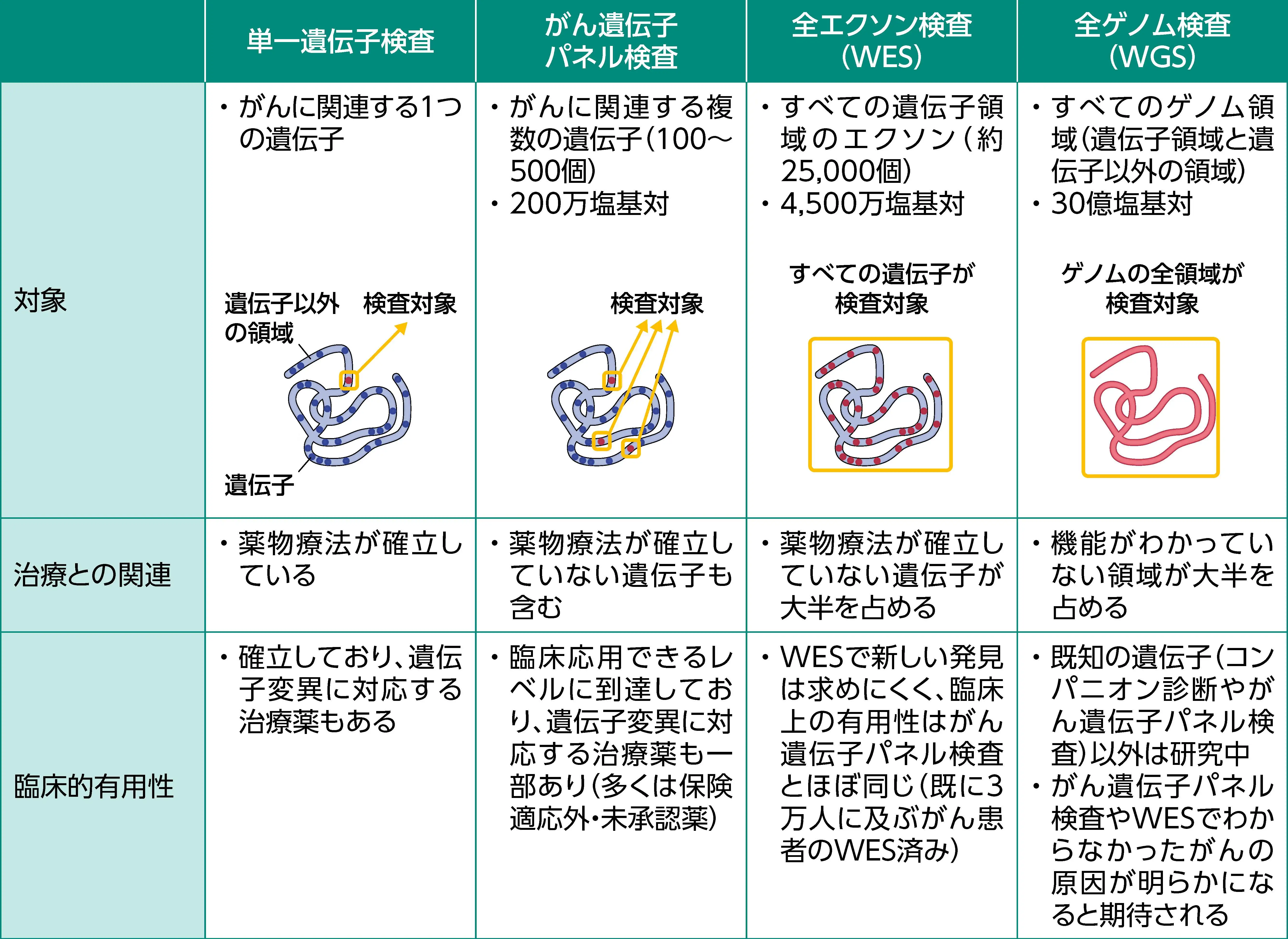
WESと主ながん遺伝子パネル検査³⁻⁶⁾

がん遺伝子パネル検査の開発と課題⁷⁾
高コストのWESに替わり、 臨床使用が容易ながん遺伝子パネル検査が複数開発されている。 一方、 WESによるTMBスコアが既知の臨床検体を用いて、 複数のがん遺伝子パネル検査間のTMBスコアのばらつきを検討したところ、 特にTMBスコアの増加に伴い、 ばらつきが大きくなる傾向があることが報告されている⁸⁾。 TMB評価の一貫性を図るため、 現在、 TMBの標準化に向けたプロジェクトが進行中である。
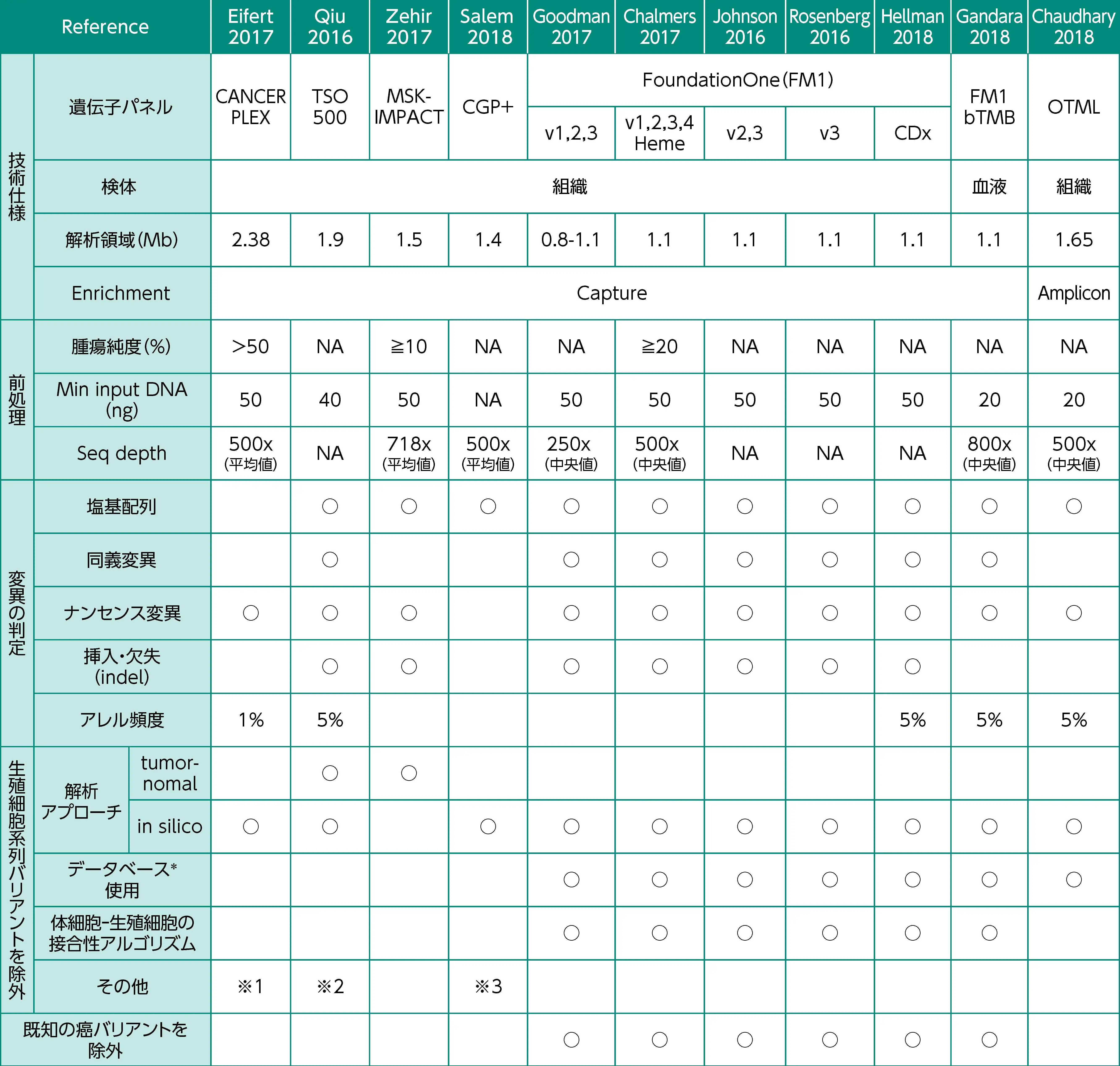
*データベースはdbSNP、 ExAC、 1000G、 NHLBI-ESP、 private dbを使用
※1 : 対立遺伝子頻度 (VAF) を基に手作業で評価
※2 : VAFを基にデータベース (詳細不明) で評価
※3 : 不明
Eifert C et al. Per Med. 2017; 14(4), 309-325
Qiu P et al. Int J Mol Sci. 2016; 17(5), 651
Zehir A et al. Nat Med. 2017; 23, 703-713
Salem ME et al. Mol Cancer Res. 2018; 16(5), 805–812
Goodman AM et al. Mol Cancer Ther. 2017; 16(11), 2598-2608
Chalmers ZR et al. Genome Med. 2017; 9(1): 34
Johnson DB et al. Cancer Immunol Res. 2016; 4(11): 959–967
Rosenberg JE et al. Lancet. 2016; 387(10031): 1909-1920
Hellmann MD et al. N Engl J Med. 2018; 378(22): 2093-2104
Gandara DR et al. Nat Med. 2018; 24(9): 1441-1448
Chaudhary R et al. Transl Lung Cancer Res. 2018; 7(6): 616–630
引用文献
1) 国立がん研究センター 中央病院, がんゲノム医療とは : https://www.ncc.go.jp/jp/ncch/genome/080/index.html (2025/7/15閲覧)
2) 日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会 編, 成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン 第3版, 金原出版, pp61-77, 2022
3) Chan TA et al. Ann Oncol. 2019; 30(1): 44-56 本論文の著者にMSD社から講演料、 研究助成金、 コンサルタント料などを受領したものが含まれる。
4) FoundationOne® CDx がんゲノムプロファイル 電子添文 (第23版)
5) OncoGuideᵀᴹ NCCオンコパネル システム 電子添文 (第5版)
6) Merino DM et al. J Immunother Cancer. 2020; 8(1): e000147
7) Fancello L et al. J Immunother Cancer. 2019; 7(1): 183 本試験はMSD社を含む複数社の資金提供により行われた。 本論文の著者にMSD社から講演料を受領したものが含まれる。
8) Vega DM et al. Ann Oncol. 2023; 32(12): 1626-1636 本論文の著者にMSD社から講演料、 コンサルタント料などを受領したものが含まれる。
TMB標準化プロジェクト
産官学コンソーシアム : Friends & QuIP イニシアティブ¹⁾
TMBの測定方法や、 臨床的有用性の検討方法の標準化を目的として、 米Friends of Cancer Research (Friends) と、 独Quality Assurance Initiative Pathology (QuIP) を中心とする産官学コンソーシアムが設立された。
TMB標準化・ハーモナイゼーションイニシアティブの目的
- TMBの測定方法による差異 (WESとがん遺伝子パネル検査の違い) の特定
- 各がん遺伝子パネル検査の標準化を目指し、 WESを用いたTMBの参照基準の作成
- アッセイ間・ラボ間のばらつきの評価、 その要因の特定
- TMBの評価、 レポート方法、 カットオフ値のばらつきを最小化・補正するための推奨事項の策定、 前向き臨床研究を実施するにあたってのベストプラクティスの普及
Friends & QuIPイニシアティブからの提言 : TMB測定の一貫性向上を目指して¹⁾

引用文献
1) Stenzinger A et al. Genes Chromosomes Cancer 2019; 58(8): 578-588
がん遺伝子パネル検査によるTMB測定の精度
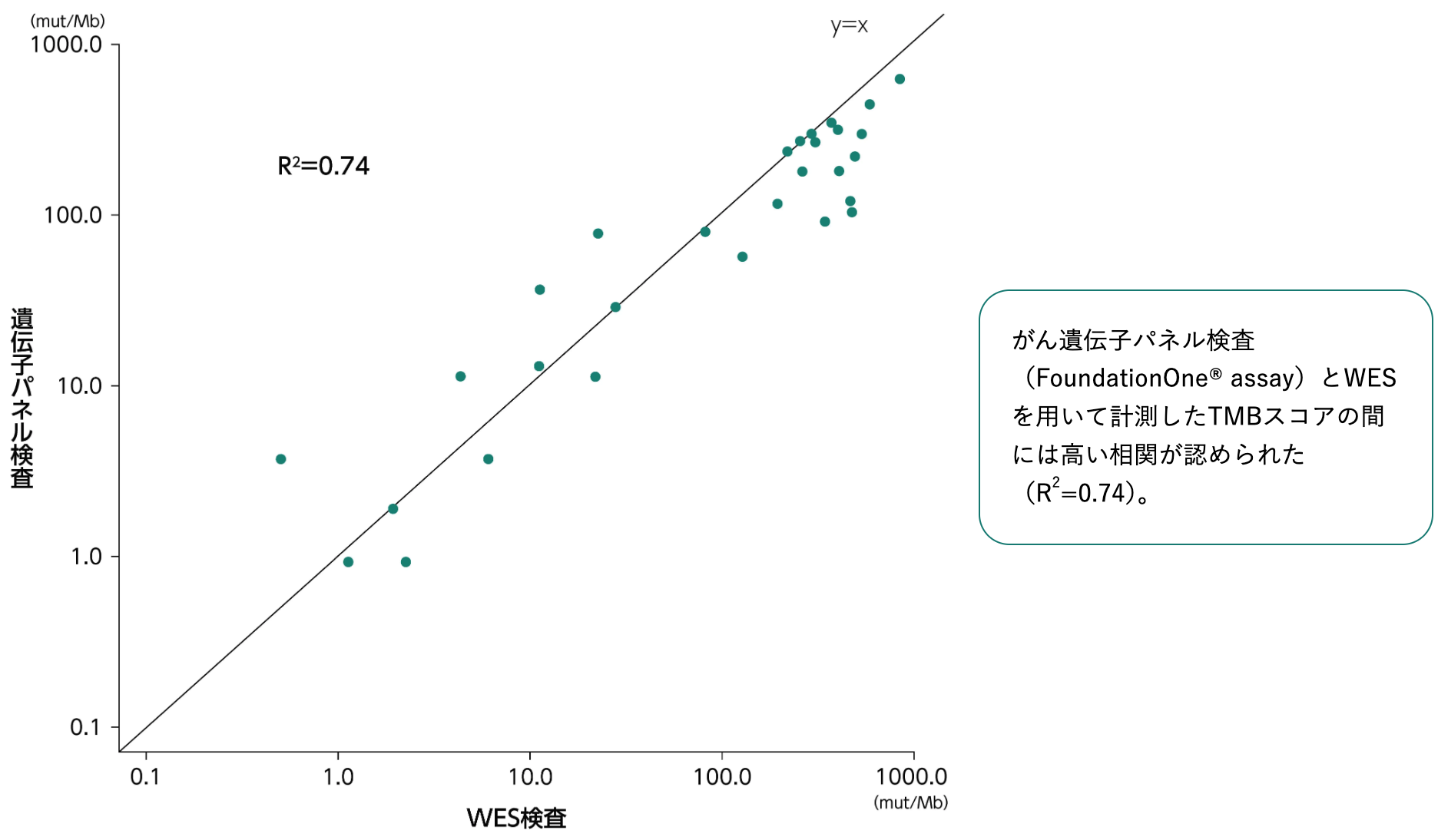
がん遺伝子パネル検査とWESとの相関¹⁾
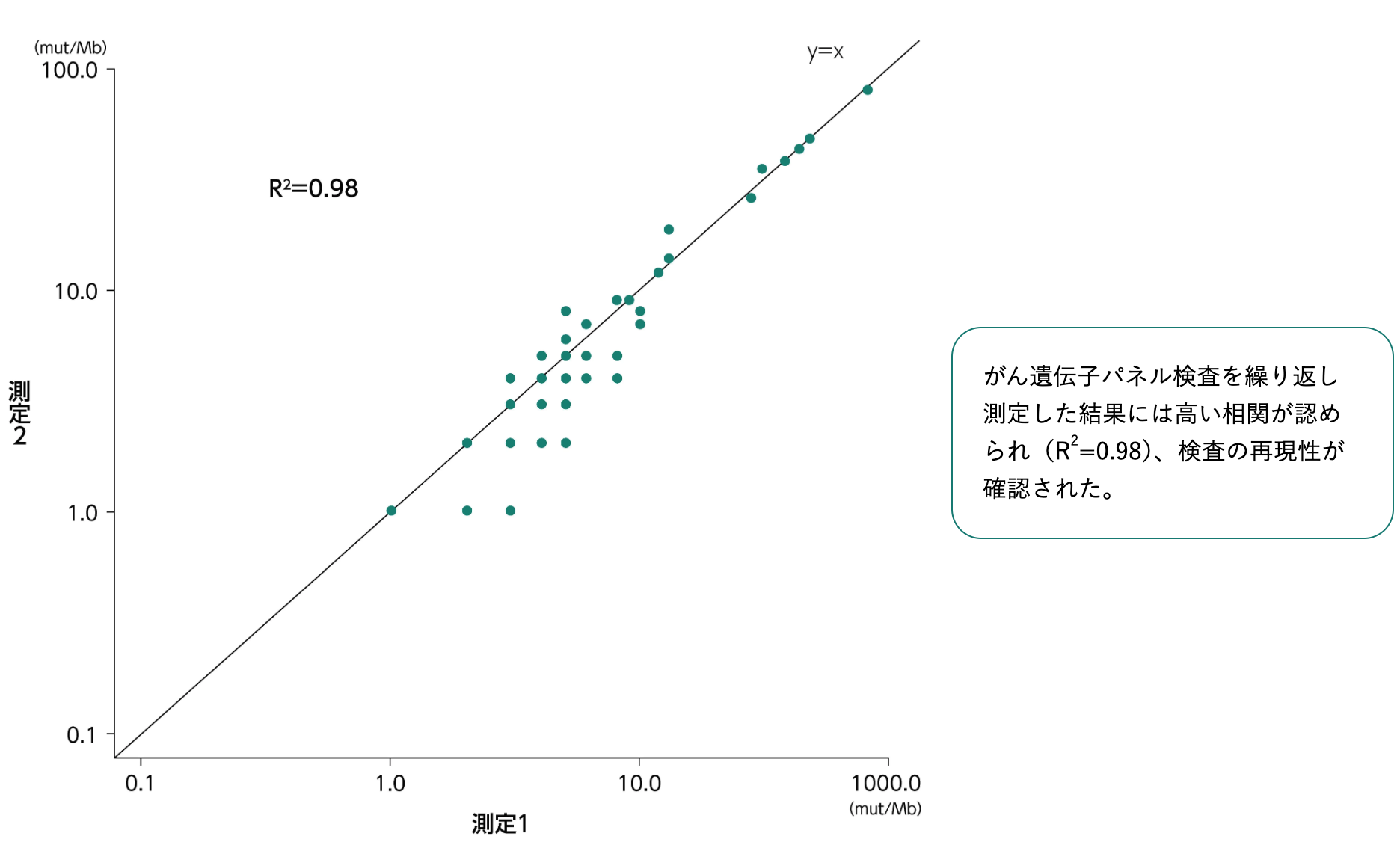
がん遺伝子パネル検査の再現性¹⁾
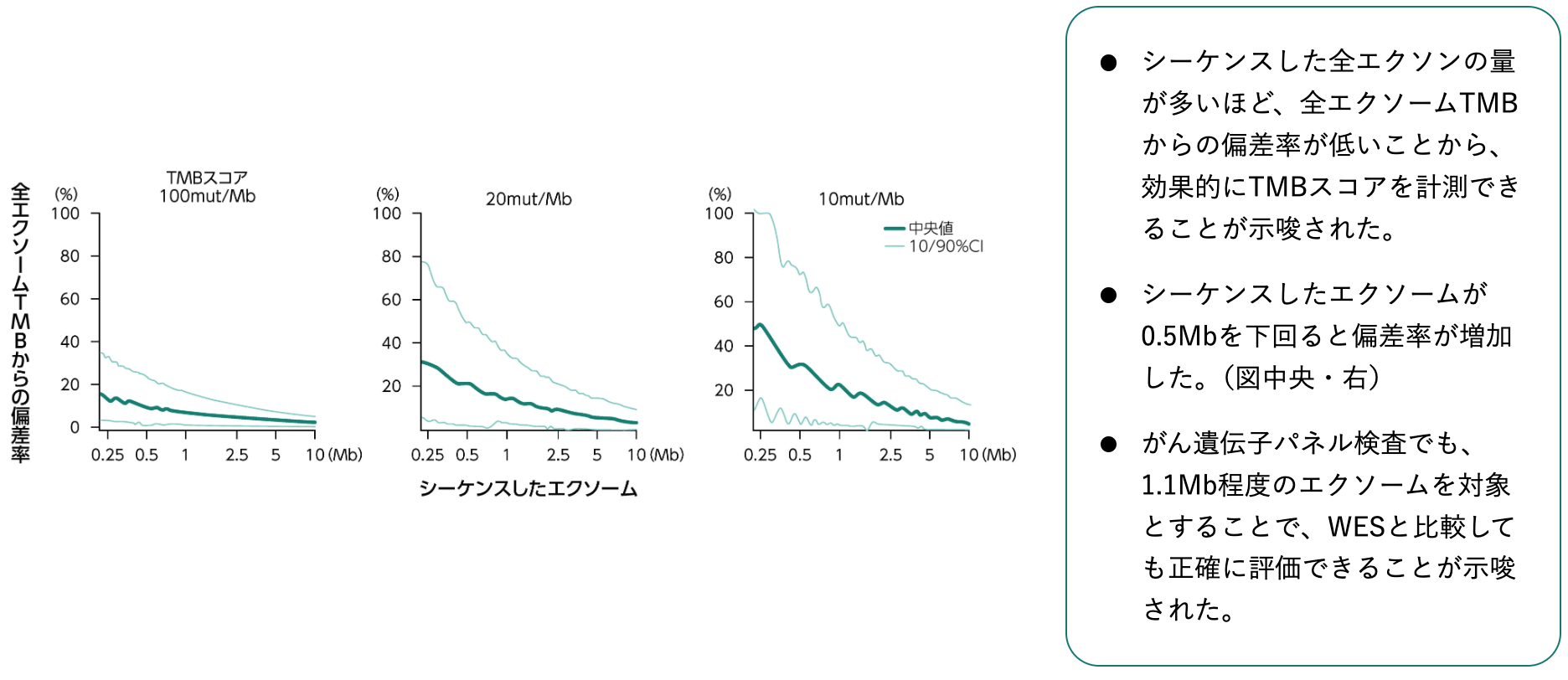
シーケンシングゲノム量の影響¹⁾

引用文献
1) Chalmers ZR et al. Genome Med. 2017; 9(1): 34
TMB標準化プロジェクトによるTMBカットオフ値
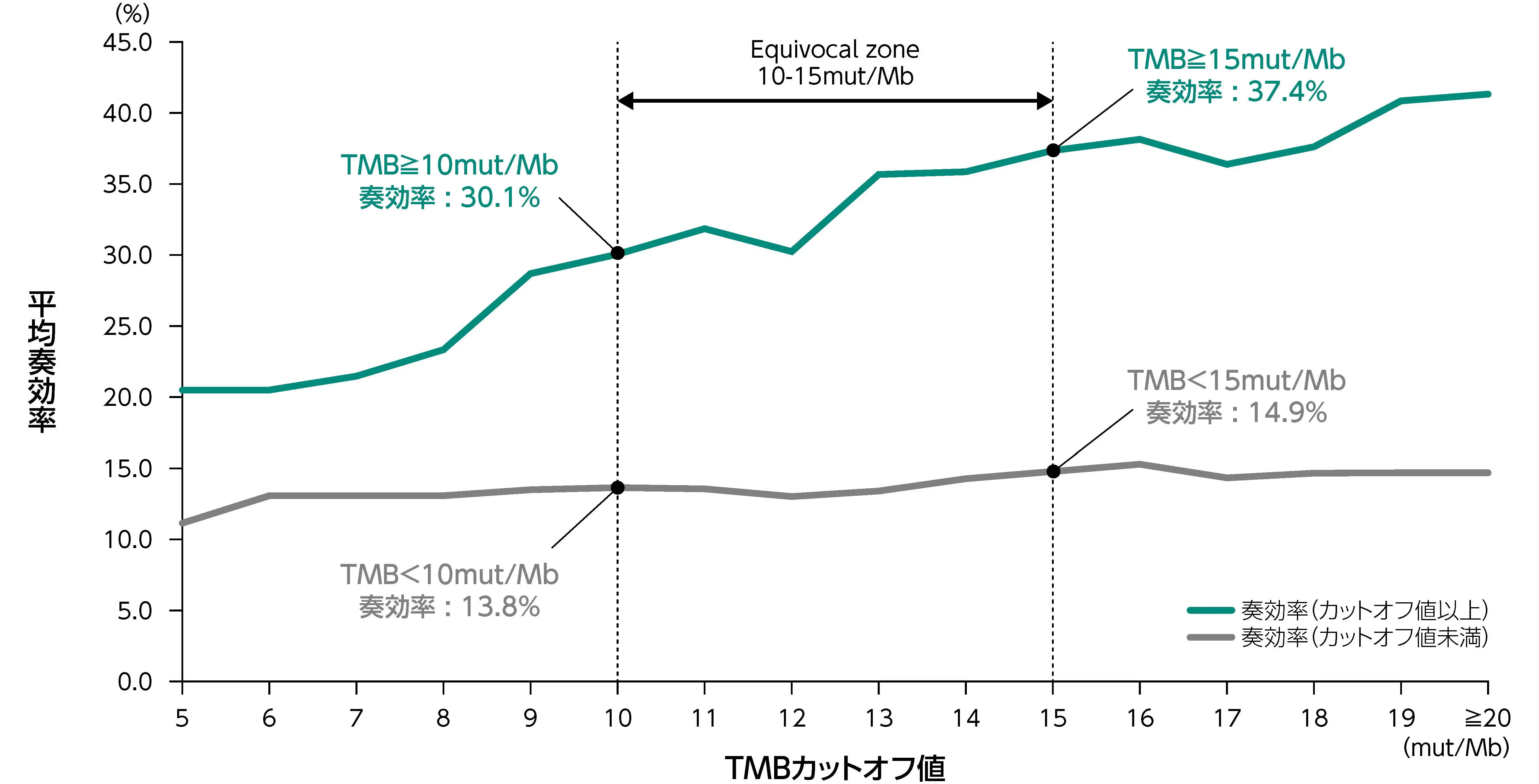
Tissue Agnostic TMB Clinical Cut-off Harmonization Initiative¹⁾
がん種横断的なPD-1/L1阻害薬の奏効率とTMBカットオフ値の相関をレトロスぺクティブに解析した結果、 固形癌患者のTMB-Highのカットオフ値として10mut/Mbを考慮して、 治験デザインや解析計画を策定することで合意した。

引用文献
1) https://friendsofcancerresearch.org/wp-content/uploads/Tissue-Agnostic-TMB_Summary.pdf (2025/7/15閲覧)
他のバイオマーカー検査コンテンツ




編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
TMB
記載されている各薬剤及び診断薬の詳細については、 最新の電子添文をご確認ください。 また、 承認されたコンパニオン診断薬等の最新情報については、 こちらをご確認ください。

アドバイザー : 国立がん研究センター中央病院 病理診断科 科長 谷田部 恭 先生、 国立研究開発法人国立がん研究センター 先端医療開発センタートランスレーショナルインフォマティクス分野 分野長 土原 一哉 先生
腫瘍遺伝子変異量 (TMB) の概要
がんと遺伝子変異
腫瘍性の形質転換 (neoplastic transformation) は、 遺伝子変異の蓄積によって生じる¹⁾。 遺伝子変異の種類や発現頻度は、 個々の腫瘍によって、 また腫瘍のタイプによってばらつきがある。
がんに関連する遺伝子変異は、 体細胞変異 (somatic mutation) と生殖細胞系列変異 (germline mutation) に大別される。

ゲノムの塩基配列のバリアント
ゲノム上に存在する塩基配列の違いは、 バリアントと呼ばれ、 変異及び多型 (先天的に存在するバリアントのなかで、 病的でないもの) を含む³⁾。 主なバリアントの種類を、 下表に示す³⁾。

遺伝子の翻訳領域内に生じた塩基配列の置換には、 同義置換と非同義置換がある。 同義置換は、 アミノ酸のコーディングに変化を与えない変異 (サイレント変異) ¹⁾で、 通常、 変異を生じた遺伝子の機能に影響を与えないと考えられている³⁾。 非同義置換は、 アミノ酸が変化する変異 (ミスセンス変異、 ナンセンス変異) ¹⁾で、 変異を生じた遺伝子の機能に影響することが知られている³⁾ 。

TMBとは
腫瘍遺伝子変異量 (tumor mutation burden : TMB) とは、 腫瘍のゲノムのタンパク質コード部分における体細胞変異の総数である¹⁾⁴⁾。

引用文献
1) Chan TA et al. Ann Oncol. 2019; 30(1): 44-56 本論文の著者にMSD社から講演料、 研究助成金、 コンサルタント料などを受領したものが含まれる。
2) Griffiths AJF et al. An Introduction to Genetic Analysis. 7th edition. New York: W. H. Freeman; 2000. Somatic versus germinal mutation.
3) 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, pp54-66, 2020
4) Champiat S et al. Oncoimmunology. 2014; 3(1): e27817 本論文の著者にMSD社からコンサルタント料などを受領したものが含まれる。
5) Galuppini F et al. Cancer Cell Int. 2019; 19: 209
TMBの増加に関連するがん遺伝子変異
がん遺伝子変異とTMBの関連性 (海外データ) ¹⁾
TMBの増加に関連する遺伝子異常として、 ミスマッチ修復 (MMR) 関連遺伝子 (MSH2、 MSH6、 MLH1、 PMS2) やDNAポリメラーゼ (POL) 遺伝子 (POLE、 POLD1) が知られている。 DNA POLは、 DNA複製時のエラー修復機能 (校正機能) やMMR過程の一部を担う。 POLE、 POLD1は、 それぞれのエラー修復機構に関与している。


TMB-HighとMSI-Highの関連性 (海外データ) ¹⁾
MSI-Highとは、 ミスマッチ修復 (mismatch repair : MMR) 機能不全により、 後天的にマイクロサテライトの反復回数の変化が高頻度に認められる状態を示す。 MSI-High固形癌ではTMB-Highになることが多いが、 TMB-High固形癌のすべてがMSI-Highとは限らない。


引用文献
1) Chalmers ZR et al. Genome Med. 2017; 9(1): 34
効果予測バイオマーカーとしてのTMB
腫瘍細胞の遺伝子変異由来のネオアンチゲンと免疫応答¹⁻³⁾
ネオアンチゲンは、 アミノ酸が変化する変異由来またはウイルスに関連した抗原であり、 免疫系によって 「異物」 または 「非自己」 として認識される。 ネオアンチゲンは、 腫瘍・免疫細胞表面に発現し、 T細胞に認識され、 T細胞の活性化につながることから、 がん免疫療法の効果予測において重要と考えられている。

効果予測バイオマーカーとしてのTMB⁴⁾
腫瘍の体細胞変異が多いほど、 ネオアンチゲンも多く形成されることから、 TMBは腫瘍によるネオアンチゲン量の推定に役立つと考えられる。 腫瘍・免疫細胞の表面に提示されるネオアンチゲンがすべて免疫原性を示すわけではないが、 TMBが高いほど、 腫瘍・免疫細胞上に免疫原性のネオアンチゲンが提示される可能性が高いことが知られている。 TMB-High腫瘍では遺伝子変異量が増加することでネオアンチゲン反応性T細胞による認識が高まる可能性があるため、 免疫チェックポイント阻害剤が反応しやすいと考えられている。

体細胞変異とネオアンチゲン²⁾⁵⁾
肺癌 (タバコ) や悪性黒色腫 (紫外線) など慢性的な変異原への曝露に関連するがんでは、 体細胞変異数が多く、 ネオアンチゲンが形成される可能性も高い。
30のがん種・7,042の腫瘍検体における4,938,362の塩基置換/Indelについて評価した結果、 体細胞変異数はがん種によって異なり、 同じがん種でも個体差が大きいことが示された (範囲 : 0.01 mut/Mb未満~400 mut/Mb超)。

がん種別のTMB-Highの割合⁴⁾⁶⁾

引用文献
1) Newkirk, K et al. Pathologic Basis of Veterinary Disease (Sixth Edition), 2017, Pages 286-321.e1
2) Schumacher TN et al. Science. 2015; 348(6230): 69-74
3) Bluestone JA Immunol Rev. 2011; 241(1): 5-19
4) Chan TA et al. Ann Oncol. 2019; 30(1): 44-56 本論文の著者にMSD社から講演料、 研究助成金、 コンサルタント料などを受領したものが含まれる。
5) Alexandrov LB et al. Nature. 2013; 500(7463): 415-421
6) 承認時評価資料 : 国際共同第Ⅱ相試験 (KEYNOTE-158試験)
TMBの測定検査
検査の概要
現在、 TMB-Highを有する固形癌に対してペムブロリズマブが承認されている*。 ペムブロリズマブの適応を判定するためのコンパニオン診断には、 TMB測定検査としてFoundationOne®CDxがんゲノムプロファイル (F1CDx) のみが承認されている¹⁾。 コンパニオン診断としてF1CDxを用いる場合は、 結果の特別な解釈は必要なく、 専門家による会議体であるエキスパートパネルでの検討は不要である²⁾。
一方、 下表のがん遺伝子パネル検査は、 TMBスコアを算出可能な包括的がんゲノムプロファイリング検査 (CGP) としても使用される。 なお、 OncoGuideᵀᴹ NCCオンコパネルシステムおよびGenMineTOP®がんゲノムプロファイリングシステムによるTMBスコア算出の手法は臨床的に確立されていないが³⁾⁴⁾、 いずれのCGPもTMBスコアはレポートに記載される。 CGPは、 得られた遺伝子異常の病的意義や対応する候補薬剤の有無などに関して、 エキスパートパネルでの検討が必要となる。
*効能又は効果 (抜粋) : がん化学療法後に増悪した高い腫瘍遺伝子変異量 (TMB-High) を有する進行・再発の固形癌 (標準的な治療が困難な場合に限る)



がん遺伝子パネル検査の詳細は、 がん遺伝子パネル検査を参照ください。
保険点数
腫瘍遺伝子変異量検査⁷⁾

がんゲノムプロファイリング検査等⁷⁾

国内ガイドラインでの記載
日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会編の 「成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン 第3版⁸⁾」 において、 TMB-Highの項目が新設され、 TMB測定の検査対象・方法・治療が詳細に解説されている。 また、 Clinical question (CQ) では、 TMB検査の対象 (CQ6)、 TMB検査法 (CQ7)、 TMB-Highに対する治療 (CQ8) について推奨度が示されている。
引用文献
1) FoundationOne® CDx がんゲノムプロファイル電子添文 (第23版)
2) 角南久仁子 他編. がんゲノム医療遺伝子パネル検査実践ガイド, 医学書院, pp32-34, 2020
3) OncoGuideᵀᴹ NCCオンコパネル システム電子添文 (第5版)
4) GenMineTOP®がんゲノムプロファイリングシステム電子添文 (第3版)
5) FoundationOne® Liquid CDx がんゲノムプロファイル電子添文 (第6版)
6) 厚生労働省 令和元年5月31日事務連絡 遺伝子パネル検査の保険適用に係る留意点についてhttps://ajhc.or.jp/siryo/20190531-2.pdf (2025/7/15閲覧)
7) 厚生労働省 : 令和6年度診療報酬改定についてー診療報酬の算定方法の一部を改正する告示 (https://www.mhlw.go.jp/content/12404000/001251499.pdf) (2025/7/15閲覧)
8) 日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会 編, 成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン 第3版, 金原出版, pp61-77, 2022
TMBのカットオフ値
KEYNOTE-158試験におけるTMB-Highの定義
現在、 化学療法歴のある進行・再発の固形癌に対するペムブロリズマブの有効性および安全性を検討するKEYNOTE-158試験のデータ¹⁾に基づき、 「がん化学療法後に増悪した高い腫瘍遺伝子変異量 (TMB-High) を有する進行・再発の固形癌 (標準的な治療が困難な場合に限る) 」 に対する適応が承認されている。
なお、 本試験では、 FoundationOne® CDxで解析されたTMBが10mut/Mb以上の症例をTMB-Highとして定義された。
臨床試験の主要文献につきましては、 下記をご参照ください。 KEYNOTE-158試験 (TMB-H) (PMID 32919526 : Marabelle A et al. Lancet Oncol. 2020;21 : 1353-1365.)
本試験の論文はMSD社の資金提供及び著者に同社の社員、 及び著者に同社より謝礼、 講演料、 顧問料、 旅費などを受領している者を含む。
組織検体を用いた包括的ゲノムプロファイリング検査 : TMB-H
大腸がん診療における遺伝子関連検査等のガイダンス改訂第5版²⁾
- KEYNOTE-158試験ではFoundationOne® CDxで解析されたTMBが10mut/Mb以上の症例がTMB-Hとして定義され、 わが国でもコンパニオン診断となっている。
- TMBのカットオフ値である10mut/Mbは、 がん種横断的なカットオフ値の適用に向けた産官学によるコンソーシアムにて、 コンセンサスが得られた値である³⁾⁴⁾。
- 一方で、 TMBについては、 がん種ごとにICIの有効性に係わるカットオフ値が異なる可能性が示唆されている⁵⁾⁶⁾。
引用文献
1) Marabelle A et al. Lancet Oncol. 2020; 21(10): 1353-1365
2)日本臨床腫瘍学会 編,大腸がん診療における遺伝子関連検査等のガイダンス改訂第5版, 金原出版 pp53-60, 2023
3)日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会 編, 成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン 第3版, 金原出版, pp61-77, 2022
4) Merino DM et al. J Immunother Cancer 8(1): e000147, 2020
5) Valero C et al. JAMA Oncol. 2021; 7(5): 739-743
6) Rousseau B et al. N Engl J Med. 2021; 384(12): 1168-1170
論文1) は、 MSD社の資金提供及び著者に同社の社員、 及び著者に同社より謝礼、 講演料、 顧問料、 旅費などを受領している者を含む。
論文4) は、 著者にMSD社から研究助成金、 コンサルタント料などを受領したものが含まれる。
がんゲノム検査とTMB測定
がんゲノム検査とTMB¹⁾
がんゲノム検査は、 対象となる遺伝子の範囲によって、 下記の4つに大きく分けられる。
TMBは、 研究のみで実施されている全ゲノム検査 (WGS) や全エクソン検査 (WES) で従来評価されていた。 近年、 がん遺伝子パネル検査でも高感度にTMBを算出できることが報告され、 WES TMBと相関することから、 臨床で使用されている²⁾。

WESと主ながん遺伝子パネル検査³⁻⁶⁾

がん遺伝子パネル検査の開発と課題⁷⁾
高コストのWESに替わり、 臨床使用が容易ながん遺伝子パネル検査が複数開発されている。 一方、 WESによるTMBスコアが既知の臨床検体を用いて、 複数のがん遺伝子パネル検査間のTMBスコアのばらつきを検討したところ、 特にTMBスコアの増加に伴い、 ばらつきが大きくなる傾向があることが報告されている⁸⁾。 TMB評価の一貫性を図るため、 現在、 TMBの標準化に向けたプロジェクトが進行中である。

*データベースはdbSNP、 ExAC、 1000G、 NHLBI-ESP、 private dbを使用
※1 : 対立遺伝子頻度 (VAF) を基に手作業で評価
※2 : VAFを基にデータベース (詳細不明) で評価
※3 : 不明
Eifert C et al. Per Med. 2017; 14(4), 309-325
Qiu P et al. Int J Mol Sci. 2016; 17(5), 651
Zehir A et al. Nat Med. 2017; 23, 703-713
Salem ME et al. Mol Cancer Res. 2018; 16(5), 805–812
Goodman AM et al. Mol Cancer Ther. 2017; 16(11), 2598-2608
Chalmers ZR et al. Genome Med. 2017; 9(1): 34
Johnson DB et al. Cancer Immunol Res. 2016; 4(11): 959–967
Rosenberg JE et al. Lancet. 2016; 387(10031): 1909-1920
Hellmann MD et al. N Engl J Med. 2018; 378(22): 2093-2104
Gandara DR et al. Nat Med. 2018; 24(9): 1441-1448
Chaudhary R et al. Transl Lung Cancer Res. 2018; 7(6): 616–630
引用文献
1) 国立がん研究センター 中央病院, がんゲノム医療とは : https://www.ncc.go.jp/jp/ncch/genome/080/index.html (2025/7/15閲覧)
2) 日本臨床腫瘍学会/日本癌治療学会/日本小児血液・がん学会 編, 成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン 第3版, 金原出版, pp61-77, 2022
3) Chan TA et al. Ann Oncol. 2019; 30(1): 44-56 本論文の著者にMSD社から講演料、 研究助成金、 コンサルタント料などを受領したものが含まれる。
4) FoundationOne® CDx がんゲノムプロファイル 電子添文 (第23版)
5) OncoGuideᵀᴹ NCCオンコパネル システム 電子添文 (第5版)
6) Merino DM et al. J Immunother Cancer. 2020; 8(1): e000147
7) Fancello L et al. J Immunother Cancer. 2019; 7(1): 183 本試験はMSD社を含む複数社の資金提供により行われた。 本論文の著者にMSD社から講演料を受領したものが含まれる。
8) Vega DM et al. Ann Oncol. 2023; 32(12): 1626-1636 本論文の著者にMSD社から講演料、 コンサルタント料などを受領したものが含まれる。
TMB標準化プロジェクト
産官学コンソーシアム : Friends & QuIP イニシアティブ¹⁾
TMBの測定方法や、 臨床的有用性の検討方法の標準化を目的として、 米Friends of Cancer Research (Friends) と、 独Quality Assurance Initiative Pathology (QuIP) を中心とする産官学コンソーシアムが設立された。

TMB標準化・ハーモナイゼーションイニシアティブの目的
- TMBの測定方法による差異 (WESとがん遺伝子パネル検査の違い) の特定
- 各がん遺伝子パネル検査の標準化を目指し、 WESを用いたTMBの参照基準の作成
- アッセイ間・ラボ間のばらつきの評価、 その要因の特定
- TMBの評価、 レポート方法、 カットオフ値のばらつきを最小化・補正するための推奨事項の策定、 前向き臨床研究を実施するにあたってのベストプラクティスの普及
Friends & QuIPイニシアティブからの提言 : TMB測定の一貫性向上を目指して¹⁾

引用文献
1) Stenzinger A et al. Genes Chromosomes Cancer 2019; 58(8): 578-588
がん遺伝子パネル検査によるTMB測定の精度
がん遺伝子パネル検査とWESとの相関¹⁾

がん遺伝子パネル検査の再現性¹⁾

シーケンシングゲノム量の影響¹⁾


引用文献
1) Chalmers ZR et al. Genome Med. 2017; 9(1): 34
TMB標準化プロジェクトによるTMBカットオフ値
Tissue Agnostic TMB Clinical Cut-off Harmonization Initiative¹⁾
がん種横断的なPD-1/L1阻害薬の奏効率とTMBカットオフ値の相関をレトロスぺクティブに解析した結果、 固形癌患者のTMB-Highのカットオフ値として10mut/Mbを考慮して、 治験デザインや解析計画を策定することで合意した。


引用文献
1) https://friendsofcancerresearch.org/wp-content/uploads/Tissue-Agnostic-TMB_Summary.pdf (2025/7/15閲覧)
他のバイオマーカー検査コンテンツ




編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




