T-DXd (Trastuzumab deruxtecan) : ホルモン療法歴あり・化学療法歴なし
トラスツズマブ デルクステカン (エンハーツ®︎)
従来、 化学療法歴のあるHER2陽性又はHER2低発現の手術不能・再発乳癌、 がん化学療法後に増悪したHER2 (ERBB2) 遺伝子変異陽性の切除不能な進行・再発非小細胞肺癌、 ならびにHER2陽性の治癒切除不能な進行・再発胃癌に適応を有していたが、 2025年8月25日に 「ホルモン受容体陽性かつHER2低発現又は超低発現の手術不能・再発乳癌」 が追加承認された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*第一三共株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】 21日間
【催吐性*】 中等度 (日本)、 高度 (NCCN GL)
【FN発症**】 低リスク
*本邦の制吐薬適正使用ガイドラインと、 NCCNガイドライン 「Antiemesis」 における分類は異なる点に留意が必要
**DESTINY-Breast06試験のFN発生率1.2%²⁾より編集部が分類

トラスツズマブ デルクステカン (T-DXd) 5.4 mg/kgを3週ごとに点滴静注。 初回は90分かけて投与し、 忍容性が確認できれば2回目以降は30分まで短縮可能
エンハーツ®電子添文情報¹⁾を基に編集部作成
Key Data|臨床試験結果
📊 DESTINY-Breast06試験
N Engl J Med. 2024;391(22):2110-2122.
ホルモン受容体陽性かつHER2低発現又は超低発現の転移性乳がん患者で、 1レジメン以上の内分泌療法歴があり化学療法未治療の866例を対象に、 国際多施設共同の無作為化第III相非盲検試験が実施された。 HER2低発現713例と超低発現153例が、 トラスツズマブ デルクステカン群又は医師選択 (カペシタビン、 アルブミン懸濁型パクリタキセル、 パクリタキセル) による単剤化学療法群に1:1で割り付けられ、 主要評価項目はHER2低発現群におけるPFSとされた。
HER2低発現 : IHC 1+、 又はIHC 2+かつISH陰性
HER2超低発現 : IHC 0だが膜染色を認める (IHC >0かつ<1+)
【有効性】T-DXd群 (vs 医師選択治療群)
HER2低発現 :
- PFS中央値 13.2ヵ月 (vs 8.1ヵ月)
- ハザード比 (HR) 0.62 (95%CI 0.52–0.75、 p<0.001)
- 奏効率 56.5% (vs 32.2%)
- 奏効期間中央値 14.1ヵ月 (vs 8.6ヵ月)
HER2超低発現 :
- PFS中央値 13.2ヵ月 (vs 8.3ヵ月)
- ハザード比 (HR) 0.78 (95%CI 0.50–1.21)
- 奏効率 61.8% (vs 26.3%)
- 奏効期間中央値 14.3ヵ月 (vs 14.1ヵ月)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 悪心 65.9% (1.6%)
- 疲労 46.8% (3.7%)
- 脱毛症 45.4% (0%)
- 好中球減少 37.6% (20.7%)
- ALT増加 29.5% (2.3%)
- 貧血 28.1% (5.8%)
- 嘔吐 27.2% (1.4%)
- 下痢 23.7% (1.8%)
- 食欲減退 23.5% (1.4%)
- 白血球減少 23.3% (6.9%)
- 手掌・足底発赤知覚不全症候群 0.5% (0%)
各プロトコル
適格基準
DESTINY-Breast06試験³⁾の主な適格基準 :
- 18歳以上 (日本では20歳以上)
- ECOG PS 0–1
- 好中球数≧1,500/mm³
- 血小板数≧10万/mm³
- ヘモグロビン≧9.0g/dL
- 腎機能 : CrCl≧30mL/min
- 肝機能 : AST/ALT≦ 3×ULN、 T-Bil≦1.5×ULN
- LVEF≧50%
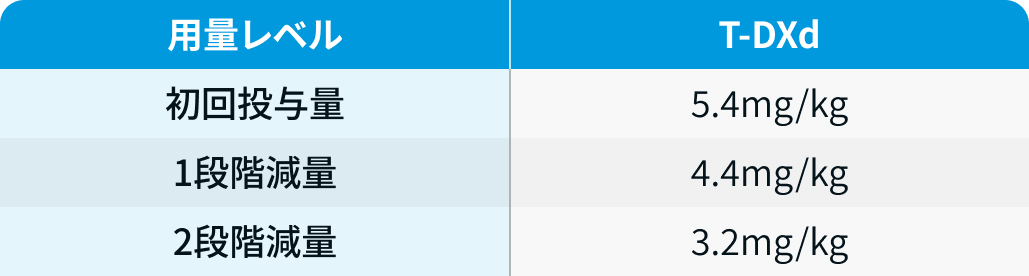
用量レベル
有害事象発現時の減量・休薬・中止基準
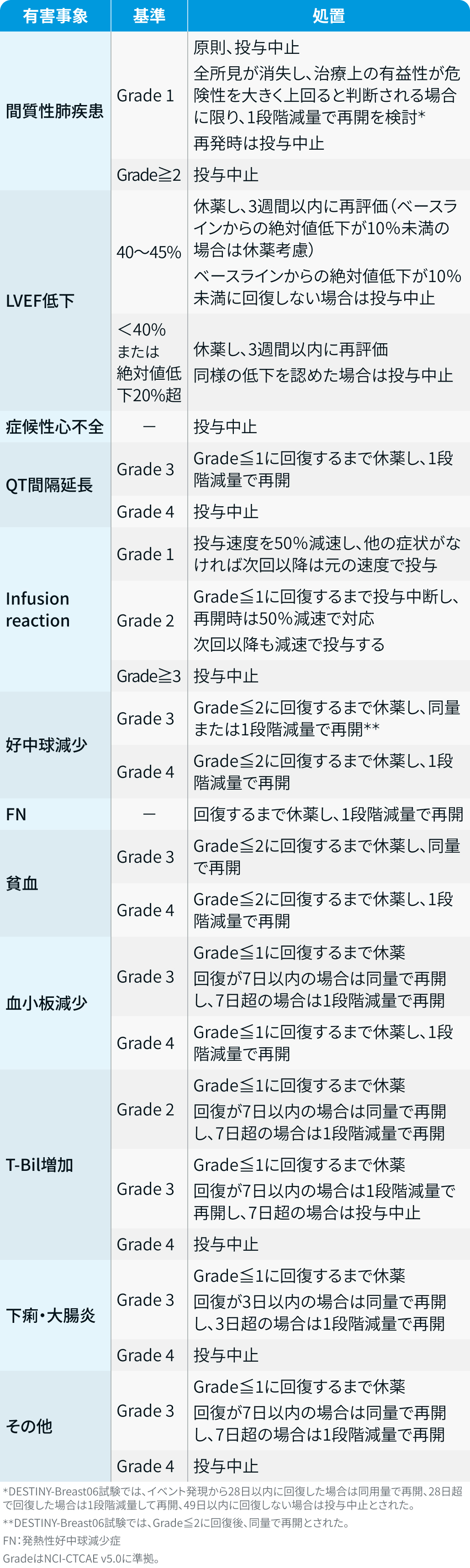
エンハーツ®電子添文情報¹⁾を基に編集部作成
DESTINY-Breast06試験³⁾では、 上記に加え、 悪心Grade 3発現時はGrade≦1に回復するまで休薬し、 回復が7日以内の場合は同量で、 7日超の場合は1段階減量で再開とされた。
レジメンの特徴と注意点
作用機序の特徴
T-DXdは、 HER2に対するヒト化モノクローナル抗体と、 トポイソメラーゼⅠ阻害作用を有するカンプトテシン誘導体をリンカーで結合させた抗体薬物複合体である。 腫瘍細胞膜上のHER2に結合し、 細胞内に取り込まれた後リンカーが加水分解され、 遊離したカンプトテシン誘導体がDNA傷害作用とアポトーシス誘導作用を示すことで腫瘍増殖を抑制すると考えられている。
本レジメンの位置付け
乳癌に対するT-DXdの適応症と、 その承認根拠となったピボタル試験は以下のとおり。

T-DXd (化学療法歴のあるHER2陽性又はHER2低発現) を確認する
HOKUTOレジメンツールに遷移します
レジメン適用時の注意事項
間質性肺疾患 : 投与開始前および投与中は呼吸状態・咳・発熱などの臨床症状を観察し、 SpO₂、 胸部X線、 CTを定期的に実施。 必要に応じてKL-6、 PaO₂、 A-aDO₂、 DLcoなども評価。 CT画像などの読影は呼吸器疾患に精通した医師の助言を得る。 患者には初期症状出現時の速やかな受診を指導する。
心毒性 : LVEF低下の可能性があるため、 投与開始前に心機能を確認。 投与中は心症状や重症度に応じて心エコー等を適宜実施し、 LVEF変動を含めた状態を観察のうえ、 休薬・再開・中止を判断する。
DESTINY-Breast06試験³⁾のプロトコルでは、 LVEFはスクリーニング時、 サイクル5 Day 1、 以降は4サイクルごとに測定された。
RMP【重要な特定されたリスク】
エンハーツ®医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 骨髄抑制
- Infusion reaction
コンパニオン診断薬の情報
HER2低発現又は超低発現の確認には、 以下の体外診断用医薬品又は医療機器が承認されている。
ベンタナ ultraView パスウェー HER2 (4B5)
出典
- 第一三共株式会社 エンハーツ®︎点滴静注用 電子添文 2025年8月改訂 第12版
- 第一三共株式会社 エンハーツ®︎点滴静注用 適正使用ガイド. 2025年8月改訂
- N Engl J Med. 2024;391(22):2110-2122.
最終更新日 : 2025年8月27日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部 監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
T-DXd (Trastuzumab deruxtecan) : ホルモン療法歴あり・化学療法歴なし
従来、 化学療法歴のあるHER2陽性又はHER2低発現の手術不能・再発乳癌、 がん化学療法後に増悪したHER2 (ERBB2) 遺伝子変異陽性の切除不能な進行・再発非小細胞肺癌、 ならびにHER2陽性の治癒切除不能な進行・再発胃癌に適応を有していたが、 2025年8月25日に 「ホルモン受容体陽性かつHER2低発現又は超低発現の手術不能・再発乳癌」 が追加承認された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*第一三共株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】 21日間
【催吐性*】 中等度 (日本)、 高度 (NCCN GL)
【FN発症**】 低リスク
*本邦の制吐薬適正使用ガイドラインと、 NCCNガイドライン 「Antiemesis」 における分類は異なる点に留意が必要
**DESTINY-Breast06試験のFN発生率1.2%²⁾より編集部が分類

トラスツズマブ デルクステカン (T-DXd) 5.4 mg/kgを3週ごとに点滴静注。 初回は90分かけて投与し、 忍容性が確認できれば2回目以降は30分まで短縮可能
エンハーツ®電子添文情報¹⁾を基に編集部作成
Key Data|臨床試験結果
📊 DESTINY-Breast06試験
N Engl J Med. 2024;391(22):2110-2122.
ホルモン受容体陽性かつHER2低発現又は超低発現の転移性乳がん患者で、 1レジメン以上の内分泌療法歴があり化学療法未治療の866例を対象に、 国際多施設共同の無作為化第III相非盲検試験が実施された。 HER2低発現713例と超低発現153例が、 トラスツズマブ デルクステカン群又は医師選択 (カペシタビン、 アルブミン懸濁型パクリタキセル、 パクリタキセル) による単剤化学療法群に1:1で割り付けられ、 主要評価項目はHER2低発現群におけるPFSとされた。
HER2低発現 : IHC 1+、 又はIHC 2+かつISH陰性
HER2超低発現 : IHC 0だが膜染色を認める (IHC >0かつ<1+)
【有効性】T-DXd群 (vs 医師選択治療群)
HER2低発現 :
- PFS中央値 13.2ヵ月 (vs 8.1ヵ月)
- ハザード比 (HR) 0.62 (95%CI 0.52–0.75、 p<0.001)
- 奏効率 56.5% (vs 32.2%)
- 奏効期間中央値 14.1ヵ月 (vs 8.6ヵ月)
HER2超低発現 :
- PFS中央値 13.2ヵ月 (vs 8.3ヵ月)
- ハザード比 (HR) 0.78 (95%CI 0.50–1.21)
- 奏効率 61.8% (vs 26.3%)
- 奏効期間中央値 14.3ヵ月 (vs 14.1ヵ月)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 悪心 65.9% (1.6%)
- 疲労 46.8% (3.7%)
- 脱毛症 45.4% (0%)
- 好中球減少 37.6% (20.7%)
- ALT増加 29.5% (2.3%)
- 貧血 28.1% (5.8%)
- 嘔吐 27.2% (1.4%)
- 下痢 23.7% (1.8%)
- 食欲減退 23.5% (1.4%)
- 白血球減少 23.3% (6.9%)
- 手掌・足底発赤知覚不全症候群 0.5% (0%)
各プロトコル
適格基準
DESTINY-Breast06試験³⁾の主な適格基準 :
- 18歳以上 (日本では20歳以上)
- ECOG PS 0–1
- 好中球数≧1,500/mm³
- 血小板数≧10万/mm³
- ヘモグロビン≧9.0g/dL
- 腎機能 : CrCl≧30mL/min
- 肝機能 : AST/ALT≦ 3×ULN、 T-Bil≦1.5×ULN
- LVEF≧50%
用量レベル

有害事象発現時の減量・休薬・中止基準

エンハーツ®電子添文情報¹⁾を基に編集部作成
DESTINY-Breast06試験³⁾では、 上記に加え、 悪心Grade 3発現時はGrade≦1に回復するまで休薬し、 回復が7日以内の場合は同量で、 7日超の場合は1段階減量で再開とされた。
レジメンの特徴と注意点
作用機序の特徴
T-DXdは、 HER2に対するヒト化モノクローナル抗体と、 トポイソメラーゼⅠ阻害作用を有するカンプトテシン誘導体をリンカーで結合させた抗体薬物複合体である。 腫瘍細胞膜上のHER2に結合し、 細胞内に取り込まれた後リンカーが加水分解され、 遊離したカンプトテシン誘導体がDNA傷害作用とアポトーシス誘導作用を示すことで腫瘍増殖を抑制すると考えられている。
本レジメンの位置付け
乳癌に対するT-DXdの適応症と、 その承認根拠となったピボタル試験は以下のとおり。

T-DXd (化学療法歴のあるHER2陽性又はHER2低発現) を確認する
HOKUTOレジメンツールに遷移します
レジメン適用時の注意事項
間質性肺疾患 : 投与開始前および投与中は呼吸状態・咳・発熱などの臨床症状を観察し、 SpO₂、 胸部X線、 CTを定期的に実施。 必要に応じてKL-6、 PaO₂、 A-aDO₂、 DLcoなども評価。 CT画像などの読影は呼吸器疾患に精通した医師の助言を得る。 患者には初期症状出現時の速やかな受診を指導する。
心毒性 : LVEF低下の可能性があるため、 投与開始前に心機能を確認。 投与中は心症状や重症度に応じて心エコー等を適宜実施し、 LVEF変動を含めた状態を観察のうえ、 休薬・再開・中止を判断する。
DESTINY-Breast06試験³⁾のプロトコルでは、 LVEFはスクリーニング時、 サイクル5 Day 1、 以降は4サイクルごとに測定された。
RMP【重要な特定されたリスク】
エンハーツ®医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 骨髄抑制
- Infusion reaction
コンパニオン診断薬の情報
HER2低発現又は超低発現の確認には、 以下の体外診断用医薬品又は医療機器が承認されている。
ベンタナ ultraView パスウェー HER2 (4B5)
出典
- 第一三共株式会社 エンハーツ®︎点滴静注用 電子添文 2025年8月改訂 第12版
- 第一三共株式会社 エンハーツ®︎点滴静注用 適正使用ガイド. 2025年8月改訂
- N Engl J Med. 2024;391(22):2110-2122.
最終更新日 : 2025年8月27日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部 監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。