Dato-DXd (Datopotamab deruxtecan)
ダトポタマブ デルクステカン (ダトロウェイ®)
「化学療法歴のあるホルモン受容体陽性かつHER2陰性の手術不能または再発乳がん」 の効能・効果で、 新有効成分含有医薬品として2024年12月27日に正式承認、 2025年3月19日に薬価収載となった。 100mg1瓶 31万1990円 (1日薬価 : 4万4570円)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗TROP2抗体薬物複合体 (ADC)
ダトポタマブ デルクステカン (Dato-DXd)
*第一三共株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】21日間
【催吐性】高度*
【FN発症】低リスク**
*NCCN Guidelines Version 2.2025 Antiemesisより引用
**TROPION-Breast01試験のFN発症率0%より編集部が分類
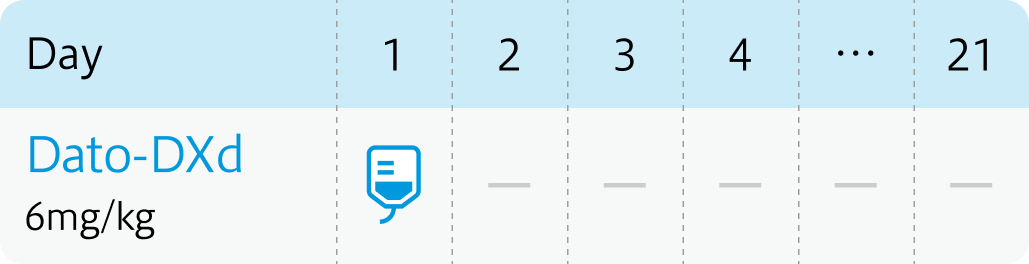
6mg/kgを3週ごとに90分かけて点滴静注。 初回投与の忍容性が良好な場合、 2回目以降は30分まで短縮可能。
Infusion reaction軽減のため、 抗ヒスタミン薬および解熱鎮痛薬を前投与し、 必要に応じて副腎皮質ステロイドの併用も考慮。
Key Data|臨床試験結果
📊 TROPION-Breast01試験
化学療法歴のあるホルモン受容体陽性・HER2陰性 (HER2陰性は、 IHC 2+ かつ ISH 陰性、 IHC 1+、 または IHC 0 と定義) の手術不能または再発乳癌患者732例を対象とした、 国際共同の非盲検無作為化第III相比較試験である。 Dato-DXd群 (365例) と医師選択治療群 (367例) に1:1で無作為に割り付け、 主要評価項目として、 PFSおよびOSが設定された。
【有効性】Dato-DXd群 (vs 医師選択治療群)
- PFS中央値 : 6.9ヵ月 (vs 4.9ヵ月)
- 12ヵ月時点のPFS率 : 25.5% (vs 14.6%)
- ハザード比 : 0.63 (95% CI 0.52–0.76)
- OS : データ未成熟 (ハザード比0.84)
- 奏効率 : 36.4% (vs 22.9%)
- 奏効期間中央値 : 6.7ヵ月 (vs 5.7ヵ月)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 悪心 51.1% (1.4%)
- 口内炎 50.0% (6.4%)
- 脱毛症 36.4% (0%)
- 疲労 23.6% (1.7%)
- ドライアイ 21.7% (0.6%)
- 嘔吐 19.7% (1.1%)
- 便秘 18.1% (0%)
- 角膜炎 14.4% (0.6%)
- 食欲減退 13.9% (0.8%)
- 無力症 12.5% (0.8%)
- 貧血 11.1% (1.1%)
- 好中球減少症 10.8% (1.1%)
- AST増加 8.6% (0.6%)
- 下痢 7.5% (0%)
- 白血球減少症 7.2% (0.6%)
- 手足症候群 1.9% (0%)
- 血小板数減少 1.9% (0%)
- 発熱性好中球減少症 0% (0%)
各プロトコル
適格基準
TROPION-Breast01試験の主な適格基準
- 年齢≧18 歳
- ECOG PS 0–1
- 手術不能又は転移性のHR+/HER2-乳癌
HER2陰性の定義 : IHC 0、 1+、 または2+/ISH陰性
- 内分泌療法後に病勢進行した患者、 または内分泌療法が不適当と判断された患者
- 切除不能または転移性乳癌に対する化学療法歴が1~2ライン
用量レベル
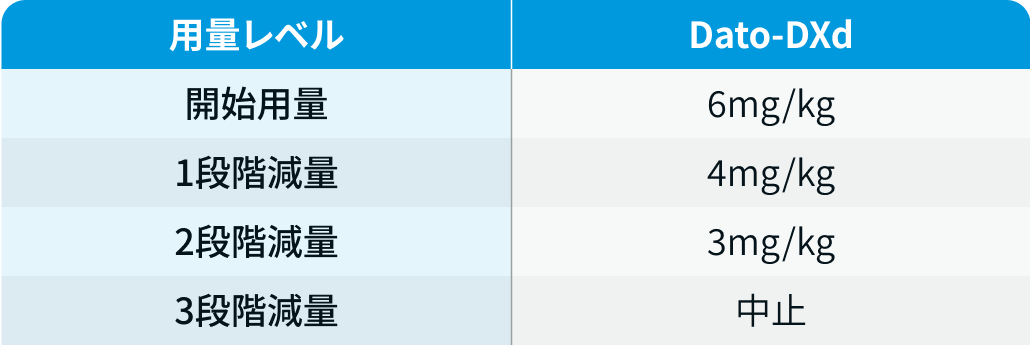
ダトロウェイ®電子添文¹⁾を基に編集部作成
有害事象発現時の対応方法
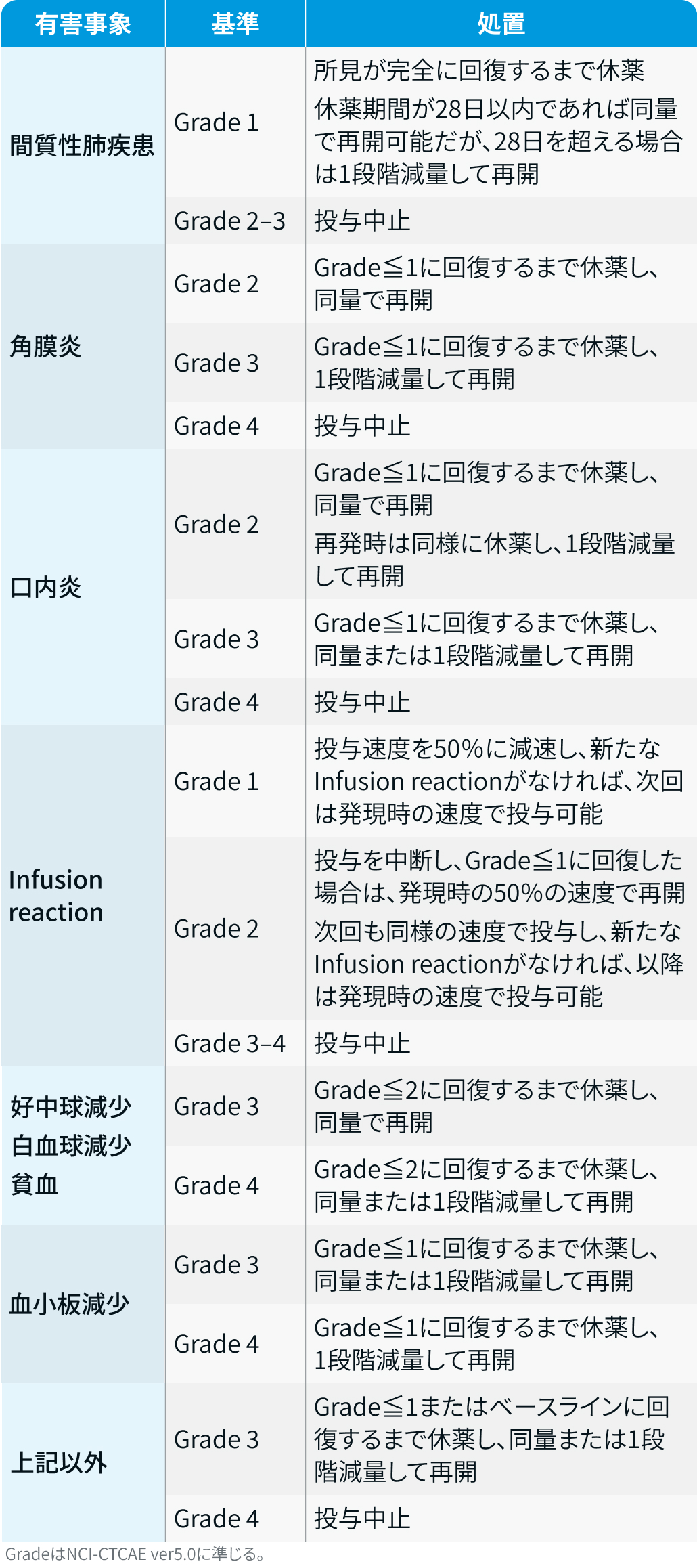
ダトロウェイ®電子添文¹⁾を基に編集部作成
レジメンの特徴と注意点
作用機序
ダトポタマブ デルクステカンは、 TROP-2に対するヒト化モノクローナル抗体に、 トポイソメラーゼ阻害作用を有するカンプトテシン誘導体をリンカーで結合させた抗体薬物複合体である。 TROP-2を発現する腫瘍細胞膜に結合後、 細胞内に取り込まれてリンカーが加水分解され、 遊離したカンプトテシン誘導体がDNA損傷およびアポトーシスを誘導することで、 腫瘍増殖を抑制すると考えられている。
2剤目の抗TROP2抗体薬物複合体
国内では、 抗TROP2抗体薬物複合体として、 サシツズマブ ゴビテカン (トロデルビ®) が2024年11月に発売されているが、 適応は異なる。
トロデルビ® ・・・・・HR陰性HER2陰性
ダトロウェイ® ・・・HR陽性HER2陰性
本レジメンは、 内分泌療法の適応とならない手術不能または再発乳癌に対し、 1~2レジメンの化学療法歴があり、 かつアントラサイクリン系またはタキサン系抗悪性腫瘍薬の治療歴を有する患者に適用される。
薬剤師からのワンポイントアドバイス
NTT東日本関東病院薬剤部 兼平暖先生
2025年2月12日のESMO Virtual Plenaryにおいて、 TROPION-Breast01試験の最終解析結果が報告され、 OSのハザード比は1.01 (95%CI 0.83–1.22、 p=0.94) であった。 本結果を踏まえ、 HER2低発現例においては、 DESTINY-Breast04試験にてOSおよびPFSの有意な改善が示されたT-DXdが第一選択と考えられている。
眼障害の予防²⁾ : 投与期間中はコンタクトレンズの使用を控え、 人工涙液*を1日6回程度の頻度で使用する。 防腐剤による角膜炎の悪化を避けるため、 防腐剤無添加の点眼薬を用いること。 また、 ヒアルロン酸ナトリウムなどの粘稠性の高い点眼薬は、 抗がん剤を含む涙液の滞留を助長するおそれがあるため使用を避ける。
*防腐剤を含まない人工涙液の医療用医薬品は存在しないため一般用医薬品を購入する : ソフトサンティア®、 なみだロート®ファイブ
口内炎の予防²⁾ : 治療開始前および投与中に歯科医師による定期的な口腔ケアを実施することが望ましい。 また、 投与中は氷片などによる口腔内冷却 (クライオセラピー) が推奨されている。
レジメン適用時の注意事項¹⁾
間質性肺疾患 : 投与開始前および投与中は、 呼吸状態・咳・発熱などの臨床症状を観察し、 定期的にSpO₂測定、 胸部X線・CTを実施。 必要に応じて血清マーカー等も測定し、 画像診断には呼吸器疾患に精通した医師の助言を得る。 患者には初期症状出現時の速やかな受診を指導。
角膜障害 : 定期的に眼症状の有無を確認し、 異常があれば速やかに眼科受診を指導。
Infusion reaction : 重度の反応に備え、 緊急時対応可能な体制下で投与を開始。
骨髄抑制 : 定期的に血液検査を行い、 患者の状態を十分に観察。
RMP【重要な特定されたリスク】
ダトロウェイ® 医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 角膜障害
- Infusion reaction
- 骨髄抑制
出典
- 第一三共株式会社. ダトロウェイ®添付文書 (2025年3月改訂 第2版)
- 第一三共株式会社. ダトロウェイ®適正使用 (2025年3月改訂)
- J Clin Oncol. 2025;43(3):285-296.
最終更新日 : 2025年6月30日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
Dato-DXd (Datopotamab deruxtecan)
「化学療法歴のあるホルモン受容体陽性かつHER2陰性の手術不能または再発乳がん」 の効能・効果で、 新有効成分含有医薬品として2024年12月27日に正式承認、 2025年3月19日に薬価収載となった。 100mg1瓶 31万1990円 (1日薬価 : 4万4570円)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗TROP2抗体薬物複合体 (ADC)
ダトポタマブ デルクステカン (Dato-DXd)
*第一三共株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】21日間
【催吐性】高度*
【FN発症】低リスク**
*NCCN Guidelines Version 2.2025 Antiemesisより引用
**TROPION-Breast01試験のFN発症率0%より編集部が分類

6mg/kgを3週ごとに90分かけて点滴静注。 初回投与の忍容性が良好な場合、 2回目以降は30分まで短縮可能。
Infusion reaction軽減のため、 抗ヒスタミン薬および解熱鎮痛薬を前投与し、 必要に応じて副腎皮質ステロイドの併用も考慮。
Key Data|臨床試験結果
📊 TROPION-Breast01試験
化学療法歴のあるホルモン受容体陽性・HER2陰性 (HER2陰性は、 IHC 2+ かつ ISH 陰性、 IHC 1+、 または IHC 0 と定義) の手術不能または再発乳癌患者732例を対象とした、 国際共同の非盲検無作為化第III相比較試験である。 Dato-DXd群 (365例) と医師選択治療群 (367例) に1:1で無作為に割り付け、 主要評価項目として、 PFSおよびOSが設定された。
【有効性】Dato-DXd群 (vs 医師選択治療群)
- PFS中央値 : 6.9ヵ月 (vs 4.9ヵ月)
- 12ヵ月時点のPFS率 : 25.5% (vs 14.6%)
- ハザード比 : 0.63 (95% CI 0.52–0.76)
- OS : データ未成熟 (ハザード比0.84)
- 奏効率 : 36.4% (vs 22.9%)
- 奏効期間中央値 : 6.7ヵ月 (vs 5.7ヵ月)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 悪心 51.1% (1.4%)
- 口内炎 50.0% (6.4%)
- 脱毛症 36.4% (0%)
- 疲労 23.6% (1.7%)
- ドライアイ 21.7% (0.6%)
- 嘔吐 19.7% (1.1%)
- 便秘 18.1% (0%)
- 角膜炎 14.4% (0.6%)
- 食欲減退 13.9% (0.8%)
- 無力症 12.5% (0.8%)
- 貧血 11.1% (1.1%)
- 好中球減少症 10.8% (1.1%)
- AST増加 8.6% (0.6%)
- 下痢 7.5% (0%)
- 白血球減少症 7.2% (0.6%)
- 手足症候群 1.9% (0%)
- 血小板数減少 1.9% (0%)
- 発熱性好中球減少症 0% (0%)
各プロトコル
適格基準
TROPION-Breast01試験の主な適格基準
- 年齢≧18 歳
- ECOG PS 0–1
- 手術不能又は転移性のHR+/HER2-乳癌
HER2陰性の定義 : IHC 0、 1+、 または2+/ISH陰性
- 内分泌療法後に病勢進行した患者、 または内分泌療法が不適当と判断された患者
- 切除不能または転移性乳癌に対する化学療法歴が1~2ライン
用量レベル

ダトロウェイ®電子添文¹⁾を基に編集部作成
有害事象発現時の対応方法

ダトロウェイ®電子添文¹⁾を基に編集部作成
レジメンの特徴と注意点
作用機序
ダトポタマブ デルクステカンは、 TROP-2に対するヒト化モノクローナル抗体に、 トポイソメラーゼ阻害作用を有するカンプトテシン誘導体をリンカーで結合させた抗体薬物複合体である。 TROP-2を発現する腫瘍細胞膜に結合後、 細胞内に取り込まれてリンカーが加水分解され、 遊離したカンプトテシン誘導体がDNA損傷およびアポトーシスを誘導することで、 腫瘍増殖を抑制すると考えられている。
2剤目の抗TROP2抗体薬物複合体
国内では、 抗TROP2抗体薬物複合体として、 サシツズマブ ゴビテカン (トロデルビ®) が2024年11月に発売されているが、 適応は異なる。
トロデルビ® ・・・・・HR陰性HER2陰性
ダトロウェイ® ・・・HR陽性HER2陰性
本レジメンは、 内分泌療法の適応とならない手術不能または再発乳癌に対し、 1~2レジメンの化学療法歴があり、 かつアントラサイクリン系またはタキサン系抗悪性腫瘍薬の治療歴を有する患者に適用される。
薬剤師からのワンポイントアドバイス
NTT東日本関東病院薬剤部 兼平暖先生
2025年2月12日のESMO Virtual Plenaryにおいて、 TROPION-Breast01試験の最終解析結果が報告され、 OSのハザード比は1.01 (95%CI 0.83–1.22、 p=0.94) であった。 本結果を踏まえ、 HER2低発現例においては、 DESTINY-Breast04試験にてOSおよびPFSの有意な改善が示されたT-DXdが第一選択と考えられている。
眼障害の予防²⁾ : 投与期間中はコンタクトレンズの使用を控え、 人工涙液*を1日6回程度の頻度で使用する。 防腐剤による角膜炎の悪化を避けるため、 防腐剤無添加の点眼薬を用いること。 また、 ヒアルロン酸ナトリウムなどの粘稠性の高い点眼薬は、 抗がん剤を含む涙液の滞留を助長するおそれがあるため使用を避ける。
*防腐剤を含まない人工涙液の医療用医薬品は存在しないため一般用医薬品を購入する : ソフトサンティア®、 なみだロート®ファイブ
口内炎の予防²⁾ : 治療開始前および投与中に歯科医師による定期的な口腔ケアを実施することが望ましい。 また、 投与中は氷片などによる口腔内冷却 (クライオセラピー) が推奨されている。
レジメン適用時の注意事項¹⁾
間質性肺疾患 : 投与開始前および投与中は、 呼吸状態・咳・発熱などの臨床症状を観察し、 定期的にSpO₂測定、 胸部X線・CTを実施。 必要に応じて血清マーカー等も測定し、 画像診断には呼吸器疾患に精通した医師の助言を得る。 患者には初期症状出現時の速やかな受診を指導。
角膜障害 : 定期的に眼症状の有無を確認し、 異常があれば速やかに眼科受診を指導。
Infusion reaction : 重度の反応に備え、 緊急時対応可能な体制下で投与を開始。
骨髄抑制 : 定期的に血液検査を行い、 患者の状態を十分に観察。
RMP【重要な特定されたリスク】
ダトロウェイ® 医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 角膜障害
- Infusion reaction
- 骨髄抑制
出典
- 第一三共株式会社. ダトロウェイ®添付文書 (2025年3月改訂 第2版)
- 第一三共株式会社. ダトロウェイ®適正使用 (2025年3月改訂)
- J Clin Oncol. 2025;43(3):285-296.
最終更新日 : 2025年6月30日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。