Trastuzumab + Pertuzumab + Aromatase Inhibitor
トラスツズマブ+ペルツズマブ+アロマターゼ阻害薬
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬の外部サイトへ遷移します
- アリミデックス® (添付文書)
- フェマーラ® (添付文書)
投与スケジュール
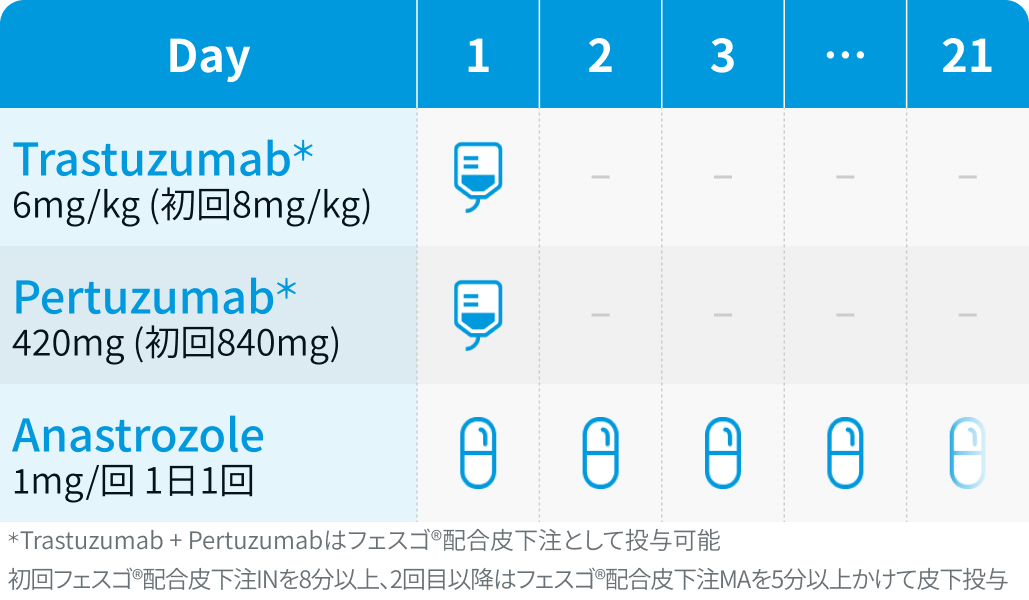
【1コース】21日間
【催吐性】最小度
【FN発症】低リスク*
*PERTAIN試験⁴⁾のFN発生率3.1%を基に編集部が分類 (導入化学療法施行例を含むことに留意)
または
PERTAIN試験⁴⁾のプロトコルを基に編集部作図
トラスツズマブ (初回8mg/kg、 以降3週ごとに6mg/kg) +静注ペルツズマブ (初回840mg、 以降3週ごとに420mg) +経口アナストロゾール (1mg/日) またはレトロゾール (2.5mg/日)。
Key Data|臨床試験結果
📊 PERTAIN試験
J Clin Oncol. 2018;36(28):2826-2835.
HER2陽性かつホルモン受容体陽性の転移性/局所進行乳癌患者258例を対象とした、 1次治療としてペルツズマブ+トラスツズマブ+アロマターゼ阻害剤 (AI) とトラスツズマブ+AIを比較するオープンラベルの無作為化第II相試験。 無作為割付後に、 パクリタキセルまたはドセタキセルによる導入化学療法 (18~24週間) の併用も可能とされた。 主要評価項目はPFSであり、 術後補助内分泌療法後の無治療期間および導入化学療法の有無により層別化された。
【有効性】ペルツズマブ併用群 (vs 非併用群)
- PFS中央値: 18.9ヵ月 (vs 15.8ヵ月)
- ハザード比 (HR) 0.65 (95%CI 0.48–0.89)
- 導入化学療法あり : HR 0.75 (0.50–1.13)
- 導入化学療法なし : HR 0.55 (0.34–0.88)
- 術後内分泌療法後12ヵ月未満 : HR 0.79 (0.42–1.52)
- 術後内分泌療法後12ヵ月以上 : HR 0.50 (0.27–0.91)
- 術後内分泌療法なし : HR 0.71 (0.46–1.09)
- 奏効率: 63.3% (vs 55.7%)
- 奏効期間中央値: 27.1ヵ月 (vs 15.1ヵ月)
【安全性】主な有害事象
- 全Grade
- 下痢 55.1%
- 脱毛症 28.3%
- 悪心 32.3%
- 無力症 30.7%
- 関節痛 29.1%
- 末梢性浮腫 24.4%
- 嘔吐 22.8%
- 貧血 20.5%
- 頭痛 17.3%
- 発疹 17.3%
- 呼吸困難 15.0%
- 食欲減退 15.7%
- 浮動性めまい 15.0%
- 骨痛 12.6%
- 不安 9.4%
- 筋痙縮 9.4%
- 排尿障害 7.1%
- 過敏症 5.5%
- Grade≧3
- 高血圧 10.2%
- 下痢 7.1%
- 好中球減少症 3.1%
- 貧血 3.9%
- 無力症 3.1%
- 発熱性好中球減少症 3.1%
- 肺炎 3.9%
- 駆出率減少 2.4%
- 高血糖 0.8%
- デバイス関連感染 0.8%
- 高血圧クリーゼ 1.6%
- 低カリウム血症 2.4%
- 左室機能不全 2.4%
- 白血球減少症 0.8%
- 腹痛 0.8%
- 丹毒 0.8%
- 疲労 1.6%
- 胃腸炎 1.6%
- 粘膜炎 0.8%
- 末梢神経障害 1.6%
- 好中球減少性敗血症 0.8%
- 感覚異常 1.6%
- 肺塞栓症 0.8%
- 失神 0.8%
- 体重増加 0.8%
各プロトコル
適格基準
PERTAIN試験⁴⁾の主な適格基準
- 閉経後の患者
- HER2陽性かつホルモン受容体陽性の疾患
- ECOG PS 0~1
- LVEF≧50%
心毒性のモニタリングと対応
抗HER2療法には心毒性のリスクがあり、 LVEFの定期的なモニタリングが推奨される。 モニタリング頻度の目安は以下のとおり¹⁾³⁾。
- 治療開始前に1回
- 術前療法中に1回
- 術後療法中および転移・再発例では12週ごと
LVEFが40%未満、 または40~45%かつベースラインから10%以上低下した場合は抗HER2療法を中止し、 必要に応じて3週以内に再評価。 回復しなければ中止を継続。
PERTAIN試験⁴⁾のプロトコルを引用
レジメンの特徴と注意点
本レジメンの位置付け
PERTAIN試験⁴⁾では、 ペルツズマブ併用群においてPFSの有意な延長が認められたものの、 導入化学療法の有無によるサブグループ解析では、 導入化学療法を併用した場合にはPFSに有意差はなく、 導入化学療法を行わなかった場合にPFSの延長が示された。 乳癌診療ガイドライン2022年版では、 PERTAIN試験を含むDual HER2-blockade+アロマターゼ阻害薬の試験はいずれも内分泌療法単独群を対照とせず、 標準1次治療 (トラスツズマブ+ペルツズマブ+タキサン) との比較が行われていないため、 その適応にあたっては慎重なshared decision makingが求められるとされている。 また、 化学療法の適応とならないHER2陽性・ホルモン受容体陽性の転移・再発乳癌に対しては、 抗HER2療法と内分泌療法の併用を弱く推奨している⁵⁾。
投与延期時の対応
- トラスツズマブ再開時は、 前回投与から6週間未満であれば6mg/kg、 6週間以上空いた場合は8mg/kgとする¹⁾。
この対応はペルツズマブとの併用時に限るため注意。
- ペルツズマブ再開時は、 前回投与から6週間未満であれば420mg、 6週間以上空いた場合は840mgとする¹⁾。
- フェスゴ®再開時は、 前回投与から6週間未満であれば維持投与量 (MA)、 6週間以上空いた場合は初回投与量 (IN) とする²⁾³⁾。
RMP【重要な特定されたリスク】
フェスゴ®医薬品リスク管理計画書 (RMP)
- 心機能障害 (左室機能不全・心不全)
- 過敏症・アナフィラキシー
- 骨髄抑制
- 間質性肺疾患
- Infusion reaction
- 腫瘍崩壊症候群
- 肝不全・肝障害
- 腎障害
- 昏睡・脳血管障害・脳浮腫
- 感染症
出典
- 中外製薬株式会社. パージェタ点滴静注420mg/14mL 適正使用ガイド. 2024年12月改訂.
- 中外製薬株式会社. フェスゴ配合皮下注 MA/フェスゴ配合皮下注 IN 電子添文. 2023年11月改訂 (第2版).
- 中外製薬株式会社. フェスゴ配合皮下注 MA/フェスゴ配合皮下注 IN 適正使用ガイド. 2024年9月改訂.
- J Clin Oncol. 2018;36(28):2826-2835.
- 日本乳癌学会編. 乳癌診療ガイドライン2022年版.
最終更新日 : 2025年7月14日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
Trastuzumab + Pertuzumab + Aromatase Inhibitor
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬の外部サイトへ遷移します
- アリミデックス® (添付文書)
- フェマーラ® (添付文書)
投与スケジュール
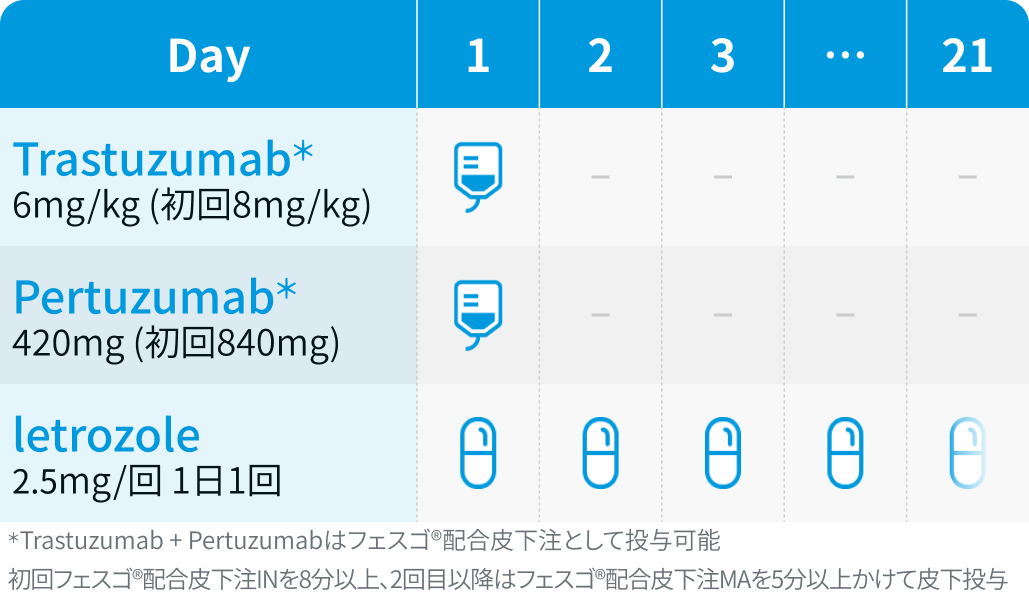
【1コース】21日間
【催吐性】最小度
【FN発症】低リスク*
*PERTAIN試験⁴⁾のFN発生率3.1%を基に編集部が分類 (導入化学療法施行例を含むことに留意)

または

PERTAIN試験⁴⁾のプロトコルを基に編集部作図
トラスツズマブ (初回8mg/kg、 以降3週ごとに6mg/kg) +静注ペルツズマブ (初回840mg、 以降3週ごとに420mg) +経口アナストロゾール (1mg/日) またはレトロゾール (2.5mg/日)。
Key Data|臨床試験結果
📊 PERTAIN試験
J Clin Oncol. 2018;36(28):2826-2835.
HER2陽性かつホルモン受容体陽性の転移性/局所進行乳癌患者258例を対象とした、 1次治療としてペルツズマブ+トラスツズマブ+アロマターゼ阻害剤 (AI) とトラスツズマブ+AIを比較するオープンラベルの無作為化第II相試験。 無作為割付後に、 パクリタキセルまたはドセタキセルによる導入化学療法 (18~24週間) の併用も可能とされた。 主要評価項目はPFSであり、 術後補助内分泌療法後の無治療期間および導入化学療法の有無により層別化された。
【有効性】ペルツズマブ併用群 (vs 非併用群)
- PFS中央値: 18.9ヵ月 (vs 15.8ヵ月)
- ハザード比 (HR) 0.65 (95%CI 0.48–0.89)
- 導入化学療法あり : HR 0.75 (0.50–1.13)
- 導入化学療法なし : HR 0.55 (0.34–0.88)
- 術後内分泌療法後12ヵ月未満 : HR 0.79 (0.42–1.52)
- 術後内分泌療法後12ヵ月以上 : HR 0.50 (0.27–0.91)
- 術後内分泌療法なし : HR 0.71 (0.46–1.09)
- 奏効率: 63.3% (vs 55.7%)
- 奏効期間中央値: 27.1ヵ月 (vs 15.1ヵ月)
【安全性】主な有害事象
- 全Grade
- 下痢 55.1%
- 脱毛症 28.3%
- 悪心 32.3%
- 無力症 30.7%
- 関節痛 29.1%
- 末梢性浮腫 24.4%
- 嘔吐 22.8%
- 貧血 20.5%
- 頭痛 17.3%
- 発疹 17.3%
- 呼吸困難 15.0%
- 食欲減退 15.7%
- 浮動性めまい 15.0%
- 骨痛 12.6%
- 不安 9.4%
- 筋痙縮 9.4%
- 排尿障害 7.1%
- 過敏症 5.5%
- Grade≧3
- 高血圧 10.2%
- 下痢 7.1%
- 好中球減少症 3.1%
- 貧血 3.9%
- 無力症 3.1%
- 発熱性好中球減少症 3.1%
- 肺炎 3.9%
- 駆出率減少 2.4%
- 高血糖 0.8%
- デバイス関連感染 0.8%
- 高血圧クリーゼ 1.6%
- 低カリウム血症 2.4%
- 左室機能不全 2.4%
- 白血球減少症 0.8%
- 腹痛 0.8%
- 丹毒 0.8%
- 疲労 1.6%
- 胃腸炎 1.6%
- 粘膜炎 0.8%
- 末梢神経障害 1.6%
- 好中球減少性敗血症 0.8%
- 感覚異常 1.6%
- 肺塞栓症 0.8%
- 失神 0.8%
- 体重増加 0.8%
各プロトコル
適格基準
PERTAIN試験⁴⁾の主な適格基準
- 閉経後の患者
- HER2陽性かつホルモン受容体陽性の疾患
- ECOG PS 0~1
- LVEF≧50%
心毒性のモニタリングと対応
抗HER2療法には心毒性のリスクがあり、 LVEFの定期的なモニタリングが推奨される。 モニタリング頻度の目安は以下のとおり¹⁾³⁾。
- 治療開始前に1回
- 術前療法中に1回
- 術後療法中および転移・再発例では12週ごと
LVEFが40%未満、 または40~45%かつベースラインから10%以上低下した場合は抗HER2療法を中止し、 必要に応じて3週以内に再評価。 回復しなければ中止を継続。
PERTAIN試験⁴⁾のプロトコルを引用
レジメンの特徴と注意点
本レジメンの位置付け
PERTAIN試験⁴⁾では、 ペルツズマブ併用群においてPFSの有意な延長が認められたものの、 導入化学療法の有無によるサブグループ解析では、 導入化学療法を併用した場合にはPFSに有意差はなく、 導入化学療法を行わなかった場合にPFSの延長が示された。 乳癌診療ガイドライン2022年版では、 PERTAIN試験を含むDual HER2-blockade+アロマターゼ阻害薬の試験はいずれも内分泌療法単独群を対照とせず、 標準1次治療 (トラスツズマブ+ペルツズマブ+タキサン) との比較が行われていないため、 その適応にあたっては慎重なshared decision makingが求められるとされている。 また、 化学療法の適応とならないHER2陽性・ホルモン受容体陽性の転移・再発乳癌に対しては、 抗HER2療法と内分泌療法の併用を弱く推奨している⁵⁾。
投与延期時の対応
- トラスツズマブ再開時は、 前回投与から6週間未満であれば6mg/kg、 6週間以上空いた場合は8mg/kgとする¹⁾。
この対応はペルツズマブとの併用時に限るため注意。
- ペルツズマブ再開時は、 前回投与から6週間未満であれば420mg、 6週間以上空いた場合は840mgとする¹⁾。
- フェスゴ®再開時は、 前回投与から6週間未満であれば維持投与量 (MA)、 6週間以上空いた場合は初回投与量 (IN) とする²⁾³⁾。
RMP【重要な特定されたリスク】
フェスゴ®医薬品リスク管理計画書 (RMP)
- 心機能障害 (左室機能不全・心不全)
- 過敏症・アナフィラキシー
- 骨髄抑制
- 間質性肺疾患
- Infusion reaction
- 腫瘍崩壊症候群
- 肝不全・肝障害
- 腎障害
- 昏睡・脳血管障害・脳浮腫
- 感染症
出典
- 中外製薬株式会社. パージェタ点滴静注420mg/14mL 適正使用ガイド. 2024年12月改訂.
- 中外製薬株式会社. フェスゴ配合皮下注 MA/フェスゴ配合皮下注 IN 電子添文. 2023年11月改訂 (第2版).
- 中外製薬株式会社. フェスゴ配合皮下注 MA/フェスゴ配合皮下注 IN 適正使用ガイド. 2024年9月改訂.
- J Clin Oncol. 2018;36(28):2826-2835.
- 日本乳癌学会編. 乳癌診療ガイドライン2022年版.
最終更新日 : 2025年7月14日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。