Tisotumab vedotin
チソツマブ ベドチン (テブダック®)
「がん化学療法後に増悪した進行または再発の子宮頸癌」 を対象として、 2024年5月に承認申請、 2025年3月27日に正式承認。 薬価は同年5月21日に収載され (40mg 1瓶 : 25万2,241円、 1日薬価 : 3万29円)、 同日より販売が開始された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
組織因子標的抗体微小管阻害薬複合体 チソツマブ ベドチン
*ジェンマブ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】3週間
【催吐性】 軽度*
【FN発症】低リスク**
*NCCN Guidelines Version 1.2025 Antiemesisより引用
**innovaTV 301試験³⁾のFN発生率0.8%を基に編集部が分類

通常、 成人にはチソツマブ ベドチン (遺伝子組換え) として1回2mg/kg (体重) を30分以上かけて、 3週間間隔で点滴静注する。 ただし、 1回量として200mgを超えないこと。 なお、 患者の状態により適宜減量する。
1次治療、術後補助療法における有効性及び安全性は確立していない。 テブダック®添付文書 (2025年3月作成 第1版)より引用
エキスパートによるワンポイント
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
進行・再発子宮頸癌のセカンドライン
Tisotumab vedotinは、 組織因子 (TF ; Tissue factor) に対するモノクロナール抗体に、 微小管阻害剤のvedotinをペイロードとして結合した新規抗体薬物複合体 (ADC ; Antibody-drug conjugate) である。
進行・再発子宮頸癌のセカンドライン薬物療法として、 新規薬剤のTisotumab vedotinと、 主治医選択の薬物療法 (トポテカン、 ビノレルビン、 ゲムシタビン、 イリノテカン、 ペメトレキセドのいずれか) とのランダム化比較試験³⁾で、 Tisotumab vedotinは、 主要評価項目の全生存期間 (OS)で、 11.5ヵ月対9.5ヵ月と優っていた (HR 0.7; 95%CI 0.54-0.89, P=0.004)。 この結果より、 Tisotumab vedotinは、 子宮頸癌のセカンドラインの標準治療の位置を確立したと言える。
眼副作用 10-30%、 末梢神経障害 35%
Tisotumab vedotinの注意すべき副作用としては、 眼副作用 (結膜炎、 角膜炎、 ドライアイ) があり、 約10-30%に起こる。 重症例 (グレード3以上) になることは少ない (約3%) が、 眼症状に対しては、 眼科医にコンサルテーションできる体制づくりが望ましい。 また、 微小管阻害剤の特徴である末梢神経障害も35%に生じるので注意が必要である。
Key Data|臨床試験結果
innovaTV 301試験³⁾
N Engl J Med. 2024;391(1):44-55.
2次又は3次治療の再発又は転移性子宮頸癌患者502例 (日本人患者101例を含む) を対象に、 チソツマブ べドチンと治験担当医師が選択した化学療法単独独 (トポテカン、 ビノレルビン、 ゲムシタビン、 イリノテカンまたはペメトレキセド) との比較による有効性および安全性の評価を目的とした無作為化非盲検の国際共同第III相臨床試験。 主要評価項目は全生存期間 (OS) であった。
【有効性】 Tisotumab Vedotin群
- ORR
チソツマブ ベドチン群 : 17.8%
化学療法群 : 5.2%
OR 4.0 (2.1~7.6)、 p<0.0001
- mPFS
チソツマブ ベドチン群 : 4.2ヵ月
化学療法群 : 2.9ヵ月
HR 0.67 (0.54~0.82)、 p<0.0001
- mOS
チソツマブ ベドチン群 : 11.5ヵ月
化学療法群 : 9.5ヵ月
HR 0.70 (0.54~0.89)、 p=0.0038
【安全性】 主な有害事象 : 全Grade (≧Grade3)
- 結膜炎 31.2% (0%)
- 末梢性感覚ニューロパチー 28.4% (2.8%)
- 鼻出血 26.0% (0%)
- 便秘 24.8% (1.2%)
- 脱毛症 24.4% (0%)
- 食欲減退 23.6% (0.8%)
- 貧血 23.2% (8.4%)
- 下痢 21.6% (1.6%)
- 角膜炎 15.6% (2.0%)
- ドライアイ 13.2% (0%)
- 尿路感染 13.2% (4.4%)
- 疲労 12.8% (3.6%)
- 悪心 33.2% (0.4%)
- 嘔吐 17.6% (1.6%)
- 発熱 16.8% (0.4%)
- 無力症 16.0% (2.0%)
- 腹痛 13.6% (4.0%)
- そう痒症 10.0% (0.4%)
- 腟出血 10.0% (1.2%)
- 好中球減少症 6.8% (3.6%)
- ALT増加 7.2% (1.6%)
- AST増加 6.8% (0.4%)
- 末梢性浮腫 3.6% (0%)
- FN発生率²⁾: 0.8%
各プロトコル
用量レベル

テブダック®電子添文情報を基に編集部作成
副作用発現時の用量調節基準
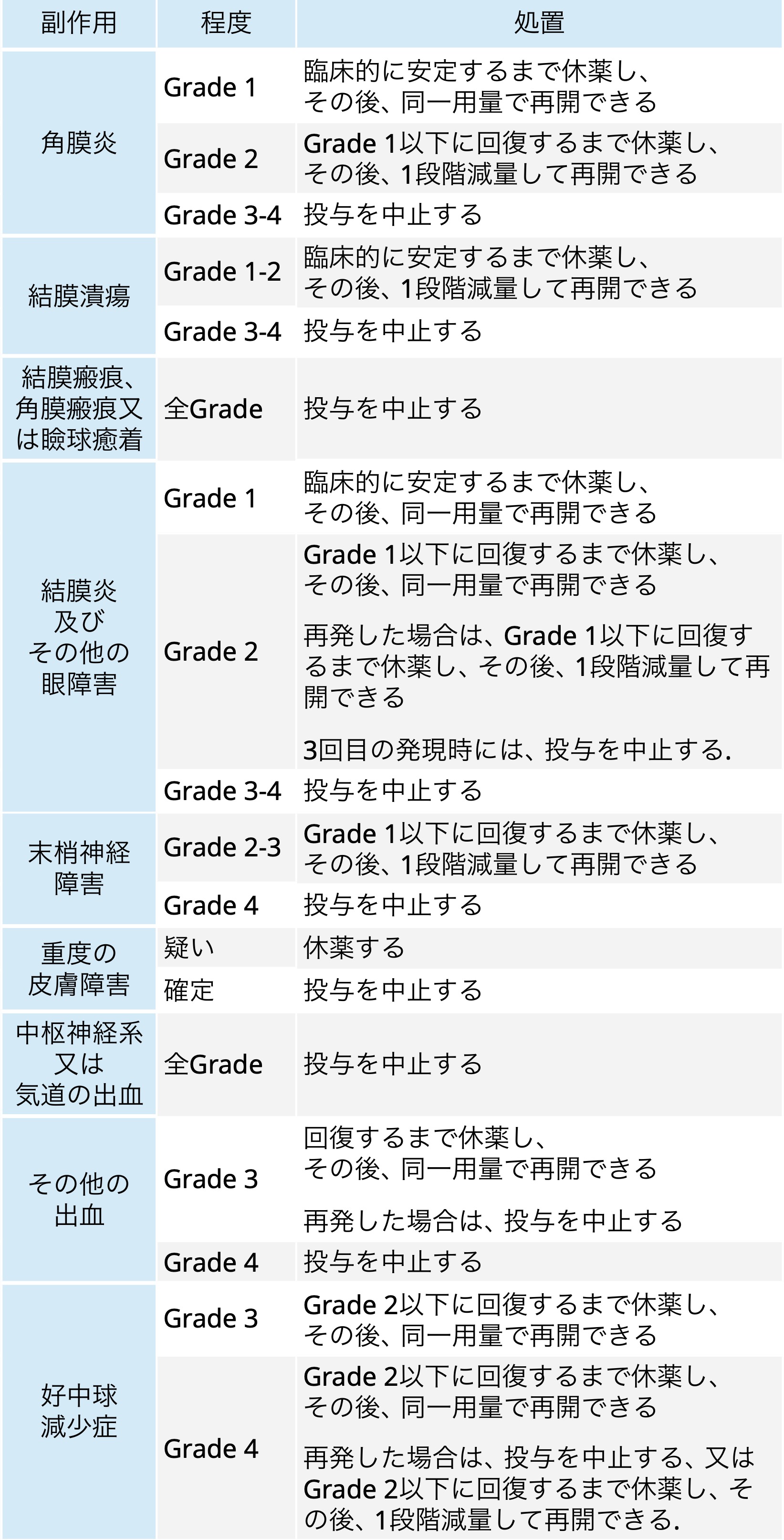
テブダック®電子添文情報を基に編集部作成
特徴と注意点¹⁾²⁾
眼障害軽減目的に点眼薬を併用する
- 副腎皮質ステロイド点眼剤 : 本剤投与の24時間前から4日間投与
日本で使用可能な点眼剤には、 フルオロメトロン (0.02%、 0.05%、 0.1%)、 ベタメタゾンリン酸エステルナトリウム (0.01%、 0.1%)、 デキサメタゾンリン酸エステルナトリウム (0.1%)、 およびデキサメタゾン安息香酸エステルナトリウム (0.02%、 0.05%、 0.1%) がある。
- 血管収縮点眼剤 (ブリモニジン酒石酸塩0.1%) : 本剤投与直前に1~3滴点眼
- ドライアイ治療用点眼剤 : 投与開始日から終了後30日目まで継続投与
日本で使用可能な点眼剤には、 精製ヒアルロン酸ナトリウム (0.1%、 0.3%)、 ジクアホソルナトリウム (3%)、 およびレバミピド (2%) がある。
眼科との連携が必要
- 投与開始前に眼科医の診察を実施
- 投与中は定期的に眼の異常の有無を確認 (問診・視診・眼球運動評価など)
- 異常を認めた場合は早期に眼科受診を指導し、 眼科医による評価を行う
生活指導を行う
- 投与中はコンタクトレンズの装着を避ける
その他の注意事項
【重要な特定されたリスク】は以下のとおり。

テブダック点滴静注用40mgに係る医薬品リスク管理計画書
出典
- テブダック®点滴静注 添付文書 (2025年3月作成 第1版)
- テブダック®点滴静注 適正使用ガイド (2025年3月作成)
- N Engl J Med. 2024;391(1):44-55.
最終更新日 : 2025年5月15日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
Tisotumab vedotin
「がん化学療法後に増悪した進行または再発の子宮頸癌」 を対象として、 2024年5月に承認申請、 2025年3月27日に正式承認。 薬価は同年5月21日に収載され (40mg 1瓶 : 25万2,241円、 1日薬価 : 3万29円)、 同日より販売が開始された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
組織因子標的抗体微小管阻害薬複合体 チソツマブ ベドチン
*ジェンマブ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】3週間
【催吐性】 軽度*
【FN発症】低リスク**
*NCCN Guidelines Version 1.2025 Antiemesisより引用
**innovaTV 301試験³⁾のFN発生率0.8%を基に編集部が分類

通常、 成人にはチソツマブ ベドチン (遺伝子組換え) として1回2mg/kg (体重) を30分以上かけて、 3週間間隔で点滴静注する。 ただし、 1回量として200mgを超えないこと。 なお、 患者の状態により適宜減量する。
1次治療、術後補助療法における有効性及び安全性は確立していない。 テブダック®添付文書 (2025年3月作成 第1版)より引用
エキスパートによるワンポイント
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
進行・再発子宮頸癌のセカンドライン
Tisotumab vedotinは、 組織因子 (TF ; Tissue factor) に対するモノクロナール抗体に、 微小管阻害剤のvedotinをペイロードとして結合した新規抗体薬物複合体 (ADC ; Antibody-drug conjugate) である。
進行・再発子宮頸癌のセカンドライン薬物療法として、 新規薬剤のTisotumab vedotinと、 主治医選択の薬物療法 (トポテカン、 ビノレルビン、 ゲムシタビン、 イリノテカン、 ペメトレキセドのいずれか) とのランダム化比較試験³⁾で、 Tisotumab vedotinは、 主要評価項目の全生存期間 (OS)で、 11.5ヵ月対9.5ヵ月と優っていた (HR 0.7; 95%CI 0.54-0.89, P=0.004)。 この結果より、 Tisotumab vedotinは、 子宮頸癌のセカンドラインの標準治療の位置を確立したと言える。
眼副作用 10-30%、 末梢神経障害 35%
Tisotumab vedotinの注意すべき副作用としては、 眼副作用 (結膜炎、 角膜炎、 ドライアイ) があり、 約10-30%に起こる。 重症例 (グレード3以上) になることは少ない (約3%) が、 眼症状に対しては、 眼科医にコンサルテーションできる体制づくりが望ましい。 また、 微小管阻害剤の特徴である末梢神経障害も35%に生じるので注意が必要である。
Key Data|臨床試験結果
innovaTV 301試験³⁾
N Engl J Med. 2024;391(1):44-55.
2次又は3次治療の再発又は転移性子宮頸癌患者502例 (日本人患者101例を含む) を対象に、 チソツマブ べドチンと治験担当医師が選択した化学療法単独独 (トポテカン、 ビノレルビン、 ゲムシタビン、 イリノテカンまたはペメトレキセド) との比較による有効性および安全性の評価を目的とした無作為化非盲検の国際共同第III相臨床試験。 主要評価項目は全生存期間 (OS) であった。
【有効性】 Tisotumab Vedotin群
- ORR
チソツマブ ベドチン群 : 17.8%
化学療法群 : 5.2%
OR 4.0 (2.1~7.6)、 p<0.0001
- mPFS
チソツマブ ベドチン群 : 4.2ヵ月
化学療法群 : 2.9ヵ月
HR 0.67 (0.54~0.82)、 p<0.0001
- mOS
チソツマブ ベドチン群 : 11.5ヵ月
化学療法群 : 9.5ヵ月
HR 0.70 (0.54~0.89)、 p=0.0038
【安全性】 主な有害事象 : 全Grade (≧Grade3)
- 結膜炎 31.2% (0%)
- 末梢性感覚ニューロパチー 28.4% (2.8%)
- 鼻出血 26.0% (0%)
- 便秘 24.8% (1.2%)
- 脱毛症 24.4% (0%)
- 食欲減退 23.6% (0.8%)
- 貧血 23.2% (8.4%)
- 下痢 21.6% (1.6%)
- 角膜炎 15.6% (2.0%)
- ドライアイ 13.2% (0%)
- 尿路感染 13.2% (4.4%)
- 疲労 12.8% (3.6%)
- 悪心 33.2% (0.4%)
- 嘔吐 17.6% (1.6%)
- 発熱 16.8% (0.4%)
- 無力症 16.0% (2.0%)
- 腹痛 13.6% (4.0%)
- そう痒症 10.0% (0.4%)
- 腟出血 10.0% (1.2%)
- 好中球減少症 6.8% (3.6%)
- ALT増加 7.2% (1.6%)
- AST増加 6.8% (0.4%)
- 末梢性浮腫 3.6% (0%)
- FN発生率²⁾: 0.8%
各プロトコル
用量レベル

テブダック®電子添文情報を基に編集部作成
副作用発現時の用量調節基準

テブダック®電子添文情報を基に編集部作成
特徴と注意点¹⁾²⁾
眼障害軽減目的に点眼薬を併用する
- 副腎皮質ステロイド点眼剤 : 本剤投与の24時間前から4日間投与
日本で使用可能な点眼剤には、 フルオロメトロン (0.02%、 0.05%、 0.1%)、 ベタメタゾンリン酸エステルナトリウム (0.01%、 0.1%)、 デキサメタゾンリン酸エステルナトリウム (0.1%)、 およびデキサメタゾン安息香酸エステルナトリウム (0.02%、 0.05%、 0.1%) がある。
- 血管収縮点眼剤 (ブリモニジン酒石酸塩0.1%) : 本剤投与直前に1~3滴点眼
- ドライアイ治療用点眼剤 : 投与開始日から終了後30日目まで継続投与
日本で使用可能な点眼剤には、 精製ヒアルロン酸ナトリウム (0.1%、 0.3%)、 ジクアホソルナトリウム (3%)、 およびレバミピド (2%) がある。
眼科との連携が必要
- 投与開始前に眼科医の診察を実施
- 投与中は定期的に眼の異常の有無を確認 (問診・視診・眼球運動評価など)
- 異常を認めた場合は早期に眼科受診を指導し、 眼科医による評価を行う
生活指導を行う
- 投与中はコンタクトレンズの装着を避ける
その他の注意事項
【重要な特定されたリスク】は以下のとおり。

テブダック点滴静注用40mgに係る医薬品リスク管理計画書
出典
- テブダック®点滴静注 添付文書 (2025年3月作成 第1版)
- テブダック®点滴静注 適正使用ガイド (2025年3月作成)
- N Engl J Med. 2024;391(1):44-55.
最終更新日 : 2025年5月15日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。




