ポスト
【専門医解説】エピゲノム診断で深化する、大腸癌の個別化医療

DNAメチル化は、 癌抑制遺伝子の機能喪失や治療抵抗性に関与することが知られており、 大腸癌では抗EGFR抗体薬の治療効果予測因子となる可能性が示されている。 本稿では、 2025年6月2日に保険収載されたDNAメチル化アッセイ 「OncoGuide™ EpiLight™メチル化検出キット」 の活用について解説する。
DNAのメチル化とは?
DNAメチル化とは、 DNAの塩基配列 (A、 T、 G、 C) のうち、 シトシン (C) にメチル基 (-CH₃) が付加される化学的修飾である。 特に 「CpG配列」 と呼ばれるシトシンとグアニンが連続する部分に多く生じ、 遺伝子発現を抑制する働きをもつことが知られている¹⁾。
癌細胞では、 癌抑制遺伝子のプロモーター領域 (遺伝子の発現を調節する領域) が異常にメチル化されることで、 その遺伝子の機能が失われ、 癌の発症や進行に関与することが明らかになっている¹⁾。
大腸癌DNAメチル化の臨床的意義
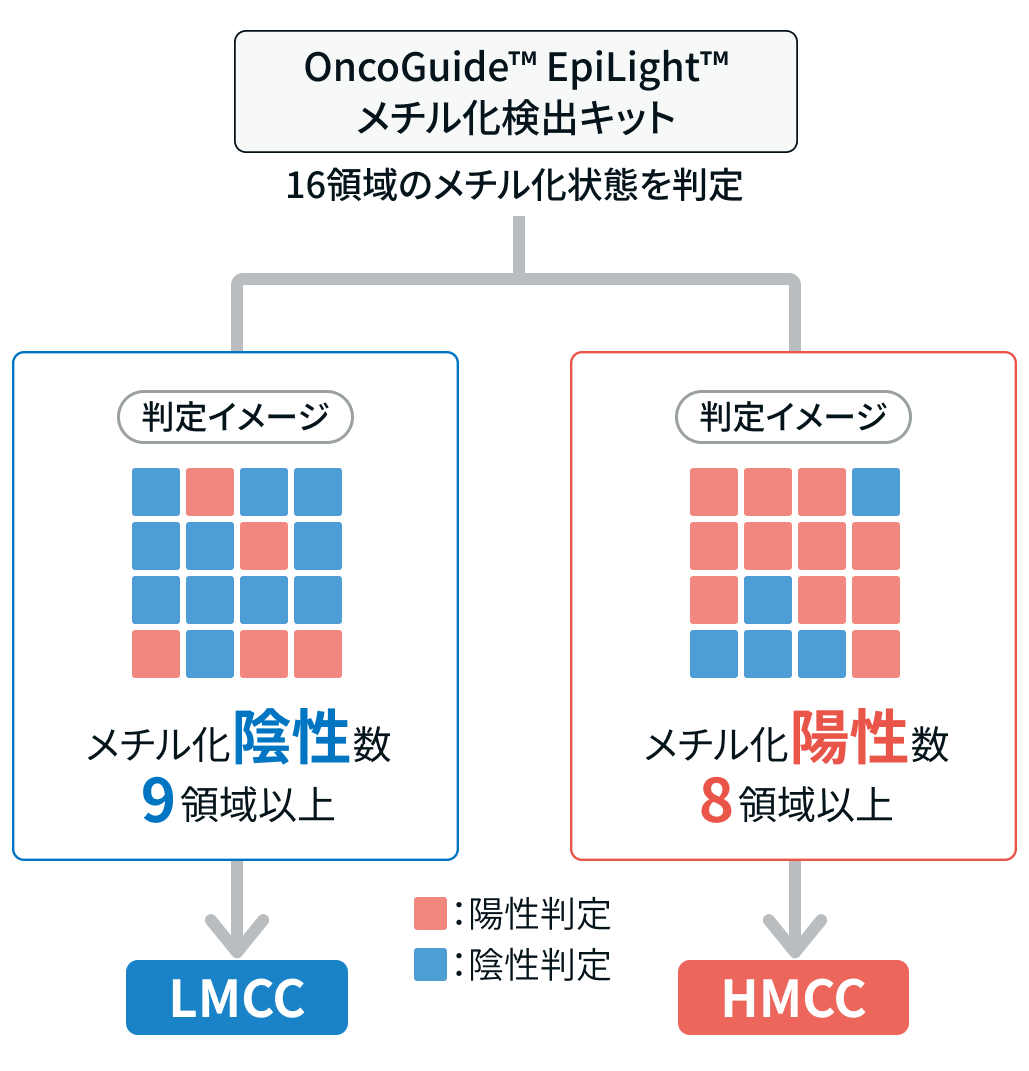
大内らは、 大腸癌におけるゲノム全体のDNAメチル化状態を網羅的に解析した結果、 大腸癌は大きく2つのグループに分類されることを報告している²⁾。 すなわち、 低メチル化型 (LMCC) と高メチル化型 (HMCC) である。
LMCCでは抗EGFR抗体薬に対する治療効果が高い一方、 HMCCでは薬剤感受性が低く治療抵抗性を示すことが、 複数の研究で示されている²⁻⁶⁾。 これにより、 DNAメチル化状態はRAS遺伝子変異とは独立して、 抗EGFR抗体薬の治療効果を予測する因子となりうることが明らかとなっている。
DNAメチル化アッセイが保険収載
OncoGuide™ EpiLight™メチル化検出キットは、 2024年6月に製造販売承認を取得し、 2025年6月より保険収載された。 検査の概要は以下のとおりである。
『国立大学法人東北大学 大腸癌のエピゲノム診断薬 DNA メチル化検出キット 「OncoGuide™ EpiLight™メチル化検出キット」 の保険適用のお知らせ』を基に編集部作成
本キットでは、 DNAメチル化の測定原理として 「バイサルファイト処理」 による化学修飾を用いている。 通常、 非メチル化のシトシンはバイサルファイト処理によりウラシルへ変換されるが、 メチル化されたシトシンは変換されずにそのまま残る。 この処理の前後で生じる塩基配列の違いを解析することで、 DNAメチル化の有無を判定する。
本検査では、 対象となる16領域のうち8領域以上がメチル化陽性であった場合にHMCC、 9領域以上がメチル化陰性であった場合にLMCCと判定される。
My Opinion
Negative hyper selectionの意義
現在、 複数のガイドラインにおいて、 RAS遺伝子変異が認められる症例では抗EGFR抗体薬の有効性が乏しいことから、 治療対象から除外するNegative Selectionの実施が推奨されている。
近年ではこれに加え、 BRAF V600E変異、 ERBB2増幅、 MET増幅・融合など、 複数の遺伝子異常を包括的に検査し、 抗EGFR抗体薬に対する抵抗性が予測される症例をより厳密に除外する 「Negative hyper selection」 という概念が注目されている。
このアプローチにより、 抗EGFR抗体薬の恩恵を最大限に享受できる患者を的確に選別する試みが進められている⁷⁾⁸⁾。
実装上の課題と今後の展望
ただし、 日本では治療前に遺伝子パネル検査を実施できる体制が整っておらず、 臨床での応用は依然として困難である。 今後は、 これらの遺伝子異常に加えてエピゲノム異常も含めたNegative hyper selectionが、 原発部位にとらわれない治療選択の基盤となる可能性がある。
右側結腸・RAS遺伝子およびBRAF V600E野生型で抗EGFR抗体を含む1次治療を行った症例に対する、 Negative hyper selectionの有効性を示すエビデンスは依然として乏しく、 今後の検討結果が待たれる。
まとめ
腫瘍組織のDNAメチル化状態を判定することで、 抗EGFR抗体薬の治療効果が期待できない症例を事前に特定し、 不要な投与や副作用、 費用を回避することは、 大腸癌の個別化医療をさらに進展させる重要な一歩であり、 治療選択の最適化に貢献する可能性がある。
出典
- Proc Natl Acad Sci U S A. 1999;96(15):8681-6.
- Cancer Sci. 2015;106(12):1722-9.
- Int J Colorectal Dis. 2022;37(6):1439-1447.
- J Gastrointest Oncol. 2023;14(2):676-691.
- Int J Colorectal Dis. 2024;39(1):89.
- ESMO Open. 2025;10(5):105076.
- Ann Oncol. 2017;28(12):3009-3014.
- Nat Med. 2024;30(3):730-739.
解説医師

関連コンテンツ
▼海外ジャーナルクラブ
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。









