ポスト
【NEJM】D型肝炎新治療、 tobevibart+elebsiran併用でウイルス抑制が顕著
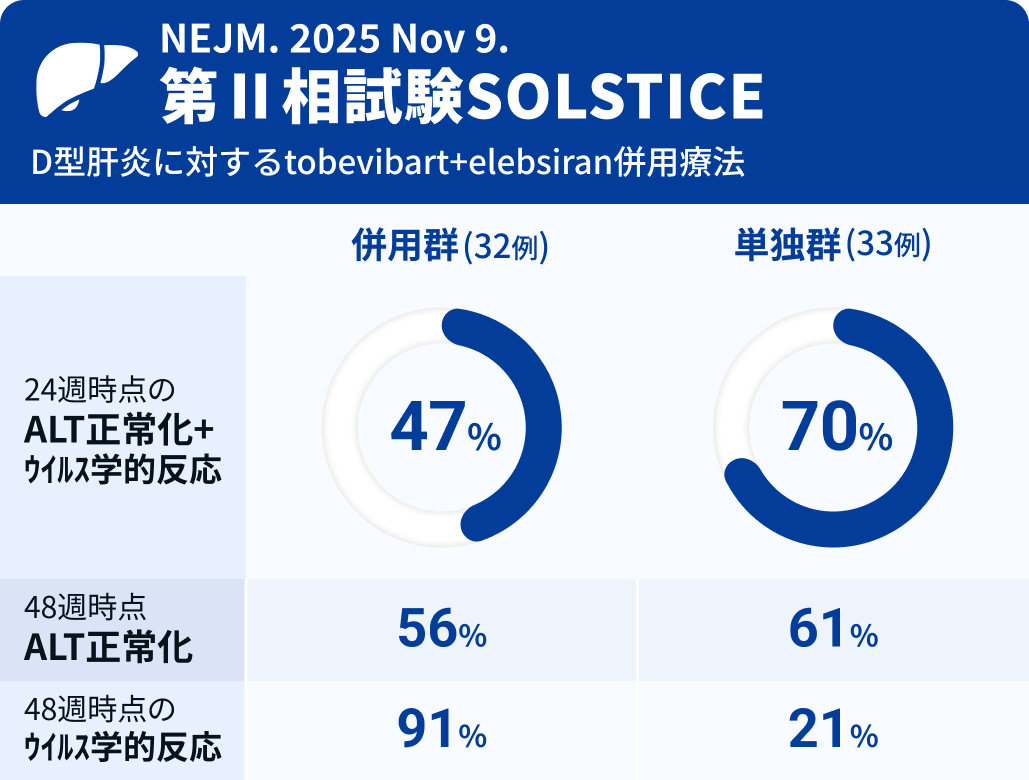
Asselahらは、 D型肝炎への新治療tobevibartおよびelebsiranの有効性・安全性を第Ⅱ相試験SOLSTICEにて評価した。 その結果、 24週時点で、 tobevibartとelebsiranの併用群では47%、 tobevibart単剤群では70%が、 ウイルス学的反応とALT値の正常化を示した。 また、 併用群において、 48週時点では66%でHDV RNAが検出されず、 91%でHBsAg値が10 IU/mL未満となった。 試験結果はNEJM誌に発表された。
📘原著論文
👨⚕️HOKUTO監修医コメント
Tobevibartとelebsiranの併用療法による第III相ECLIPSEプログラムが現在進行中です。
関連コンテンツ
肝炎の劇症化率の予測式
肝線維化リスク評価
背景
B型肝炎ウイルス表面抗原が標的の新薬
Tobevibart (モノクローナル抗体) およびelebsiran (低分子干渉RNA) は、 B型肝炎ウイルス表面抗原のHBsAgを標的とするが、 これら薬剤の慢性D型肝炎ウイルス (HDV) 感染症治療における有効性と安全性は不明である。
研究デザイン
2剤併用群とtobevibart単独群に無作為化
本試験は進行中の第Ⅱ相非盲検試験であり、 参加者をtobevibartとelebsiranを4週間ごとに投与する群と、 tobevibart単剤を2週間ごとに投与する群に無作為に割り付けた。 主要評価項目は、 24週時点における、 ウイルス学的反応 (HDV RNA値が検出限界未満またはベースラインから2 log10 IU/mL以上減少すること) とALT値の正常化を組み合わせた反応とした。
結果
24週時に併用群47%、 単剤群70%が反応
24週時点で、 併用群では47% (32例中15例)、 単剤群では70% (33例中23例) が反応を示した。
- 併用群 : 100% (32例中32例)
- 単独群 : 82% (33例中27例)
ALT値の正常化
- 併用群 : 47% (32例中15例)
- 単独群 : 76% (33例中25例)
48週時に併用群91%がHBsAg<10 IU/mL
48週時点では、 併用群で56% (32例中18例)、 単剤群で61% (33例中20例) が反応を示した。
HDV RNAが検出されない割合
- 併用群 : 66% (32例中21例)
- 単独群 : 48% (33例中16例)
ALT値の正常化
- 併用群 : 56% (32例中18例)
- 単独群 : 61% (33例中20例)
HBsAg値10 IU/mL未満の割合
- 併用群 : 91% (32例中29例)
- 単独群 : 21% (33例中7例)
ALTフレアは認められなかった
ALTフレアはどちらの群でも認められなかった。 48週までに、 併用群の81%、 単剤群の94%が1回以上の有害事象を経験し、 主な内容はインフルエンザ様症状と悪寒であった。
結論
48週でHDV RNAおよびALT値を低下
著者らは、 「tobevibartとelebsiranの併用療法およびtobevibart単剤療法は、 48週までにHDV RNAおよびALT値を低下させた。 Tobevibartとelebsiranの併用療法は、 HDV RNA検出不能およびHBsAg値低下と高い関連を示した」 と報告している。
※X (旧Twitter) の利用規約に基づき、 サブライセンスが認められている埋め込み形式でTweetを紹介しています。 掲載停止のご希望がある場合は、 XのHOKUTO公式アカウント (@HOKUTOmed) までDMでご連絡をお願いします。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
あなたは医師もしくは医療関係者ですか?
HOKUTOへようこそ。当サイトでは、医師の方を対象に株式会社HOKUTOの臨床支援コンテンツを提供しています。